扩展功能
文章信息
- 胡新月, 王德娴, 宋丽雅
- HU Xinyue, WANG Dexian, SONG Liya
- 表皮葡萄球菌对皮肤健康的作用研究进展
- Emerging roles of Staphylococcus epidermidis in skin health
- 微生物学通报, 2023, 50(1): 368-376
- Microbiology China, 2023, 50(1): 368-376
- DOI: 10.13344/j.microbiol.china.220439
-
文章历史
- 收稿日期: 2022-04-28
- 接受日期: 2022-06-24
- 网络首发日期: 2022-08-03
皮肤微生物群由数百万共生微生物组成,是人体第二大微生物群,通过与皮肤之间复杂的沟通维持皮肤健康[1],主要参与皮肤屏障的维持、免疫系统的调节和病原体的防御等环节。表皮葡萄球菌是健康人群皮肤表面微生物群的主要成员之一,作为皮肤微生物群的关键组成影响着皮肤健康。在多种皮肤疾病如脂溢性皮炎[2]、痤疮[3]和特应性皮炎[4]中发现表皮葡萄球菌丰度失衡,更说明表皮葡萄球菌作为皮肤共生菌对于皮肤具有重大作用。本文介绍了表皮葡萄球菌分布和基本特性,总结表皮葡萄球菌在皮肤免疫调节、屏障保护、抗菌防御及促进伤口愈合等方面的重要作用,以期为表皮葡萄球菌今后的应用提供论据支持。
1 表皮葡萄球菌概述表皮葡萄球菌(Staphylococcus epidermidis)属于厚壁菌门(Firmicutes)微球菌科(Micrococaceae)葡萄球菌属(Staphylococcus),是一种相对疏水的革兰氏阳性兼性厌氧菌。表皮葡萄球菌在自然界广泛分布,最适生长温度为30−37 ℃,不产生血浆凝固酶和α溶血素等毒性物质,因而绝大多数S. epidermidis不致病,仅少数可引起人和动物的化脓性感染[5]。S. epidermidis还在皮肤表面广泛存在,位于皮肤角质层,在干燥、潮湿和皮脂腺区域的表皮基底膜中可见[6]。Grice等[7]通过对10名健康志愿者20个不同皮肤部位微生物组成的研究发现,葡萄球菌属占皮肤总细菌丰度的16.8%,其中S. epidermidis占体表葡萄球菌的65%−90%[8]。S. epidermidis与角质形成细胞紧密结合,可以通过多种分泌物与角质形成细胞进行沟通,通常被认为是皮肤的共生细菌,它们在健康条件下无害,而且可以对皮肤产生有益影响[9]。在正常生理环境下,共生的S. epidermidis可以调节皮肤免疫、维持皮肤屏障功能,并通过刺激先天性宿主防御或直接的细菌干扰来控制病原微生物的过度生长,加速伤口愈合,对皮肤发挥着良性作用。同时,共生葡萄球菌的减少可能会降低它们对皮肤的益处并导致皮肤老化[10]。维持S. epidermidis的相对丰度和多样性可能是皮肤健康的一个关键因素[11]。
2 表皮葡萄球菌调节皮肤免疫调节皮肤免疫是皮肤微生物维持皮肤健康的重要一环。皮肤微生物失衡时就可能会引起皮肤免疫系统的紊乱,从而导致皮肤疾病,如特应性皮炎通常被认为与金黄色葡萄球菌过度增殖引发的皮肤炎症有关[4]。然而S. epidermidis对于调节皮肤免疫系统有重要的作用,不仅可以通过抗菌肽参与皮肤的固有免疫,还有助于适应性免疫的发育和启动。
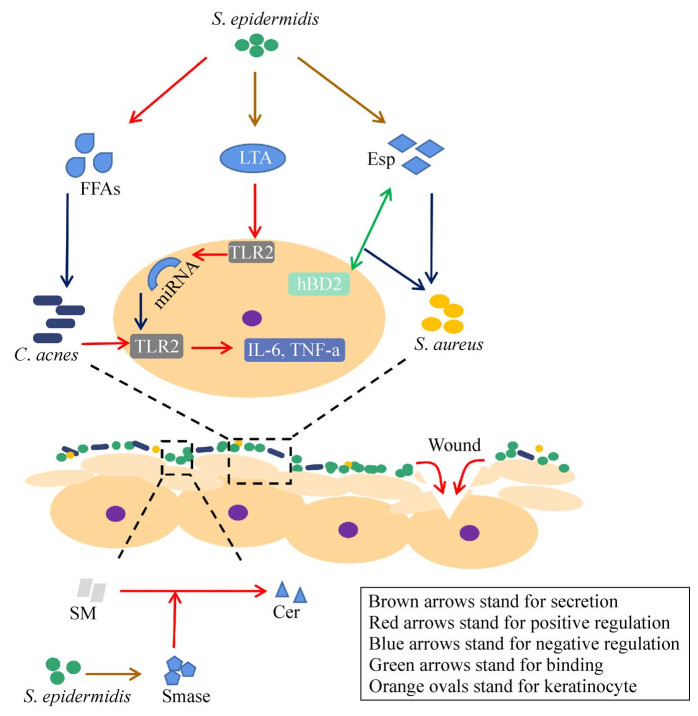
2.1 固有免疫固有免疫又称先天免疫,可以识别病原体所共有的一些特定结构或病原体相关分子,从而激活免疫信号,导致炎症反应的发生。皮肤驻留淋巴细胞亚群参与了固有免疫反应[12],T细胞亚群作为其中的一员有靶特异性和协调高度动态的免疫反应的特点。共生皮肤菌的定殖促进皮肤内各种T细胞亚群的积累[13]。人类表皮由多层复层上皮组成,其中角质形成细胞是参与抵抗微生物病原体的主要细胞群[9]。角质形成细胞通过产生细胞因子、趋化因子[14]和抗菌肽(antimicrobial peptides, AMPs)积极参与先天免疫反应。S. epidermidis可以通过AMPs激活人角质形成细胞中独特的固有免疫信号通路。因为AMPs对广谱的革兰氏阳性和革兰氏阴性细菌以及一些真菌和包膜病毒具有活性,在皮肤上它是抵抗病原微生物感染的第一道防线[15]。AMPs在响应微生物刺激(例如,病原体相关分子或促炎刺激)时表达,人类角质形成细胞产生的最丰富的AMPs是人β-防御素(human β-defensin, HBD)[16]。S. epidermidis可激活人角质形成细胞中独特的固有免疫信号通路,增强AMPs介导的对金黄色葡萄球菌的杀伤作用,增强角质形成细胞对金黄色葡萄球菌的固有免疫反应[17]。Toll样受体(Toll-like receptors, TLR)是跨膜受体家族,其信号控制细胞增殖、存活、凋亡、血管生成、重塑和组织修复的细胞过程,可识别病原体的相关分子,并激活机体的免疫应答,TLR基因的多态性可以改变促炎性和抗炎性细胞因子之间的平衡,降低感染、慢性炎症和癌症的风险[18]。S. epidermidis细胞壁成分脂磷壁酸(lipoteichoic acid, LTA)通过TLR2依赖性机制抑制角质形成细胞释放炎性细胞因子和皮肤损伤引发的炎症[19]。
2.2 适应性免疫除了对皮肤感染或损伤的先天性免疫应答的调节外,S. epidermidis定殖还有助于适应性免疫系统的发育和启动。Linehan等[20]的研究表明,S. epidermidis通过树突状细胞的抗原递呈诱导皮肤中CD8+ T细胞的聚集,从而也加速了皮肤伤口修复。一些S. epidermidis菌株还可以抑制金黄色葡萄球菌诱导的中性粒细胞募集和促炎细胞因子的产生[21],共生的S. epidermidis对皮肤定殖可以促进皮肤的抗病毒特征[22]。综上所述,S. epidermidis对于启动对病原体的先天性和适应性免疫防御及促进皮肤免疫系统的正常运行具有重要意义。
3 表皮葡萄球菌维护皮肤屏障除可以通过免疫过程保护皮肤免受微生物侵袭外,皮肤本身也是一个物理屏障,其完整性对其防御功能至关重要。对皮肤物理屏障来说,最重要的是其外层,即角质层是由角质细胞组成,在角质细胞增殖、分化及向皮肤表面迁移后,角质细胞逐渐嵌入脂质的皮肤基质中。鞘磷脂和神经酰胺都是皮肤脂质的成分,神经酰胺可以维护皮肤屏障,保持皮肤水分;角质层对于皮肤的屏障功能至关重要,可以防止水和电解质的流失,以及有害物质的渗透[23]。近期有研究表明,共生S. epidermidis通过协助宿主产生神经酰胺(ceramides, Cer)来促进皮肤屏障的平衡,并确定其基本机制是S. epidermidis分泌的鞘磷脂酶(sphingomyelinase, Smase)可以通过分解鞘磷脂(sphingomyelin, SM)产生神经酰胺;此外,这种鞘磷脂酶为S. epidermidis提供营养物质,并显著促进了S. epidermidis的皮肤定殖能力[23]。这也证明了S. epidermidis具有潜在的治疗作用,可以促进物理性皮肤屏障的稳态。
S. epidermidis的代谢产物,比如甘油和有机酸等可以改善皮肤保湿性,维持皮肤表面的低酸性状态,改善粗糙的皮肤纹理[24]。Nodake等[25]通过将来自受试者皮肤的S. epidermidis增殖培养后,连续应用于受试者自身面部,以增加S. epidermidis定殖水平,结果表明,此过程增加了皮肤的脂质含量,抑制了皮肤水分流失,从而显著改善了皮肤的保湿性。此外,表皮葡萄球菌的增加维持了皮肤表面的低酸性条件,通过测量红斑和黑色素水平也证实了表皮葡萄球菌导致皮肤不良反应的风险较低[25]。
紧密连接(tight junctions, TJs)是皮肤屏障内的细胞间连接,共生S. epidermidis激活TLR2可以在体外培养的角质形成细胞中增加紧密连接作用,有助于保持皮肤屏障内的稳态[26]。TJs作为物理屏障,是由紧密连接蛋白(claudins)、闭合蛋白(occluding)和胞质紧密连接蛋白(ZO)等关键屏障蛋白组成的细胞间紧密连接,尽管人们对角质层的了解非常广泛,但直到2000年才认识到它的存在[26]。有研究[26]证明,共生S. epidermidis对TLR2的激活增强了培养的人角质形成细胞中TJs的功能,具体机制是激活TLR2使得对TJs生物发生至关重要的磷酸化非典型蛋白激酶Cζ/ι与闭合蛋白(occluding)的结合性增加,而且抑制非典型蛋白激酶Cζ/ι活性可完全阻断TJs相关屏障蛋白的升高。
近期有研究建议将皮肤定殖菌作为益生菌局部应用于皮肤,以根除潜在有害的病原体[27]。由于S. epidermidis是一种天然的皮肤定殖菌,对于维持皮肤屏障的稳态发挥了重要作用,可以应用高产鞘磷脂酶的S. epidermidis作为益生菌菌株,或者利用基因改造技术改造该益生菌,这可能对于恢复皮肤屏障方面的护肤或相关医疗领域有一定发展空间。
4 表皮葡萄球菌的抗菌防御皮肤微生物群作为皮肤生态系统的一部分,不仅与皮肤细胞相互沟通,而且在不同微生物之间也具有相互作用,这是维持皮肤微生态平衡稳定的重要因素。S. epidermidis作为共生菌具有占位功能,可以通过抗菌肽等产生一定的防御功能,从而保护皮肤免受病原体侵害。此外,S. epidermidis还可以通过塑造宿主免疫和协助刺激宿主免疫应答来防御病原微生物的定殖。
4.1 表皮葡萄球菌抑制金黄色葡萄球菌生物活性金黄色葡萄球菌(Staphylococcus aureus)与S. epidermidis同属于葡萄球菌属,但这两种菌有很大差异,S. aureu定殖可能会引起皮肤免疫失衡及屏障破坏,S. aureus也经常被作为共生表皮葡萄球菌的对照菌株。大多数自由生活的细菌附着在宿主表面并聚集在一起形成多细胞群落,包裹在被称为生物膜的细胞外聚合物组成的黏性基质中[28]。据估计,人类中80%的微生物感染是微生物生物膜导致的直接结果[29]。S. epidermidis抑制S. aureu的生物活性主要是通过抑制S. aureu生物膜的产生或直接破坏已有生物膜。S. epidermidis能够抑制毒力状态的S. aureus致病菌形成生物膜的黏附[30],主要是通过分泌细菌素来阻止其生物膜形成并破坏生物膜。细菌素是微生物在定殖过程中释放的大量生物活性小分子,可以提高单个菌株与其他微生物竞争的适应性[31]。通过对金黄色葡萄球菌的体外抗菌和细胞实验发现,表皮葡萄球菌培养上清液能够显著抑制金黄色葡萄球菌的生长,并诱导角质形成细胞分泌的白细胞介素(interleukin, IL)-1α和IL-6[32]。
共生的S. epidermidis分泌的内肽酶丝氨酸蛋白酶(extracellular serine protease, Esp)也可以抑制S. aureus生物膜形成和鼻腔定殖[33]。纯化的Esp不仅可以抑制S. aureus生物膜的形成,而且可以破坏预先存在的生物膜;此外,Esp还增强了生物膜中S. aureus对免疫系统成分的敏感性;HBD2是由角质形成细胞分泌的一种抗菌肽成分,HBD2单独使用时对生物膜中的S. aureus的杀菌活性较低,Esp也并无杀菌活性[33]。然而,当HBD2与Esp结合时,HBD2可以有效杀死生物膜中的S. aureus[34]。Bitschar等[21]证明了S. epidermidis可以减少S. aureus感染诱导的中性粒细胞募集,对S. aureus定殖的皮肤有一定的保护作用[35]。
4.2 表皮葡萄球菌抑制痤疮丙酸杆菌生物活性痤疮丙酸杆菌(Cutibacterium acnes)也是一种皮肤共生菌,与S. epidermidis一起作为皮肤微生物群的基本组成部分。但不同的是C. acnes是一种厌氧菌,而S. epidermidis是一种需氧兼性厌氧菌,生长在需氧环境中时能够利用发酵产生酸性物质抑制C. acnes的生长。而且S. epidermidis不仅可以调节C. acnes的生长,还可以通过将甘油发酵成醋酸、丁酸、乳酸和琥珀酸等短链脂肪酸(FFAs)来抑制C. acnes生物膜的形成[36]。微小RNA (micro RNA, miRNA)是小的非编码单链RNA分子,在动植物和病毒中普遍存在,通过调控基因的表达发挥作用。角质形成细胞上TLR的激活将触发表皮中促炎细胞因子的不当产生,这是几种皮肤病发病机制中的一个因素[37-39]。S. epidermidis的LTA可以激活角质形成细胞中由TLR2诱导产生的miRNA-143[40]。miRNA-143也会反过来降低TLR2的mRNA及蛋白质的稳定性,从而抑制C. acnes诱导的促炎细胞因子IL-6和TNF-α的产生[40],减轻由C. acnes引发的炎症反应。
正常情况下,角质形成细胞和黑素细胞分泌的多种可溶性介质共同维持着表皮微环境的稳态[41]。Wang等[42]的研究表明,C. acnes可以抑制UVB照射的黑素细胞存活,UVB辐射是以剂量依赖性的方式减少了C. acnes衍生的卟啉的产生,并增加了UVB对黑素细胞的诱导凋亡活性。S. epidermidis在紫外线照射后对黑素细胞的发育表现出保护作用,这抵消了C. acnes的负面影响[43]。这些研究表明,当暴露在紫外线下时,S. epidermidis和C. acnes之间存在拮抗作用。
4.3 表皮葡萄球菌抑制化脓性链球菌抗菌肽在宿主防御病原体方面一直发挥着重要作用[44],AMPs在多种细胞类型中都很重要,包括但不限于巨噬细胞、中性粒细胞、肥大细胞和上皮细胞。病原体通过宿主分泌机制和吞噬作用与AMPs接触[45]。S. epidermidis酚溶性调节蛋白(phenol-soluble modulin, PSMs)是一种α-螺旋肽,在正常表皮和毛囊中大量产生,它被证明可以与脂膜相互作用,形成复合物并发挥抗菌活性。使用小鼠伤口模型证明了PSMs可以与宿主AMPs协同作用,从而增强杀灭病原体化脓性链球菌的能力[45]。
5 表皮葡萄球菌促进伤口愈合皮肤是与外界环境直接接触的体表面积最大的器官,保护人类免受多种可能的物理、机械、化学和生物攻击。在此前提下,皮肤因外界环境而受到损伤的可能性很大,如果皮肤损伤未得到妥善修复,可能会导致感染、疼痛和不必要的后遗症,以及疤痕的形成。皮肤伤口愈合是一个动态复杂的过程,是重建皮肤屏障的过程,细分的步骤为炎症、增殖和组织重塑[46]。Linehan等[20]研究了皮肤微生物群与皮肤免疫细胞的相互作用,证明了S. epidermidis诱导的CD8+ T细胞促进了受影响皮肤的再上皮化,并加速了伤口修复。与患有皮肤病的成年人相比,健康患者的皮肤定殖菌中S. epidermidis菌株富集;通过分析S. epidermidis基因组并结合体外实验表明,树突状细胞上的主要组织相容性复合体Ib (major histocompatibility complex Ib, MHCIb)将S. epidermidis分泌的N-甲酰甲硫氨酸肽呈现给CD8+ T细胞[20]。此外,对S. epidermidis局部作用诱导的CD8+ T细胞进行了RNA测序,整体转录组特征的分析发现CD8+ T淋巴细胞上调了与免疫调节相关及组织修复相关的基因[20]。在最近的一项研究中,Nakatsuji等[47]发现微生物群可以防止皮肤肿瘤的发展。表皮葡萄球菌产生一种具有抗肿瘤活性的分子(6-N-羟基氨基嘌呤),这种分子在体内可以选择性地抑制黑色素瘤生长,而且无毒性[47]。
目前尚不清楚表皮葡萄球菌生物膜是否会影响伤口愈合。由于伤口可能有多种细菌,其他细菌及其与表皮葡萄球菌的相互作用如何影响伤口愈合,以及参与皮肤愈合的皮肤共生微生物群与皮肤细胞之间的相互作用都有待揭示。
6 总结与展望近年来,随着测序技术的不断发展,研究者对皮肤微生物组的认识越来越深入,发现皮肤微生物和皮肤健康关系紧密。S. epidermidis作为皮肤上的优势菌,对于维持皮肤健康尤为重要。本文总结了S. epidermidis在调节皮肤免疫应答、维护皮肤屏障、抗菌防御和促进伤口愈合中(图 1)的作用,表明大多数S. epidermidis菌株可以维护皮肤健康平稳的状态。同时,S. epidermidis也会引发疾病,如其失衡引起的皮肤问题及手术后感染等。目前,研究者更关注这些皮肤共生微生物的致病作用,对其有益作用的探究还需要进一步深入。S. epidermidis作为一种天然的皮肤定殖菌,在应用其作为益生菌菌株方面还有很大的发展空间。S. epidermidis菌株水平的多样性及其如何调控共生定殖、皮肤与细菌间的相互作用等方面都值得深入探索。
|
| 图 1 表皮葡萄球菌与角质形成细胞及其他细菌的相互作用机制 Figure 1 Mechanism of interaction of Staphylococcus epidermidis with keratinocyte and other bacteria. |
|
|
| [1] |
BALDWIN HE, BHATIA ND, FRIEDMAN A, ENG RM, SEITE S. The role of cutaneous microbiota harmony in maintaining a functional skin barrier[J]. Journal of Drugs in Dermatology: JDD, 2017, 16(1): 12-18. |
| [2] |
ZHONG CM, ZHENG XF, HUANG TY, PAN HJ, DENG YH, HE RL. Macrogenomic analysis of flora changes in facial seborrheic dermatitis[J]. Journal of Diagnosis and Therapy on Dermato-Venereology, 2020, 27(4): 241-246. (in Chinese) 钟彩梅, 郑秀芬, 黄桃源, 潘惠娟, 邓裕华, 何仁亮. 宏基因组分析面部脂溢性皮炎的菌群变化[J]. 皮肤性病诊疗学杂志, 2020, 27(4): 241-246. DOI:10.3969/j.issn.1674-8468.2020.04.006 |
| [3] |
ZHENG YM, MENG RL, PENG HY, JIANG R, SONG LY, DONG K, HE CF. Variation of skin microbial community in adolescent acne[J]. Microbiology China, 2019, 46(12): 3414-3423. (in Chinese) 郑玉梅, 孟若琳, 彭海悦, 蒋锐, 宋丽雅, 董坤, 何聪芬. 青少年痤疮面部皮肤微生物群落结构变化[J]. 微生物学通报, 2019, 46(12): 3414-3423. |
| [4] |
LI J, GUO Y, ZHOU J. The relationship between atopic dermatitis and skin microorganism[J]. Dermatology and Venereology, 2021, 43(1): 16-19. (in Chinese) 李娇, 郭芸, 周杰. 特应性皮炎与皮肤微生物态的关系[J]. 皮肤病与性病, 2021, 43(1): 16-19. |
| [5] |
The Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome[J]. Nature, 2012, 486(7402): 207-214. DOI:10.1038/nature11234 |
| [6] |
NAKATSUJI T, CHIANG HI, JIANG SB, NAGARAJAN H, ZENGLER K, GALLO RL. The microbiome extends to subepidermal compartments of normal skin[J]. Nature Communications, 2013, 4: 1431. DOI:10.1038/ncomms2441 |
| [7] |
GRICE EA, KONG HH, CONLAN S, DEMING CB, DAVIS J, YOUNG AC, PROGRAM NISCCS, BOUFFARD GG, BLAKESLEY RW, MURRAY PR, GREEN ED, TURNER ML, SEGRE JA. Topographical and temporal diversity of the human skin microbiome[J]. Science, 2009, 324(5931): 1190-1192. DOI:10.1126/science.1171700 |
| [8] |
HUEBNER J, GOLDMANN DA. Coagulase-negative staphylococci: role as pathogens[J]. Annual Review of Medicine, 1999, 50: 223-236. DOI:10.1146/annurev.med.50.1.223 |
| [9] |
COGEN AL, NIZET V, GALLO RL. Skin microbiota: a source of disease or defence?[J]. British Journal of Dermatology, 2008, 158(3): 442-455. DOI:10.1111/j.1365-2133.2008.08437.x |
| [10] |
SHIBAGAKI N, SUDA W, CLAVAUD C, BASTIEN P, TAKAYASU L, IIOKA E, KUROKAWA R, YAMASHITA N, HATTORI Y, SHINDO C, BRETON L, HATTORI M. Aging-related changes in the diversity of women's skin microbiomes associated with oral bacteria[J]. Scientific Reports, 2017, 7: 10567. DOI:10.1038/s41598-017-10834-9 |
| [11] |
CHRISTENSEN GJM, SCHOLZ CFP, ENGHILD J, ROHDE H, KILIAN M, THÜRMER A, BRZUSZKIEWICZ E, LOMHOLT HB, BRÜGGEMANN H. Antagonism between Staphylococcus epidermidis and Propionibacterium acnes and its genomic basis[J]. BMC Genomics, 2016, 17: 152. DOI:10.1186/s12864-016-2489-5 |
| [12] |
FAN XY, RUDENSKY AY. Hallmarks of tissue- resident lymphocytes[J]. Cell, 2016, 164(6): 1198-1211. DOI:10.1016/j.cell.2016.02.048 |
| [13] |
BELKAID Y, HARRISON OJ. Homeostatic immunity and the microbiota[J]. Immunity, 2017, 46(4): 562-576. DOI:10.1016/j.immuni.2017.04.008 |
| [14] |
TÜZÜN Y, ANTONOV M, DOLAR N, WOLF R. Keratinocyte cytokine and chemokine receptors[J]. Dermatologic Clinics, 2007, 25(4): 467-476. DOI:10.1016/j.det.2007.06.003 |
| [15] |
BROGDEN KA. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria?[J]. Nature Reviews Microbiology, 2005, 3(3): 238-250. DOI:10.1038/nrmicro1098 |
| [16] |
SCHRöDER JM, HARDER J. Antimicrobial skin peptides and proteins[J]. Cellular and Molecular Life Sciences: CMLS, 2006, 63(4): 469-486. DOI:10.1007/s00018-005-5364-0 |
| [17] |
WANKE I, STEFFEN H, CHRIST C, KRISMER B, GöTZ F, PESCHEL A, SCHALLER M, SCHITTEK B. Skin commensals amplify the innate immune response to pathogens by activation of distinct signaling pathways[J]. Journal of Investigative Dermatology, 2011, 131(2): 382-390. DOI:10.1038/jid.2010.328 |
| [18] |
QUIRINO MG, MACEDO LC, PAGNANO KBB, PAGLIARINI-E-SILVA S, SELL AM, VISENTAINER JEL. Toll-like receptor gene polymorphisms in patients with myeloproliferative neoplasms[J]. Molecular Biology Reports, 2021, 48(6): 4995-5001. DOI:10.1007/s11033-021-06238-8 |
| [19] |
LAI YP, DI NARDO A, NAKATSUJI T, LEICHTLE A, YANG Y, COGEN AL, WU ZR, HOOPER LV, SCHMIDT RR, von AULOCK S, RADEK KA, HUANG CM, RYAN AF, GALLO RL. Commensal bacteria regulate Toll-like receptor 3-dependent inflammation after skin injury[J]. Nature Medicine, 2009, 15(12): 1377-1382. DOI:10.1038/nm.2062 |
| [20] |
LINEHAN JL, HARRISON OJ, HAN SJ, BYRD AL, VUJKOVIC-CVIJIN I, VILLARINO AV, SEN SK, SHAIK J, SMELKINSON M, TAMOUTOUNOUR S, COLLINS N, BOULADOUX N, DZUTSEV A, ROSSHART SP, ARBUCKLE JH, WANG CR, KRISTIE TM, REHERMANN B, TRINCHIERI G, BRENCHLEY JM, et al. Non-classical immunity controls microbiota impact on skin immunity and tissue repair[J]. Cell, 2018, 172(4): 784-796. e18. DOI:10.1016/j.cell.2017.12.033 |
| [21] |
BITSCHAR K, STAUDENMAIER L, KLINK L, FOCKEN J, SAUER B, FEHRENBACHER B, HERSTER F, BITTNER Z, BLEUL L, SCHALLER M, WOLZ C, WEBER ANR, PESCHEL A, SCHITTEK B. Staphylococcus aureus skin colonization is enhanced by the interaction of neutrophil extracellular traps with keratinocytes[J]. The Journal of Investigative Dermatology, 2020, 140(5): 1054-1065. e4. DOI:10.1016/j.jid.2019.10.017 |
| [22] |
LIMA DS JR, KRISHNAMURTHY SR, BOULADOUX N, COLLINS N, HAN SJ, CHEN EY, CONSTANTINIDES MG, LINK VM, LIM AI, ENAMORADO M, CATAISSON C, GIL L, RAO I, FARLEY TK, KOROLEVA G, ATTIG J, YUSPA SH, FISCHBACH MA, KASSIOTIS G, BELKAID Y. Endogenous retroviruses promote homeostatic and inflammatory responses to the microbiota[J]. Cell, 2021, 184(14): 3794-3811. e19. DOI:10.1016/j.cell.2021.05.020 |
| [23] |
ZHENG Y, HUNT RL, VILLARUZ AE, FISHER EL, LIU R, LIU Q, CHEUNG GYC, LI M, OTTO M. Commensal Staphylococcus epidermidis contributes to skin barrier homeostasis by generating protective ceramides[J]. Cell Host & Microbe, 2022, 30(3): 301-313. e9. |
| [24] |
SPELLBERG B. The cutaneous citadel: a holistic view of skin and immunity[J]. Life Sciences, 2000, 67(5): 477-502. DOI:10.1016/S0024-3205(00)00653-6 |
| [25] |
NODAKE Y, MATSUMOTO S, MIURA R, HONDA H, ISHIBASHI G, MATSUMOTO S, DEKIO I, SAKAKIBARA R. Pilot study on novel skin care method by augmentation with Staphylococcus epidermidis, an autologous skin microbe - a blinded randomized clinical trial[J]. Journal of Dermatological Science, 2015, 79(2): 119-126. DOI:10.1016/j.jdermsci.2015.05.001 |
| [26] |
YUKI T, YOSHIDA H, AKAZAWA Y, KOMIYA A, SUGIYAMA Y, INOUE S. Activation of TLR2 enhances tight junction barrier in epidermal keratinocytes[J]. Journal of Immunology: Baltimore, Md: 1950, 2011, 187(6): 3230-3237. |
| [27] |
LIU Y, LIU YZ, DU ZX, ZHANG LD, CHEN J, SHEN Z, LIU Q, QIN JX, LV HY, WANG H, HE L, LIU JL, HUANG Q, SUN YH, OTTO M, LI M. Skin microbiota analysis-inspired development of novel anti-infectives[J]. Microbiome, 2020, 8(1): 85. DOI:10.1186/s40168-020-00866-1 |
| [28] |
VERDEROSA AD, TOTSIKA M, FAIRFULL-SMITH KE. Bacterial biofilm eradication agents: a current review[J]. Frontiers in Chemistry, 2019, 7: 824. DOI:10.3389/fchem.2019.00824 |
| [29] |
DAVIES D. Understanding biofilm resistance to antibacterial agents[J]. Nature Reviews Drug Discovery, 2003, 2(2): 114-122. DOI:10.1038/nrd1008 |
| [30] |
CHRISTENSEN GJM, BRÜGGEMANN H. Bacterial skin commensals and their role as host guardians[J]. Beneficial Microbes, 2014, 5(2): 201-215. DOI:10.3920/BM2012.0062 |
| [31] |
DONIA MS, FISCHBACH MA. HUMAN MICROBIOTA. Small molecules from the human microbiota[J]. Science, 2015, 349(6246): 1254766. DOI:10.1126/science.1254766 |
| [32] |
SONG LY, WANG Q, ZHENG YM, MA LJ, CHEN YY, GAO Y, ZHANG GL, CUI SM, HE KK, HE CF. Cheek microbial communities vary in young children with atopic dermatitis in China[J]. Dermatology: Basel, Switzerland, 2020, 236(2): 160-169. DOI:10.1159/000502469 |
| [33] |
SUGIMOTO S, IWAMOTO T, TAKADA K, OKUDA KI, TAJIMA A, IWASE T, MIZUNOE Y. Staphylococcus epidermidis Esp degrades specific proteins associated with Staphylococcus aureus biofilm formation and host-pathogen interaction[J]. Journal of Bacteriology, 2013, 195(8): 1645-1655. DOI:10.1128/JB.01672-12 |
| [34] |
IWASE T, UEHARA Y, SHINJI H, TAJIMA A, SEO H, TAKADA K, AGATA T, MIZUNOE Y. Staphylococcus epidermidis Esp inhibits Staphylococcus aureus biofilm formation and nasal colonization[J]. Nature, 2010, 465(7296): 346-349. DOI:10.1038/nature09074 |
| [35] |
BURIAN M, BITSCHAR K, DYLUS B, PESCHEL A, SCHITTEK B. The protective effect of microbiota on S. aureus skin colonization depends on the integrity of the epithelial barrier[J]. The Journal of Investigative Dermatology, 2017, 137(4): 976-979. DOI:10.1016/j.jid.2016.11.024 |
| [36] |
WANG YH, KUO S, SHU MY, YU JH, HUANG S, DAI A, TWO A, GALLO RL, HUANG CM. Staphylococcus epidermidis in the human skin microbiome mediates fermentation to inhibit the growth of Propionibacterium acnes: implications of probiotics in acne vulgaris[J]. Applied Microbiology and Biotechnology, 2014, 98(1): 411-424. DOI:10.1007/s00253-013-5394-8 |
| [37] |
LEBRE MC, van DER AAR AMG, van BAARSEN L, van Capel TMM, Schuitemaker JHN, Kapsenberg ML, de Jong EC. Human keratinocytes express functional Toll-like receptor 3, 4, 5, and 9[J]. Journal of Investigative Dermatology, 2007, 127(2): 331-341. DOI:10.1038/sj.jid.5700530 |
| [38] |
PIVARCSI A, BODAI L, RÉTHI B, KENDERESSY- SZABÓ A, KORECK A, SZÉLL M, BEER Z, BATA- CSöRGOő Z, MAGÓCSI M, RAJNAVöLGYI é, DOBOZY A, KEMÉNY L. Expression and function of Toll-like receptors 2 and 4 in human keratinocytes[J]. International Immunology, 2003, 15(6): 721-730. DOI:10.1093/intimm/dxg068 |
| [39] |
BAKER BS, OVIGNE JM, POWLES AV, CORCORAN S, FRY L. Normal keratinocytes express Toll-like receptors (TLRs) 1, 2 and 5: modulation of TLR expression in chronic plaque psoriasis[J]. British Journal of Dermatology, 2003, 148(4): 670-679. DOI:10.1046/j.1365-2133.2003.05287.x |
| [40] |
XIA XL, LI ZH, LIU KW, WU YL, JIANG DM, LAI YP. Staphylococcal LTA-induced miR-143 inhibits Propionibacterium acnes-mediated inflammatory response in skin[J]. Journal of Investigative Dermatology, 2016, 136(3): 621-630. DOI:10.1016/j.jid.2015.12.024 |
| [41] |
BASTONINI E, BELLEI B, FILONI A, KOVACS D, IACOVELLI P, PICARDO M. Involvement of non-melanocytic skin cells in vitiligo[J]. Experimental Dermatology, 2019, 28(6): 667-673. DOI:10.1111/exd.13868 |
| [42] |
WANG YH, ZHU WH, SHU MY, JIANG Y, GALLO RL, LIU YT, HUANG CM. The response of human skin commensal bacteria as a reflection of UV radiation: UV-B decreases porphyrin production[J]. PLoS One, 2012, 7(10): e47798. DOI:10.1371/journal.pone.0047798 |
| [43] |
WANG ZP, CHOI JE, WU CC, DI NARDO A. Skin commensal bacteria Staphylococcus epidermidis promote survival of melanocytes bearing UVB-induced DNA damage, while bacteria Propionibacterium acnes inhibit survival of melanocytes by increasing apoptosis[J]. Photodermatology, Photoimmunology & Photomedicine, 2018, 34(6): 405-414. |
| [44] |
NIZET V, OHTAKE T, LAUTH X, TROWBRIDGE J, RUDISILL J, DORSCHNER RA, PESTONJAMASP V, PIRAINO J, HUTTNER K, GALLO RL. Innate antimicrobial peptide protects the skin from invasive bacterial infection[J]. Nature, 2001, 414(6862): 454-457. DOI:10.1038/35106587 |
| [45] |
COGEN AL, YAMASAKI K, MUTO J, SANCHEZ KM, CROTTY ALEXANDER L, TANIOS J, LAI YP, KIM JE, NIZET V, GALLO RL. Staphylococcus epidermidis antimicrobial delta-toxin (phenol-soluble modulin-gamma) cooperates with host antimicrobial peptides to kill group A Streptococcus[J]. PLoS One, 2010, 5(1): e8557. DOI:10.1371/journal.pone.0008557 |
| [46] |
LEONEL C, SENA IFG, SILVA WN, PRAZERES PHDM, FERNANDES GR, MANCHA AGRESTI P, MARTINS DRUMOND M, MINTZ A, AZEVEDO VAC, BIRBRAIR A. Staphylococcus epidermidis role in the skin microenvironment[J]. Journal of Cellular and Molecular Medicine, 2019, 23(9): 5949-5955. DOI:10.1111/jcmm.14415 |
| [47] |
NAKATSUJI T, CHEN TH, BUTCHER AM, TRZOSS LL, NAM SJ, SHIRAKAWA KT, ZHOU W, OH J, OTTO M, FENICAL W, GALLO RL. A commensal strain of Staphylococcus epidermidis protects against skin neoplasia[J]. Science Advances, 2018, 4(2): eaao4502. DOI:10.1126/sciadv.aao4502 |
 2023, Vol. 50
2023, Vol. 50




