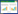扩展功能
文章信息
- 李旭, 朱晓伟, 代先祝, 冯俊洲, 李岱黛, 习向银, 陈少鹏
- LI Xu, ZHU Xiaowei, DAI Xianzhu, FENG Junzhou, LI Daidai, XI Xiangyin, CHEN Shaopeng
- 促进烟草生长的耐冷芽孢杆菌的筛选及其对烟苗根系分泌物的影响
- Screening of a tobacco growth-promoting psychrotolerant Bacillus sp. strain with effects on the root exudates of tobacco seedlings
- 微生物学通报, 2024, 51(8): 2947-2961
- Microbiology China, 2024, 51(8): 2947-2961
- DOI: 10.13344/j.microbiol.china.230866
-
文章历史
- 收稿日期: 2023-10-19
- 接受日期: 2024-01-05
- 网络首发日期: 2024-02-23
2. 西南大学 资源与环境学院, 重庆 400715
2. College of Resources and Environment, Southwest University, Chongqing 400715, China
低温胁迫是植物生长发育过程中遇到的主要环境胁迫因子之一。因为周期性低温及高海拔山区低温,低温冷害现象在我国南方山区农作物生产中普遍存在,在喜温的烟草生产中尤为突出,近年的极端天气现象进一步加剧了冷害造成的经济损失。一方面,低温冷害影响烟草种子发芽、出苗和幼苗生长,最终降低烟叶的质量和产量[1-2];另一方面,苗期和大田低温易引起烟株早花,使烟草总叶片数减少,不但显著降低烟叶产量,还会导致烟叶增厚,烘烤出来的烟叶等级下降,上部烟叶多,价位高的中部烟减少,从而降低烤烟经济效益[3-5]。推迟移栽期虽然可能避开低温冷害,但烤烟在大田生长后期仍然存在高温逼熟、易诱发烟草青枯病等根茎类病害问题[4]。目前应对低温的措施主要有采用井窖小苗移栽、地膜覆盖及使用生物增温促根剂等[6-8]。但这些方法存在增温时长和效果不足等问题,亟待开发出更多有效缓解烟苗低温胁迫的可持续方法。
植物根际促生菌(plant growth-promoting rhizobacteria, PGPR)是一类定殖于植物根际的有益细菌。它们通过固定氮素、溶解难溶性磷、产生嗜铁素和植物激素等促进作物生长,也可通过产生特定种类的抑菌物质限制病原菌的生长,缓解非生物胁迫等方式间接促进植物生长[9-10]。低温条件下能够生长且最适生长温度大于15 ℃的细菌被称为耐冷细菌(psychrotolerant bacteria)[11]。耐冷微生物的生长温度范围广,在缓解农作物低温胁迫方面有较大的应用潜力。目前有一些关于耐冷PGPR缓解小麦、豌豆、番茄等作物低温胁迫、促进这些作物生长的报道[12-13],但主要是关于分离自高寒地区的菌种研究[14-15]。分离自非高寒地区的耐冷PGPR资源,特别是针对促进烟苗低温生长的PGPR资源的开发和研究还很少[16]。
充分调动植物-微生物之间的友好协作关系是发展可持续农业的重要手段,而植物根系分泌物是联系植物和根际微生物的关键纽带[17-18]。根际微生物依赖于植物根系分泌物生长,同时也可以改变根系分泌物的组成[19]。烟草根系分泌物相关的研究主要针对根系分泌物的自毒作用[20],关于耐冷PGPR对烟苗根际分泌物影响的报道较少。本研究采用非靶向代谢组学方法分析低温条件下在烟苗根部接种耐冷促生芽孢杆菌后烟苗根系分泌物的变化,以期为了解根际促生菌缓解烟苗低温胁迫提供新的理论基础。
1 材料与方法 1.1 材料 1.1.1 样品土壤样品采自重庆市武隆区高海拔烟区的烟苗根际土。烟草种子为云烟87。
1.1.2 培养基LB培养基(g/L):蛋白胨10.0,酵母提取物5.0,NaCl 10.0。MS培养基参考文献[1]配制,Pikovskaya无机磷培养基、CAS培养基、脱脂奶粉培养基、罗丹明-橄榄油培养基和KingB-Trp液体培养基参考文献[16, 21-23]配制。
1.1.3 主要试剂和仪器光色素,上海皓鸿生物医药科技有限公司;PCR反应试剂和酶,TaKaRa公司。人工气候培养箱,宁波东南仪器有限公司;普通光学显微镜,重庆澳浦光电技术有限公司;冷冻组织研磨仪,上海测博生物科技发展中心;超高效液相色谱串联傅里叶变换质谱系统,赛默飞世尔科技公司。
1.2 耐冷根际微生物的分离纯化称取10 g土壤样品加入90 mL无菌水中,振荡混匀后10倍梯度稀释,用稀释为10–4、10–5和10–6的稀释液涂布LB平板,倒置于10 ℃恒温培养箱中培养2 d,然后从平板上挑取长势较快且菌落形态具有差异的细菌,转接LB平板上划线纯化。
1.3 耐冷烟苗促生菌的筛选与鉴定用0.1% CuSO4浸泡烟草种子20 min后,无菌水冲洗5次,40 ℃温水浸种30 min后再用冷水浸泡24 h,然后用牙签将种子点种于MS琼脂培养基上,25 ℃人工气候培养箱中催芽。8 d后选取萌发较为一致的烟苗移栽至新MS平板上,每个平板5株烟苗。将分离的耐冷细菌接种于LB液体培养基中,15 ℃、180 r/min振荡培养24 h后取约1 µL菌液接种在每株烟苗根部的中间,对照组中加等量的LB液体培养基。接种后的烟苗分别放置于低温15 ℃和常温25 ℃的人工气候箱培养20 d,根据烟苗根系发育和长势筛选出低温条件下对烟苗促生效果较好的菌株,保藏菌种待用。需要测鲜重和根系指标的烟苗延长培养至40 d。
相较于对照组,低温条件下接种耐冷菌后烟苗产生侧根、烟苗叶片数量更多或叶片更大,则视为有促生效果的菌。用LB液体培养基培养耐冷促生细菌至对数生长期(OD600=1.2),以菌液为模板,使用细菌16S rRNA基因通用引物27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR反应体系和条件按照TaqTM试剂盒说明书操作。琼脂糖凝胶电泳确认PCR产物大小后送生工生物工程(上海)股份有限公司测序。获得的序列用BLASTn在GenBank中搜索比对与之相似性高的多个序列,下载相近种属菌株的16S rRNA基因片段,在软件MEGA 11.0中进行序列比对,并选择neighbor-joining法构建系统发育树,初步鉴定菌株归属。
1.4 耐冷烟苗促生菌促生特性的测定采用Pikovskaya无机磷培养基检测菌株的溶磷活性[21],采用CAS培养基检测菌株嗜铁素的分泌[22],采用脱脂奶粉培养基检测菌株产蛋白酶的活性,采用罗丹明-橄榄油培养基测定菌株产脂酶活性。点种等量的菌液后在15 ℃和25 ℃分别培养至产生透明圈或晕圈,测量菌落直径和晕圈直径,用晕圈或透明圈直径除以菌落直径来定性菌株相关促生特性,并定量测定分泌吲哚乙酸(indoleacetic acid, IAA)的能力[23]:将待测菌株接种到50 mL KingB-Trp液体培养基,25 ℃或15 ℃、180 r/min避光振荡培养3 d后4 ℃、12 000×g离心2 min,取上清与等量Salkowski试剂混匀,室温避光放置20 min,若出现玫瑰红色,则表明有IAA产生。然后吸取200 µL变色的样品于96孔板,测定吸光度A530,并测定10、20、40、60、80和100 µg/mL的纯IAA溶液的A530,绘制标准曲线,根据标准曲线计算培养液上清中的IAA浓度。
1.5 促生菌在烟苗根部生长和定殖的观察将1.3筛选的耐冷促生菌接种于LB液体培养基中,28 ℃、180 r/min振荡培养12 h,在MS固体培养基上生长的每株烟苗根部中间接种约1 µL菌液,对照组烟苗根部加1 µL LB液体培养基。将接种菌液的烟苗平板分别置于低温15 ℃和常温25 ℃人工气候培养箱中培养20 d后,从平板上小心取下烟苗,用1%番红染色烟苗根1 min,然后用去离子水轻柔地冲洗掉染色剂以及未附着在根部的菌体,最后通过光学显微镜观察根系菌株的生长和附着情况。
1.6 非靶向代谢组测定低温条件下烟苗根系分泌物的组成采用平板培养法将耐冷促生菌接种于烟苗根部,低温15 ℃培养20 d,挑取烟苗根系附近的MS培养基,立即液氮冷冻,送往上海美吉生物医药科技有限公司测定代谢物。首先精确称取样本进行脱盐处理,加入研磨珠,于低温环境下加入含内标(l-2-氯苯丙氨酸)的提取液(甲醇: 水体积比为4:1),再用冷冻组织研磨仪(–10 ℃,50 Hz)研磨后低温超声(5 ℃,40 kHz)进行代谢物的提取。将该提取液于–20 ℃静置30 min,4 ℃、20 000×g离心10 min,取上清液至带内插管的进样小瓶中上机分析。采用液相色谱进行组分分离,分离的单一组分再进入高真空质谱仪的离子源进行离子化,按质荷比(m/z)分开而得到质谱图,最后通过样品的质谱数据分析得到样品的定性定量结果。样品质谱信号的采集采用阴阳离子扫描模式,质谱检测器扫描范围m/z:70–1 050。
2 结果与分析 2.1 耐冷烟苗促生菌的筛选与鉴定通过MS平板烟苗筛选的方法,发现在15 ℃条件下接种菌株JZC10的烟苗长势显著好于对照组(图 1A–1D),处理组烟苗的侧根较对照组发达,根毛更为密集,处理组有3片真叶而对照组只有2片真叶。而25 ℃条件下接种菌株JZC10对烟苗叶片、根系发育均无明显的促进效果。15 ℃条件下接种处理组的根表面积、根总长及地上和地下部分鲜重都显著高于未接种对照组(图 1E–1G)。这一结果表明菌株JZC10与烟苗根系在不同温度条件下存在不同的相互作用关系。
|
| 图 1 菌株JZC10促进烟苗生长的效果 Figure 1 Growth promoting effects of bacterial strain JZC10 on tobacco seedlings. A: Tobacco seedlings of control group grown at 15 ℃. B: Tobacco seedlings of strain JCZ10 treated group grown at 15 ℃. C: Tobacco seedlings of control group grown at 25 ℃. D: Tobacco seedlings of strain JCZ10 treated group grown at 25 ℃. E: Effects of strain JZC10 treatment on the root surface of tobacco seedlings grown at 15 ℃. F: Effects of JZC10 treatment on the total root length of tobacco seedlings grown at 15 ℃. G: Effects of strain JZC10 treatment on the fresh weight of root and shoot of tobacco seedlings grown at 15 ℃. **: P < 0.01. A:15 ℃条件下培养的未接菌对照组烟苗. B:15 ℃条件下培养的接种菌株JCZ10的烟苗. C:25 ℃条件下培养的未接菌对照组烟苗. D:25 ℃条件下培养的接种JCZ10的烟苗. E:接种菌株JZC10对在15 ℃条件下培养的烟苗根表面积的影响. F:接种菌株JZC10对在15 ℃条件下培养的烟苗根总长的影响. G:接种菌株JZC10对在15 ℃条件下培养的烟苗鲜重的影响. **: P < 0.01 |
|
|
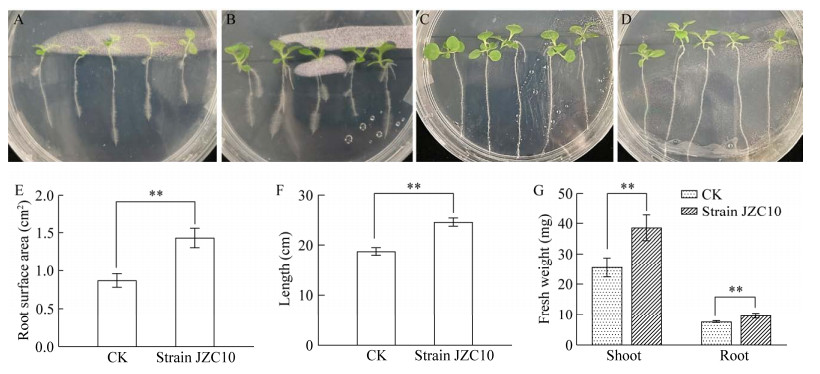
菌株JZC10在平板上形成扁平、表面粗糙的菌落,简单染色镜检观察到菌体呈杆状,产芽孢(图 2A、2B)。通过MEGA 11.0与相近种属细菌的16S rRNA基因序列比对和构建系统发育树的结果表明菌株JZC10为芽孢杆菌属(Bacillus) (GenBank登录号为OR660403),与蜡样芽孢杆菌分类地位最近(图 2C)。另外,菌株JZC10的促生性状多为阴性,只有产IAA和蛋白酶为阳性(表 1)。菌株JZC10在15 ℃时溶蛋白透明圈直径与菌落直径的比为1.61,25 ℃时为1.69,可见该菌蛋白酶的分泌不受温度影响。菌株JZC10在25 ℃时产IAA量为127.89 µg/mL,15 ℃培养时不产IAA,这个结果与促生效果现象相反。这可能是由于菌株在常温生长速度快,产IAA量更多,还可能是因为低温下细菌在与植物根系互作后诱导产生新的促生物质,但促生物质不是IAA。
|
| 图 2 菌株JZC10的菌落、菌体和芽孢及基于16S rRNA基因序列构建的系统发育树 Figure 2 Colonies, cells and spores of strain JZC10 and phylogenetic tree constructed based on 16S rRNA gene sequence. A: Colonies of strain JCZ10 grown on LB solid medium. B: Rod-shaped cells and spores of strain JZC10 (indicated by black arrow). C: Phylogenetic tree of strain JCZ10 based on 16S rRNA gene sequence. The serial number in parentheses is the GenBank login number; The numbers on the branching points represent credibility; The scale represents the evolutionary distance of the sequence. A:菌株JZC10在LB固体培养基上形成的菌落. B:菌株JZC10的杆状菌体和芽孢(黑色箭头所指). C:菌株JZC10的系统发育树,括号内为各菌株在GenBank中的登录号;分支点上的数字表示可信度;标尺代表序列的进化距离 |
|
|
| 促生性状 Growth-promoting traits |
15 ℃ | 25 ℃ |
| 溶磷P solubilization | – | – |
| 产嗜铁素Siderophores | – | – |
| 蛋白酶Proteinase | 1.61 | 1.69 |
| 脂酶Lipase | – | – |
| 吲哚乙酸Indoleacetic acid (µg/mL) | – | 127.89 |
| 除吲哚乙酸外,其他活性用透明圈直径/菌落直径表示. –:阴性 Except for indoleacetic acid, other activities were represented by the ratio of transparent ring diameter to colony diameter. –: Negative. | ||
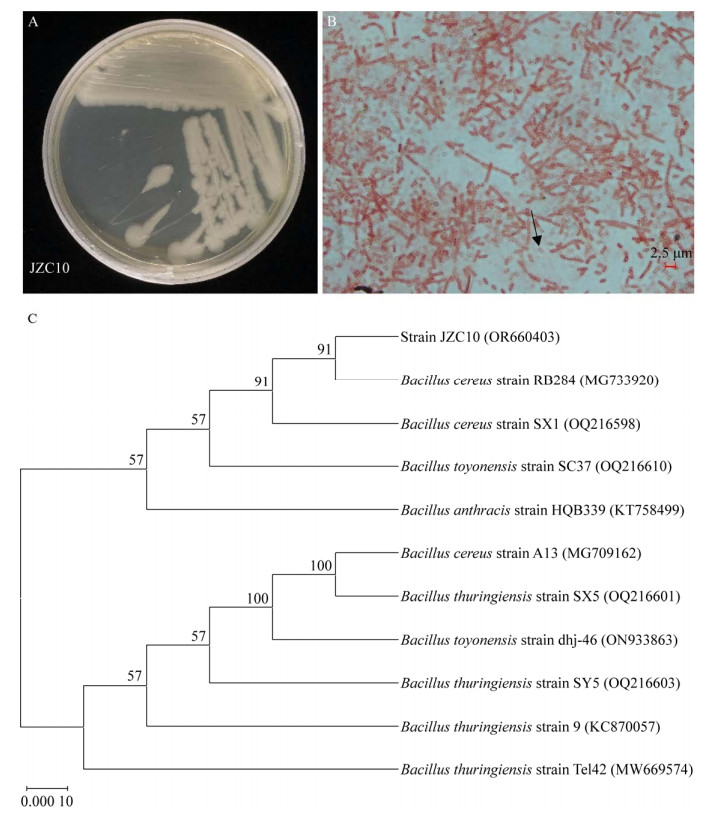
接种促生菌后,随着烟苗根系向下生长延伸,取样检测时,初始的菌体接种点位于取样时烟苗根系的上部。为了判断菌株在根部的生长和扩散定殖情况,将根系分为根上部(菌的接种部位)、根中部及根下部。染色后镜检结果显示菌株JZC10主要分布在初始接种部位,即根的上部,根的中部和下部未观察到菌体(图 3),表明菌体只在接种部位生长,不会随着根系的生长向下扩散。菌株JZC10在15 ℃培养的烟苗根部生长得更旺盛,镜检能观察到更密集的菌体,在25 ℃的烟苗根部生长的菌体量较少(图 3A和3D)。结合菌株JZC10在15 ℃的促生效果比25 ℃显著的现象,可以推测低温条件下耐冷促生菌和烟苗根系有更好的协作关系,从而促进彼此的生长。
|
| 图 3 不同温度下菌株JZC10在烟苗根系不同部位的分布和生长情况 Figure 3 Distribution and growth of strain JZC10 in different parts of tobacco seedling roots at different temperatures. A: The growth and distribution of strain JZC10 around the root upper part of tobacco seedlings grown at 15 ℃. B: The growth and distribution of strain JZC10 around the root middle part of tobacco seedlings grown at 15 ℃. C: The growth and distribution of strain JZC10 around the root bottom part of tobacco seedlings grown at 15 ℃. D: The growth and distribution of strain JZC10 around the root upper part of tobacco seedlings grown at 25 ℃. E: The growth and distribution of strain JZC10 around the root middle part of tobacco seedlings grown at 25 ℃. F: The growth and distribution of strain JZC10 around the root bottom part of tobacco seedlings grown at 25 ℃. A:15 ℃条件下菌株JZC10在烟苗根系上部的分布和生长情况. B:15 ℃条件下菌株JZC10在烟苗根系中部的分布和生长情况. C:15 ℃条件下菌株JZC10在烟苗根系下部的分布和生长情况. D:25 ℃条件下菌株JZC10在烟苗根系上部的分布和生长情况. E:25 ℃条件下菌株JZC10在烟苗根系中部的分布和生长情况. F:25 ℃条件下菌株JZC10在烟苗根系下部的分布和生长情况 |
|
|
通过非靶向代谢组分析从烟苗根系一共鉴定到894种代谢物,其中阳离子模式下有700种,阴离子模式下有194种。这些鉴定到的代谢物中属于京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)的较少,其中氨基酸、羧酸、磷脂、脂肪酸、单糖类化合物和传递介质的量相对较多(图 4A),除传递介质外,其他物质都是常见植物根系分泌物,传递介质广泛存在于各类生物中,在植物中可作为信号分子,参与植物对外界环境的响应[24]。基于人类代谢组数据库(human metabolome database, HMDB)化合物分类鉴定的代谢物较多,其中氨基酸、肽类及其衍生物在所有分类化合物中占比最高,为14.63%,碳水化合物及相关物质占比为6.74%,脂肪酸及相关物质占比5.69%,羰基类化合物占比3.14% (图 4B)。基于两个数据库进行的代谢物分类结果数量虽然差异较大,但主要代谢物分类比较一致,可见HMDB也可用于分析烟苗代谢物。这一结果也表明烟苗根系分泌物中有丰富的营养基质,这将有利于菌株JZC10在烟苗根系的生长。
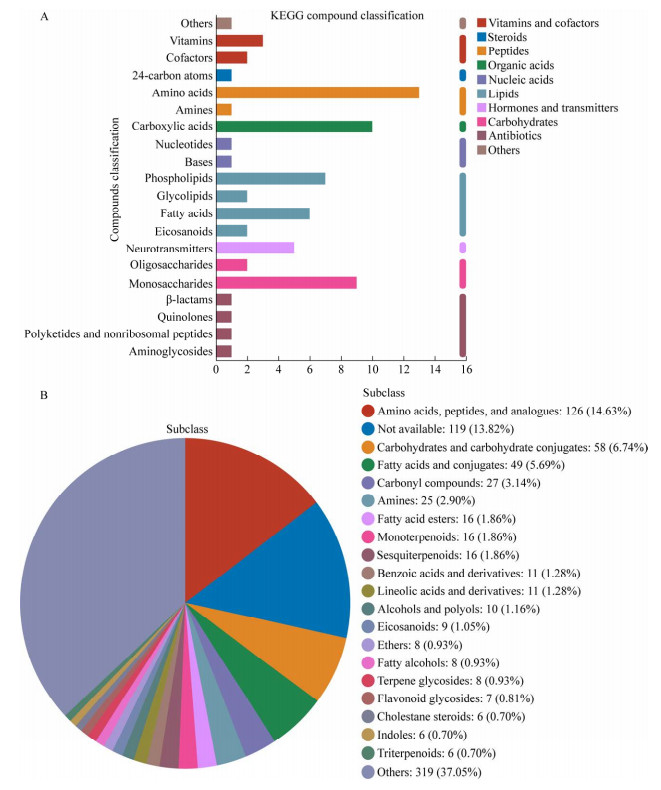
|
| 图 4 烟苗根系分泌物的KEGG (A)和HMDB (B)化合物分类结果 Figure 4 KEGG (A) and HMDB (B) compound classification of all the identified root exudates from tobacco seedling. |
|
|
阳离子模式下,处理组和对照组的共同代谢物有723种,特有代谢物分别有19种和70种(图 5A)。阴离子模式下,处理组和对照组的共同代谢物有145种,而特有代谢物分别有7种和13种(图 5B)。正交偏最小二乘判别分析(Orthogonal partial least squares discrimination analysis, OPLS-DA)的结果显示,阴离子和阳离子检测结果中,对照组和处理组分别分布在不同区域(图 5C和5D),说明接种促生菌显著影响烟苗根系分泌物。
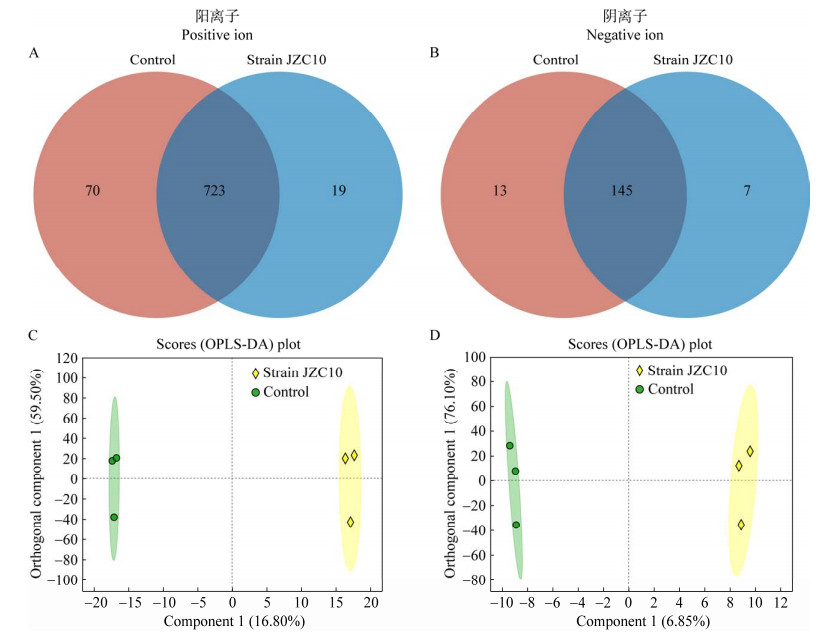
|
| 图 5 15 ℃条件下接种菌株JZC10对烟苗根系分泌物影响的韦恩图和正交偏最小二乘判别分析 Figure 5 The Venn plot and Orthogonal partial least squares discrimination analysis displays the root exudates of tobacco seedlings with or without strain JZC10 treatment at 15 ℃. A: Venn plot of positive ion root exudates. B: Venn plot of negative ion root exudates. C: OPLS-DA plot of positive ion root exudates. D: OPLS-DA plot of negative ion root exudates. A:阳离子根系分泌物韦恩图. B:阴离子根系分泌物韦恩图. C:阳离子根系分泌物的OPLS-DA分析结果. D:阴离子根系分泌物的OPLS-DA分析结果 |
|
|
用variable importance in projection (VIP)值大于1且P < 0.05的标准进行差异代谢物聚类分析。结果显示,相较于对照组,处理组有19个含量有显著差异的代谢物,其中上调代谢物6个,下调代谢物13个。上调代谢物分别是新岩蛤毒素(neosaxitoxin)、6-(α-D-氨基葡萄糖基)-1D肌醇[6-(alpha-D-glucosaminyl)-1D-myo-inositol]、(2-巯基甲基-3-苯基-丙酰基)-甘氨酸[(2-mercaptomethyl-3-phenyl-propionyl)-glycine]、光色素(lumichrome)、根皮素(phlorin)和1, 4-二羟基-2-萘甲酸(1, 4-dihydroxy-2-naphthoic acid)。下调化合物中有6种是短肽或者氨基酸衍生物,多聚不饱和脂肪酸PC[22:5(7Z, 10Z, 13Z, 16Z, 19Z)/PGF1alpha],以及一些抗菌活性物质,如放线菌酮(cycloheximide)、硫酸西索米星(sisomicin sulfate) (图 6A)。采用5 nmol/L光色素浸泡烟苗根系,结果发现经光色素处理后烟苗的叶片比对照组更宽大,侧根发育更好(图 6B和图 6C)。

|
| 图 6 聚类分析接种菌株JZC10后烟苗根系含量有差异的分泌物及验证 Figure 6 Cluster analysis and validation of differential root exudes of tobacco seedlings inoculated with strain JZC10. A: Cluster analysis based on the differential root exudates of tobacco seedlings inoculated Bacillus sp. JZC10. B: The control tobacco seedlings grown without lumichrome treatment at 15 ℃. C: The tobacco seedlings grown with lumichrome treatment at 15 ℃. *: P < 0.05; **: P < 0.01. A:接种JZC10导致的根系差异分泌物聚类分析图. B:15 ℃条件下生长的未加光色素处理的烟苗. C:15 ℃条件下生长的添加光色素处理的烟苗. *: P < 0.05; **: P < 0.01 |
|
|
常见的根际促生菌筛选顺序是先检测菌株的促生特性,包括溶磷、产IAA、嗜铁素等,再选取促生特性好的菌株接种到目的作物根系进一步筛选促生菌[16, 25]。本研究的芽孢杆菌JZC10是采用先将菌株接种到烟苗根系测试菌株的促生效果方法筛选获得,结果发现在15 ℃的低温条件下,测试的几项促生特性指标中,仅产蛋白酶是阳性。菌株JZC10在25 ℃产IAA浓度较高,但对烟苗无明显的促生效果。这可能因为筛选促生作用的MS培养基和测试产IAA的培养基组成不一样,菌株JZC10在MS培养基上不能合成和分泌IAA。还可能是温度和营养底物影响了根际促生菌和烟苗根系的相互作用关系,从而使得促生效果和促生特性指标不一致。可见,在促生菌筛选过程中,过度依赖于促生性状指标可能不利于促生菌资源的获得,本研究直接用基于平板培养的筛选方式,具有更直观的效果。
植物根系分泌物受各种生物和非生物因子的影响,也是影响植物与根际微生物相互作用的关键因子[18-19]。关于烟苗根系分泌物自毒作用和与病原菌的关系相关的报道很多,而对根际促生菌接种后烟苗根系分泌物影响相关的研究却很少[19, 26]。本研究采用非靶向代谢组分析法,在15 ℃的低温条件下,从接种促生菌JZC10和不接种的烟苗根系分泌物中总共鉴定了近900种化合物,包括常见的氨基酸和肽类物质、碳水化合物、脂肪酸和有机酸,这些化合物都是利于根际微生物生长的营养基质,可能是烟苗根系生长更旺盛的原因。另外,本研究还鉴定到苯甲酸及其衍生物、吲哚类、维生素类和辅因子类化合物,以及一些萜类和糖苷类物质。苯甲酸类物质被认为参与根系和根际微生物的相互作用,在烟苗根系苯甲酸的浓度可达到0.25 mg/g根干重[27]。这些活性物质可能在调控根系和促生菌之间的生长平衡上发挥重要作用。在接种菌株JZC10的烟苗根系所特有分泌物中,根皮酚-β-D-葡糖甙(phlorin)、缬草素(valtrate)、车叶草苷酸(asperuloside acid)和13α(21)-环氧宽缨酮[13alpha(21)-epoxyeurycomanone]都是来源于植物、具有生物活性或抗菌活性的物质[28-29] (表 2)。已发表的烟草根系分泌物相关文献中鲜见报道这些化合物,可能因为分析测试方法差异导致,也可能是烟苗根系与菌株JZC10相互作用诱导才分泌了这些活性物质。另外,接种菌株JZC10处理组的光色素含量显著增加。研究表明光色素是根际微生物分泌来促进植物生长的一种信号分子,由中华根瘤菌(Sinorhizobium)分泌的光色素可以增强苜蓿根的呼吸作用,促进幼苗生长,使用5 nmol/L的光色素溶液浸根就可诱导植物更早进入三叶期,促进茎延伸和增加叶面积[30-31]。我们的验证结果表明光色素也可以促进烟苗叶片生长和侧根发育,由此表明,光色素是菌株JZC10在低温条件下的关键促生物质。
| ID | 代谢物Metabolite | metab ID | m/z | Formula |
| pos_1552 | 布他巴比妥Butabarbital | metab_573 | 230.149 919 1 | C10H16N2O3 |
| pos_1652 | 13α(21)-环氧宽缨酮 13alpha(21)-epoxyeurycomanone |
metab_680 | 442.170 701 2 | C20H24O10 |
| pos_1669 | 新岩蛤毒素Neosaxitoxin | metab_698 | 280.117 927 9 | C10H17N7O5 |
| pos_2031 | N-反式阿魏酰酪胺N-trans-feruloyityramine | metab_1085 | 314.138 536 1 | C18H19NO4 |
| pos_3317 | 肉豆蔻酸Myristic acid | metab_2401 | 246.242 797 9 | C14H28O2 |
| pos_3418 | 鼠卡他素Muricatacin | metab_2501 | 302.268 714 8 | C17H32O3 |
| pos_381 | 车叶草苷酸Asperuloside acid | metab_2914 | 450.160 522 | C18H24O12 |
| pos_4231 | 4-氯-L-苯丙氨酸4-chloro-L-phenylalanine | metab_3357 | 241.073 914 1 | C9H10C1NO2 |
| pos_4319 | 缬草素Valtrate | metab_3451 | 442.170 843 1 | C10H12O5 |
| pos_4384 | 5-甲基四氢叶酸5-methyltetrahydrofolic acid | metab_3519 | 477.223 143 4 | C20H25N7O6 |
| pos_4691 | 根皮酚-β-D-葡糖甙Phlorin | metab_3825 | 271.081 027 4 | C12H16O8 |
| pos_4733 | 6-(α-D-氨基葡萄糖基)-1D肌醇 6-(alpha-D-glucosaminyl)-1D-myo-inositol |
metab_3871 | 306.118 236 9 | C12H23NO10 |
| pos_5041 | 胞嘧啶Cytosine | metab_4188 | 112.050 880 1 | C4H5N3O |
| neg_1262 | (+)醋酸新薄荷酯(+)-neomenthyl acetate | metab_5248 | 243.160 260 9 | C12H22O2 |
| neg_1567 | 2-氨基苄他汀2-aminobenzvistatine | metab_5492 | 605.355 618 8 | C15H24N2O3 |
| neg_2272 | 噻吩Thienorphine | metab_6104 | 556.227 902 9 | C31H39NO4S |
| neg_2399 | 髓肽Myelopeptides | metab_6232 | 717.301 364 8 | C35H48N6O8 |
| a:仅列出了有明确化学名称的化合物 a: Only compounds with clear chemical names are listed. |
||||
接种菌株JZC10后含量下调的根系分泌物中氨基酸和肽类及它们的衍生物最多,推测是因为菌株JZC10的代谢分解导致了这些化合物含量下降。下调的化合物中还有多聚不饱和脂肪酸PC[22:5(7Z, 10Z, 13Z, 16Z, 19Z)/PGF1alpha],带有多聚不饱脂肪酸链的磷脂是生物细胞膜为应对低温而合成的[32],这一物质的降低表明菌株JZC10一定程度上缓解了烟苗的低温胁迫,这也可能是菌株JZC10促进烟苗低温条件下生长的原因之一,具体缓解低温胁迫的机理有待进一步研究。此外,与前文提到的一些生物活性物质含量增加相反的是,抗细菌抗生素硫酸西索米星(sisomicin sulfate)的含量显著降低,说明烟苗根系可能通过调整抗菌活性物质种类和含量,以保证菌株JZC10与烟苗之间形成一种生长平衡关系,菌的生物量不会对根系造成营养竞争威胁,烟苗又能受益于菌体分泌物。
本研究通过直接在烟草幼苗根系接种耐冷菌的方法筛选促生菌,获得的芽孢杆菌在15 ℃显著促进了烟苗根系发育和植株生长,并利用非靶向代谢组学方法全面解析了所分离的耐冷促生芽孢杆菌在15 ℃低温条件下对烟苗根系分泌物的影响,为了解烟苗根系与根际微生物在低温条件下的相互作用提供了新的见解。
| [1] |
CUI HW. Effects of low temperature and drought stress on tobacco seed germination and seedling growth and study on improving its cold and drought resistance[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2012 (in Chinese). 崔华威. 低温干旱胁迫对烟草种子发芽和幼苗生长的影响及提高其抗寒抗旱性的研究[D]. 杭州: 浙江大学博士学位论文, 2012. |
| [2] |
WANG SH, HUANG CJ. Effect of low temperature on tobacco seed germination[J]. China Seed Industry, 2008(5): 48-49. (in Chinese) 王树会, 黄成江. 低温对烟草种子萌发的影响[J]. 中国种业, 2008(5): 48-49. DOI:10.3969/j.issn.1671-895X.2008.05.025 |
| [3] |
JIN L, JIN Y, ZHOU JH, YANG YH, YANG HQ, HUANG CJ, DUAN YQ, CHEN HW. Effects of low temperature in seedling stage on floral differentiation and development of flue-cured tobacco[J]. Chinese Tobacco Science, 2007, 28(6): 1-5. (in Chinese) 金磊, 晋艳, 周冀衡, 杨宇虹, 杨虹琦, 黄成江, 段玉琪, 陈恒旺. 苗期低温对烤烟花芽分化及发育进程的影响[J]. 中国烟草科学, 2007, 28(6): 1-5. DOI:10.3969/j.issn.1007-5119.2007.06.001 |
| [4] |
ZHENG RH. Effect of temperature on yield and quality of flue-cured tobacco in Guangdong[J]. Guangdong Agricultural Science, 2001, 28(1): 13-14. (in Chinese) 郑荣豪. 气温对广东烤烟产量和质量的影响[J]. 广东农业科学, 2001, 28(1): 13-14. DOI:10.3969/j.issn.1004-874X.2001.01.006 |
| [5] |
JIANG XZ, YANG CK, ZOU XX, LI YY, ZHANG QF, REN XM, YAN WJ, YAO WY, HE XY, HU RS, HU ZR. Expression analysis of flowering regulatory genes in tobacco under low temperature stress[J]. Chinese Tobacco Science, 2023, 44(3): 10-15. (in Chinese) 姜习振, 杨晨凯, 邹湘香, 李洋洋, 张庆富, 任晓敏, 晏伟杰, 姚未远, 贺新颖, 胡日生, 户正荣. 低温胁迫下烟草开花调控基因表达分析[J]. 中国烟草科学, 2023, 44(3): 10-15. |
| [6] |
CHEN PY, YANG C, WANG DB, LI KW, WEI YQ, CHEN YY, ZHANG SH, JIANG HL, XI XY. Effects of root-promoting agents on flue-cured tobacco's shoot and root development grown at low temperature based on pot experiment[J]. Tobacco Science & Technology, 2021, 54(1): 17-23. (in Chinese) 陈鹏宇, 杨超, 汪代斌, 李科伟, 委亚庆, 陈益银, 张世浩, 江厚龙, 习向银. 基于盆栽试验的促根剂对低温条件下烤烟地上部生长和根系发育的影响[J]. 烟草科技, 2021, 54(1): 17-23. |
| [7] |
LI X, JIA CL, HU CH, ZHU J, CHEN TT, XIAO LZ, DAI XM, ZHANG JK. Effects of plantlet transplanting models in well cellar on growth, yield and quality of flue-cured tobacco in Chongqing[J]. Journal of Southern Agriculture, 2015, 46(6): 991-995. (in Chinese) 李茜, 贾春雷, 胡晨浩, 朱俊, 陈婷婷, 肖立增, 戴秀梅, 张建奎. 井窖式小苗移栽方式对重庆地区烤烟生长和产质量的影响[J]. 南方农业学报, 2015, 46(6): 991-995. DOI:10.3969/j.issn.2095-1191.2015.6.991 |
| [8] |
XU Y. Studies on key technologies of regulation and control on early growth stage of flue-cured tobacco in Chongqing[D]. Chongqing: Master's Thesis of Southwest University, 2014 (in Chinese). 徐盈. 重庆烤烟前期生长调控的关键技术研究[D]. 重庆: 西南大学硕士学位论文, 2014. |
| [9] |
AHMAD HM, FIAZ S, HAFEEZ S, ZAHRA S, SHAH AN, GUL B, AZIZ O, Mahmood-Ur-Rahman, FAKHAR A, RAFIQUE M, CHEN YL, YANG SH, WANG XK. Plant growth-promoting rhizobacteria eliminate the effect of drought stress in plants: a review[J]. Frontiers in Plant Science, 2022, 13: 875774. DOI:10.3389/fpls.2022.875774 |
| [10] |
OLEŃSKA E, MAŁEK W, WÓJCIK M, SWIECICKA I, THIJS S, VANGRONSVELD J. Beneficial features of plant growth-promoting rhizobacteria for improving plant growth and health in challenging conditions: a methodical review[J]. Science of the Total Environment, 2020, 743: 140682. DOI:10.1016/j.scitotenv.2020.140682 |
| [11] |
MOYER CL, ERIC COLLINS R, MORITA RY. Psychrophiles and psychrotrophs[M]//Reference Module in Life Sciences. Amsterdam: Elsevier, 2017.
|
| [12] |
MISHRA PK, BISHT SC, RUWARI P, SELVAKUMAR G, JOSHI GK, BISHT JK, BHATT JC, GUPTA HS. Alleviation of cold stress in inoculated wheat (Triticum aestivum L.) seedlings with psychrotolerant Pseudomonads from NW Himalayas[J]. Archives of Microbiology, 2011, 193(7): 497-513. DOI:10.1007/s00203-011-0693-x |
| [13] |
BISHT SC, MISHRA PK, JOSHI GK. Genetic and functional diversity among root-associated psychrotrophic Pseudomonad's isolated from the Himalayan plants[J]. Archives of Microbiology, 2013, 195(9): 605-615. DOI:10.1007/s00203-013-0908-4 |
| [14] |
SUYAL DC, JOSHI D, KUMAR S, BHATT P, NARAYAN A, GIRI K, SINGH M, SONI R, KUMAR R, YADAV A, DEVI R, KAUR T, KOUR D, YADAV AN. Himalayan microbiomes for agro-environmental sustainability: current perspectives and future challenges[J]. Microbial Ecology, 2022, 84(3): 643-675. DOI:10.1007/s00248-021-01849-x |
| [15] |
GAN YN. Screening of PGPR strains of typical legumes on alpine grassland and construction of synthetic bacteria[D]. Lanzhou: Master's Thesis of Lanzhou University, 2023 (in Chinese). 甘雅楠. 高寒草地典型豆科植物PGPR菌株筛选及合成菌群的构建[D]. 兰州: 兰州大学硕士学位论文, 2023. |
| [16] |
WANG W. Screening of low temperature adapted plant growth-promoting rhizobacteria and investigation of their promoting effects[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2016 (in Chinese). 王伟. 低温适应型植物根际促生菌的筛选及促生效应研究[D]. 南京: 南京农业大学硕士学位论文, 2016. |
| [17] |
JIAO LY, CAO XS, WANG CX, CHEN FR, ZOU H, YUE L, WANG ZY. Crosstalk between in situ root exudates and rhizobacteria to promote rice growth by selenium nanomaterials[J]. The Science of the Total Environment, 2023, 878: 163175. DOI:10.1016/j.scitotenv.2023.163175 |
| [18] |
XIONG YW, LI XW, WANG TT, GONG Y, ZHANG CM, XING K, QIN S. Root exudates-driven rhizosphere recruitment of the plant growth-promoting rhizobacterium Bacillus flexus KLBMP 4941 and its growth-promoting effect on the coastal halophyte Limonium sinense under salt stress[J]. Ecotoxicology and Environmental Safety, 2020, 194: 110374. DOI:10.1016/j.ecoenv.2020.110374 |
| [19] |
GUO QQ, YU J, SUN JG, WANG CJ, CHEN SW, YANG CL, YANG Y. Exogenous inoculation of microorganisms effect on root exudates and rhizosphere microorganism of tobaccos[J]. Advances in Microbiology, 2021, 11(9): 510-528. DOI:10.4236/aim.2021.119038 |
| [20] |
GUO YL, LI MH, WU HT, YUAN L, HUANG JG. Effects of root exudates on growth and nutrients uptake of tobacco seedlings[J]. Plant Nutrition and Fertilizer Science, 2007, 13(3): 458-463. (in Chinese) 郭亚利, 李明海, 吴洪田, 袁玲, 黄建国. 烤烟根系分泌物对烤烟幼苗生长和养分吸收的影响[J]. 植物营养与肥料学报, 2007, 13(3): 458-463. DOI:10.3321/j.issn:1008-505X.2007.03.017 |
| [21] |
NAIK PR, SAHOO N, GOSWAMI D, AYYADURAI N, SAKTHIVEL N. Genetic and functional diversity among fluorescent pseudomonads isolated from the rhizosphere of banana[J]. Microbial Ecology, 2008, 56(3): 492-504. DOI:10.1007/s00248-008-9368-9 |
| [22] |
PATTEN CL, GLICK BR. Role of Pseudomonas putida indoleacetic acid in development of the host plant root system[J]. Applied and Environmental Microbiology, 2002, 68(8): 3795-3801. DOI:10.1128/AEM.68.8.3795-3801.2002 |
| [23] |
ROCA A, PIZARRO-TOBÍAS P, UDAONDO Z, FERNÁNDEZ M, MATILLA MA, MOLINA-HENARES MA, MOLINA L, SEGURA A, DUQUE E, RAMOS JL. Analysis of the plant growth-promoting properties encoded by the genome of the rhizobacterium Pseudomonas putida BIRD-1[J]. Environmental Microbiology, 2013, 15(3): 780-794. DOI:10.1111/1462-2920.12037 |
| [24] |
AKULA R, MUKHERJEE S. New insights on neurotransmitters signaling mechanisms in plants[J]. Plant Signaling & Behavior, 2020, 15(6): 1737450. |
| [25] |
LIU XT, YAO T. Screening, identification and characteristics of low-temperature-tolerant plant growth promoting rhizobacteria in alpine meadow[J]. Acta Prataculturae Sinica, 2022, 31(8): 178-187. (in Chinese) 刘晓婷, 姚拓. 高寒草地耐低温植物根际促生菌的筛选鉴定及特性研究[J]. 草业学报, 2022, 31(8): 178-187. |
| [26] |
ZHANG CS, FENG C, ZHENG YF, WANG J, WANG FL. Root exudates metabolic profiling suggests distinct defense mechanisms between resistant and susceptible tobacco cultivars against black shank disease[J]. Frontiers in Plant Science, 2020, 11: 559775. DOI:10.3389/fpls.2020.559775 |
| [27] |
LIU YX, LI X, CAI K, CAI LT, LU N, SHI JX. Identification of benzoic acid and 3-phenylpropanoic acid in tobacco root exudates and their role in the growth of rhizosphere microorganisms[J]. Applied Soil Ecology, 2015, 93: 78-87. DOI:10.1016/j.apsoil.2015.04.009 |
| [28] |
MIYAKE Y, HIRAMITSU M. Isolation and extraction of antimicrobial substances against oral bacteria from lemon peel[J]. Journal of Food Science and Technology, 2011, 48(5): 635-639. DOI:10.1007/s13197-011-0330-3 |
| [29] |
ZHAO S, TANG H. Enhanced production of valtrate in hairy root cultures of Valeriana jatamansi Jones by methyl jasmonate, jasmonic acid and salicylic acid elicitors[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2020, 48(2): 839-848. DOI:10.15835/nbha48211891 |
| [30] |
DAKORA FD, MATIRU VN, KANU AS. Rhizosphere ecology of lumichrome and riboflavin, two bacterial signal molecules eliciting developmental changes in plants[J]. Frontiers in Plant Science, 2015, 6: 700. |
| [31] |
PHILLIPS DA, JOSEPH CM, YANG GP, MARTINEZ-ROMERO E, SANBORN JR, VOLPIN H. Identification of lumichrome as a sinorhizobium enhancer of alfalfa root respiration and shoot growth[J]. PNAS, 1999, 96(22): 12275-12280. DOI:10.1073/pnas.96.22.12275 |
| [32] |
SANCHEZ J, MANGAT P, Angeles‐SHIM RB. Weathering the cold: modifying membrane and storage fatty acid composition of seeds to improve cold germination ability in upland cotton (Gossypium hirsutum L.)[J]. Agronomy-Basel, 2019, 9(11): 684. DOI:10.3390/agronomy9110684 |
 2024, Vol. 51
2024, Vol. 51