扩展功能
文章信息
- 戎新倩, 舒青龙
- RONG Xinqian, SHU Qinglong
- 基于脑-肠-微生物轴的肠易激综合征机制与治疗研究进展
- Progress in the pathogenesis and treatment of irritable bowel syndrome based on the brain-gut-microbiota axis
- 微生物学通报, 2023, 50(9): 4190-4205
- Microbiology China, 2023, 50(9): 4190-4205
- DOI: 10.13344/j.microbiol.china.230253
-
文章历史
- 收稿日期: 2023-03-29
- 接受日期: 2023-05-25
- 网络首发日期: 2023-06-14
肠易激综合征(irritable bowel syndrome, IBS)是最常见的功能性肠病之一,主要症状表现为腹痛以及排便习惯的改变,在全球范围内,IBS影响着约20%的人口[1],以罗马Ⅲ标准进行统计,IBS的合并患病率高达9.2%[2],严重影响着患病人群的生活质量和工作效率。截至目前,IBS的发病机制尚不明确,现代医学研究表明,肠道微生物组、肠道通透性、肠道免疫、肠动力、内脏感觉、脑肠相互作用和社会心理状态等是IBS发病的重要因素[3]。其中,肠道微生物组、社会心理状态和脑肠相互作用均属于脑-肠-微生物轴涵盖范围,中医研究认为,脑、肠作为同一个有机体的两个端口,在生理上相互关联,在病理上相互影响[4],中医药在对IBS的治疗及相关症状的改善中发挥着越来越重要的作用。然而,从中西医结合角度阐述与脑-肠-微生物轴相关的IBS机制与治疗等尚属空白。因此,本文根据最新文献进展,从脑-肠-微生物轴及中医病因病机角度,对IBS发病、治疗及其相关研究等进行综述,主要内容包括脑肠轴与IBS、肠道微生物的中介作用、脑-肠-微生物轴对IBS的靶点治疗性、中医药-脑肠轴-IBS的机制与治疗方案等,并结合笔者自己的工作进行了展望,以期为相关的科研及临床工作提供参考。
1 脑肠轴与IBS脑肠轴是一种双向神经体液通路系统,它整合了大脑与胃肠道的功能。脑肠轴的双向通讯网络包括中枢神经系统(central nervous system, CNS)、自主神经系统(autonomic nervous system, ANS)、肠神经系统(enteric nervous system, ENS)和下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴。研究表明,肠道微生物群和自主神经系统之间的作用与交流是IBS症状持续存在的核心因素[5],双向调节轴中的神经免疫通路系统的紊乱与平衡成为IBS发病与治疗中的关键所在[6]。根据排便习惯改变的主要模式,罗马Ⅳ标准将IBS分为4个不同的亚型:IBS伴便秘(IBS-constipation, IBS-C)、IBS伴腹泻(IBS-diarrhea, IBS-D)、IBS伴便秘和腹泻混合模式(IBS-M)和未分类的IBS。
目前,肠易激综合征的诊断依赖基于症状的标准,需要先排除相关疾病特征,如50岁后出现不明原因的体重减轻、某些器质性胃肠道疾病的家族史、胃肠道失血的证据和不明原因的缺铁性贫血以及相关临床筛查,如全血细胞计数、C反应蛋白或粪便钙保护蛋白、乳糜泻血清学测试和年龄适当的结直肠癌筛查的表现,以此来排除类似IBS的器质性疾病[7]。近年来,研究热点转向开发新的生物标志物和使用心理标志物来帮助诊断IBS,脑-肠-微生物轴的发现以及进一步研究为其提供了理论支持。在临床应用中,脑肠互动被广泛应用到IBS的诊断与治疗等多个环节。
1.1 脑肠肽与IBS脑肠肽是中枢神经系统和肠神经系统共同的递质,是脑肠轴及其包含的神经免疫通路系统在物质方面的具体体现,具有神经递质和激素的双重作用,是脑肠互动中的关键物质性因素。已证实的脑肠肽包括:P物质(substance P, SP)、基因相关肽(calcitonin gene-related peptide, CGRP)、血管活性肠肽(vasoactive intestine peptide, VIP)、神经肽Y (neuropeptide Y, NPY)、神经降压素(neurotensin, NT)、促肾上腺皮质激素释放因子、催产素和生长素释放肽等[8]。在IBS疾病中,内脏高敏性是腹痛、腹泻症状的重要机制之一,研究表明急性和慢性应激引起HPA轴激活诱导促肾上腺皮质激素释放因子的释放,会导致内脏痛觉高敏,表明脑肠肽在IBS发病过程中充当了重要介质的作用[9]。在IBS的一项动物试验中,IBS大鼠背根神经节中神经递质蛋白水平、SP和CGRP等脑肠肽减少,提示含有脑肠肽的神经通路可能是调节胃肠功能中起重要作用的神经通路之一[10]。
目前对脑肠肽的作用研究主要包含两个方向:(1) 从肠道到大脑方向,包含4个信息载体:迷走神经和脊髓传入神经元、免疫介质(如细胞因子)、肠道激素、肠道微生物群衍生的信号分子;(2) 从中枢神经系统到肠道方向,也包含4种信息载体:交感神经传出神经元、副交感神经传出神经元、肾上腺髓质相关神经内分泌因子和肾上腺皮质相关神经内分泌因子[11]。大脑通过自主神经和神经内分泌途径向肠道的输出可能导致胃肠道功能障碍,进而导致持续处于内脏高敏状态[12],可能是IBS发生的重要机制之一。另外,神经炎症可能通过脑肠轴参与IBS的病理生理,神经炎症导致神经内分泌途径和糖皮质激素受体基因发生改变,总体促炎表型、HPA轴和5-羟色胺(5-hydoxytryptamine, 5-HT)功能失调[13],这也可以部分解释IBS的症状[14]。因此,在脑肠双向互动中,脑肠肽可能既作为催化物又作为产物来双向调控着IBS的发生及相关症状。
1.2 脑肠通路与IBS神经免疫通路对CNS与ENS之间的双向调节也发挥着至关重要的作用。研究表明,脑肠互动主要由CNS-ANS-ENS实现,神经通路包括起源于脊髓背根神经节的传入神经以及起源于脑干核团及脊髓背角的传出神经,其传入神经将内脏和躯体感觉投射到大脑的整合皮层区(如前后扣带回、岛叶及杏仁核皮层),同时,又通过传出神经作用于平滑肌及腺体来影响内脏感觉信号的传导,这一点在核磁共振成像中也有证实[15]。在神经系统方面,肠道主要受ENS、迷走神经、脊髓神经、交感神经及副交感神经控制,研究表明脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)于中枢神经系统和胃肠道上大量表达能促进神经系统的发育,维持成熟神经细胞的正常功能,还能调节胃肠道动力和内脏敏感性[16]。在免疫方面,研究已经确定了IBS-D和感染型IBS的几个易感基因,这些基因参与了先天免疫和细菌识别,也保持了肠道屏障的完整性[17]。IBS患者被证实单核细胞Toll样受体2 (Toll-like receptor 2, TLR2)表达增加以及TLR诱导的细胞因子分泌模式在IBS患者中发生改变,这些支持了肠道微生物群和黏膜免疫系统之间的联系[18]。
最新研究表明,脑肠电路通路系统具有合理性,该通路检测肠道微生物并将此信息传递到中枢神经系统区域,而中枢神经系统区域反过来又调节肠道生理机能[19]。对于肠道黏膜,研究表明,慢性焦虑和抑郁本身会损害屏障功能,患有焦虑和抑郁的IBS患者屏障功能受损更大[20]。总之,目前关于IBS的研究几乎都是在脑肠轴层面进行的,包括HPA轴和脑肠双向自主神经系统的参与、免疫应答的激活、与焦虑和抑郁共病、内感受的增加和神经痛处理的改变等。
2 肠道微生物的中介作用 2.1 脑-肠-微生物轴的概念据最新研究,脑-肠轴的概念进一步扩充为脑-肠-微生物轴,强调了微生物在生物轴的作用,其中,肠道菌群是微生物中的主要角色之一,在生物轴中充当着重要的中介作用。肠道菌群(gut microbiota)被称为人体“第二大脑”,其含有的基因约为人体自身基因的150倍,98%的肠道菌群由厚壁菌门(Bacteroidetes)、拟杆菌门(Firmicutes)、变形杆菌门(Proteobacteria)和放线菌门(Actinobacteria)这4个细菌门组成,但大多数是厚壁菌门或拟杆菌门[21]。肠道菌群的改变能够影响试验动物的行为、认知、情绪和相关神经递质的功能。Wu等[22]通过对比无菌小鼠和抗生素治疗小鼠的应激反应和社会行为,发现该神经反应是由微生物组调节小鼠特定大脑区域的神经元活动来完成的,特定的肠道细菌可以抑制HPA轴的激活,微生物组可以通过介导大脑压力反应的离散神经回路影响小鼠的社会行为,促进社交活动并降低感受社交压力后小鼠的皮质酮水平。由此可见,在脑肠交流及相关神经机制中微生物的作用是显而易见的。
另外,饮食调节在一些神经系统疾病中发挥着独特作用,这也解释了肠道微生物在脑肠交流中的介质作用。例如,生酮饮食可用于治疗难治性癫痫,其方法为生酮饮食者肠道微生物群的移植以及用阿克曼氏菌(Akkermansia)和副拟杆菌(Parabacteroides)进行喂养,其作用包括全身性γ-谷氨酰化氨基酸减少和海马4-氨基丁酸/谷氨酸水平升高,具体机制为细菌交叉喂养会降低γ-谷氨酰转肽酶活性,促进体内癫痫发作时的自我保护,在此过程中,肠道菌群作为中间介质,调节了宿主的新陈代谢和癫痫易感性[23]。由此可见,肠道菌群似乎可以产生部分神经活性产物,对于自闭症谱系障碍的研究也论证了这一观点[24]。因此,为了进一步阐释脑-肠-微生物轴的观点,我们建立了CUMS大鼠抑郁症模型并采集大鼠粪便样本,选择丁酰辅酶A和乙酸CoA转移酶基因引物进行PCR扩增,确定产丁酸菌的多样性,结果表明中医方案增加了CUMS大鼠肠道产丁酸盐细菌的门和属数量多样性,2个菌门分布于厚壁菌门和拟杆菌门,4个菌属分布于真杆菌属(Eubacterium)、罗斯伯氏菌属(Roseburia)、梭菌属(Clostridium)和拟杆菌属,因此,中医方案可以通过调节肠道产丁酸盐细菌的多样性,特别是Roseburia sp.和Eubacterium sp.改善抑郁样行为[25]。
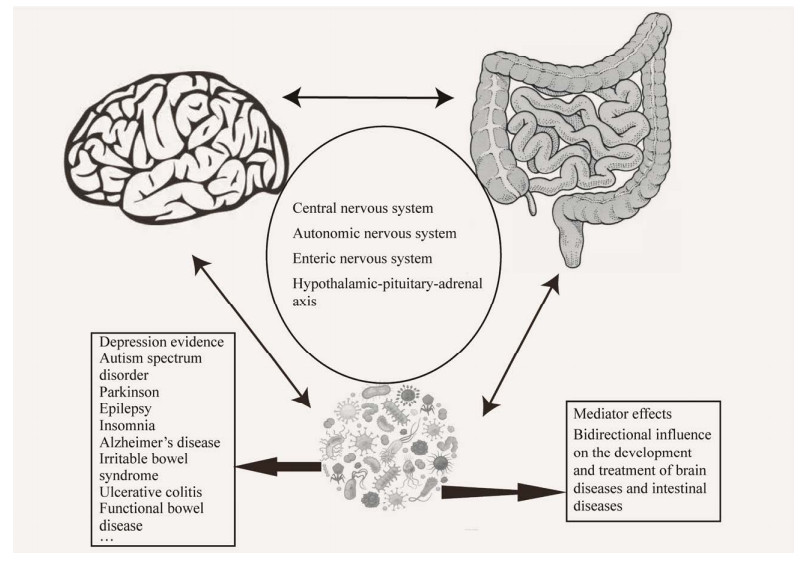
综上可知,脑肠交流可能不仅仅是通过脑肠肽、脑肠通路的作用实现的,更有可能的是,脑肠互动是由数个环节构成的,除了神经递质与神经通路的作用,肠道微生物的作用也是其中重要一环。因此,以肠道微生物为介质的脑肠通路与神经精神性疾病、胃肠道疾病的发病机制之间的关联性值得进一步研究与探索,如图 1所示。
|
| 图 1 脑-肠-微生物轴机制图 Figure 1 Schematic diagram of the brain-gut-microbiota axis. |
|
|
肠道微生物群具有明确的功能,与宿主形成互惠关系,从饮食中获取额外的能量和营养,保护宿主免受病原体的侵害,最新研究将其明确为一个“真正的器官”,而其组成的特定变化似乎在IBS病理生理学中起着至关重要的作用[26]。首先,Quigley等[27]提出IBS的发病机制可能与应激等中枢刺激作用有关,应激可破坏黏膜免疫,降低微生物多样性,改变肠道屏障功能,导致肠道功能障碍,进而导致的肠道微生物群失调可能引发IBS,这可以通过肠道微生物群产生的粪便短链脂肪酸(short-chain fatty acid, SCFA)的情况进行评估。例如,Sun等[28]综合分析表明,就粪便SCFA而言,IBS患者和健康对照组患者之间存在差异,与健康对照组相比,IBS-C患者粪便中的丙酸盐和丁酸盐减少,而IBS-D患者粪便中的丁酸盐增加,因此,丙酸盐和丁酸盐可作为IBS诊断的生物标志物之一。另外,IBS患者的肠道活检和粪便上清液在体外都显示了明显的屏障损害作用,这也反向提示外周介质的存在,而大多数研究表明,屏障功能丧失与腹痛和肠功能改变等症状之间存在正相关,是IBS发病机制中的重要因素[29]。因此,肠道微生物的组成状况与肠道屏障作用的发挥息息相关,肠道健康情况特别是IBS患者的肠道环境评估可以通过对肠道微生物产物SCFA的测算进行,SCFA也成为IBS诊断的重要生物学标志之一。此外,真菌也是肠道微生物的组成部分之一。在肠道真菌群的序列分析中显示IBS患者肠道中酵母菌处于富集状态,对粪便中真菌分离物的培养组学分析显示,与正常人的白念珠菌分离物相比,IBS患者肠道菌群中的念珠菌属升高,并表现出克隆扩增和明显的基因型特征以及不同的表型特征[30]在IBS的发病过程中,肠道菌群往往呈现有益菌群的缺失和有害菌群的聚集,这也是IBS诊断中的重要生物学标志之一。
在IBS的诊断中,心理学标志也是重要指标之一,对于IBS患者,微生物β多样性与痛苦和抑郁显著相关,抑郁症与毛螺菌科(Lachnospiraceae)丰度呈负相关,痛苦、焦虑、抑郁和压力感知阈值的患者表现出更高的变形菌属(Proteobacteria)丰度,焦虑症患者的特征是肠道拟杆菌属升高,占总细菌丰度的3.9%[31]。这可能为IBS诊断中的心理学标志以及治疗中的微生态制剂提供了新思路,但还需要更多证据支持。肠道微生物是脑肠互动的关键纽带,人精神异常与肠道微生物环境改变引发的肠道症状密切关联,一方面,反复精神刺激(如抑郁、焦虑等)可导致肠道菌群的改变;另一方面,肠道菌群结构的改变与神经系统的发育以及大脑的功能密切相关,在脑肠的双向交流互动中,肠道微生物所发挥的作用不是单向的,而是双向的,这也解释了IBS诊断中生物学标志和心理学标志的共同存在及相互作用。
3 现代医学的IBS治疗方案目前,对于IBS的治疗,饮食改变通常是治疗的第一条线。短链碳水化合物限制饮食和无麸质饮食对IBS治疗具有积极作用[32]。此外,生活方式治疗包括补充替代药物、益生菌和薄荷油作为辅助药物等,但尚未在IBS-D/M中具体描述。基于脑肠轴理论,得益于心理学标志物的存在,心理疗法治疗IBS得到广泛关注。
在药物治疗方面,除了非处方的抗腹泻药、抗痉挛药和抗抑郁药外,现在还包括治疗胆汁酸吸收不良药物,以及利福昔明、依鲁沙多林和阿洛司琼等。未来的治疗可能包括粪菌移植、克罗非列默和血清素拮抗剂,但还需要进一步的研究[33]。针对IBS的具体分型,对IBS-D患者的治疗选择主要包括抗生素如利福昔明、外周阿片类激动剂、混合阿片类激动剂/拮抗剂、胆汁酸螯合剂和5-HT 3型受体拮抗剂。IBS-C的一线治疗药物以填充剂和渗透性泻药为代表,而鲁比前列酮和利那洛肽则适用于以上方案治疗效果均不佳的患者。
基于脑-肠-微生物轴,胃肠道微生物制剂参与治疗IBS的方案带来了一个更加引人注目的探索领域,益生菌、益生元、合生元以及粪菌移植均展示出了治疗IBS的潜力[34]。以上方案的作用是改变肠道微生物群的组成,例如:益生菌对IBS的积极作用大多数为调节肠道中参与IBS症状发生的微生物群。对于IBS患者的焦虑和抑郁水平明显高于健康人群的状况应进行系统检查和治疗[35],因为心理因素是症状严重程度、症状持续性和治疗反应的重要调节因素。在一项临床试验中,双歧杆菌(Bifidobacterium) NCC3001被用于有焦虑和抑郁情绪的IBS患者,结果显示益生菌改善了抑郁症情况,降低了IBS患者的焦虑得分,提高了IBS患者的生活质量,这可能与益生菌减少边缘反应性的变化有关[36]。但临床使用中还需要更多证据支持。目前对于治疗IBS-D的药物包括阿洛司琼、依鲁沙杜林和利福昔明,根据患者报告的IBS-D症状对生活质量的负面影响情况统计,对有效治疗和改善该病症的需求尚未得到满足[37]。因此,IBS的治疗依然面临靶点单一、用药效果个体化差异大、难以实现脑肠同治、副作用大、易复发等缺点,因此中西医联合治疗具有更好的潜力。
4 中医药-脑肠轴-IBS的机制与治疗方案 4.1 中医基础理论对脑肠轴的认识脑肠的双向调节互动在中医理论中并不新奇,《素问·逆调论》中曾言:“胃不和则卧不安”,胃肠道通行运化功能的正常与否反向作用于人脑,进而影响人的情志,《本草纲目·辛夷》中也有言:“脑为元神之腑,统帅五脏六腑”,一方面,脑的功能失常不仅可以导致精神神志方面疾病,也会波及五脏六腑,影响肠腑泌别清浊,排泄糟粕的功能;另一方面,脑位于颅内,统领诸神,脑窍贵在清灵通利,如果肠腑通降失常,导致腹痛泄泻或糟粕内结,也会影响脑之清灵,进而产生精神神志疾病,正如《伤寒杂病论》中曾言:“阳明病多汗,津液出,胃中燥,大便必硬,硬则谵语”。
脑肠轴除了符合中医藏象理论,也符合中医经络学说。《灵枢·经脉》言:“大肠手阳明之脉,起于大指次指之端……至目锐眦……至目内眦,斜络于颧”经脉循行,一气周流,下属于肠,上通于脑,是信息的载体更是物质的通路。更有“头为诸阳之会”,脏属阴,腑属阳,大肠腑位于诸腑最下,与脑犹如一轴之两端,二者经脉从属相通,生理上相互联系,病理上相互作用,在人体中可看作统一的整体。
在中医临床实践方面,对于脑-肠-微生物轴也进行了一定阐释,例如:王雪等[38]利用针灸“调神和胃法”治疗胃肠功能紊乱取得了良好效果;程倩[39]使用针刺方法对抑郁症患者进行临床试验发现,针刺可以改善轻中度抑郁症患者抑郁症状和胃肠道不适症状;张莎莎等[40]临床研究发现“健脾止动汤”治疗儿童多发性抽动症的机制主要为神经通路系统与肠道菌群的相互作用进而抑制抽动症状。由此可见,基于中医药对脑-肠-微生物轴的调节及相关疾病的治疗具有临床基础,尤其是针刺方案可能通过作用于神经通路系统而起到双向调节脑肠稳态,影响肠道菌群构成的作用,这也与上文提到的肠道微生物和神经通路系统均作为脑肠互动中的一环相契合,但中医药方案尚有待于深入挖掘及推广。
4.2 中医对IBS发病机制的认识目前,IBS的发病机制和病理生理学尚不完全清晰。最新提出的生物-心理-社会模型将IBS带来的慢性疼痛概念化为肠-脑稳态失调,提出了周边因素和中心因素相互影响是解释IBS较为公认的框架。此种框架与中医理论具有高度契合性。首先,人体是一个统一的整体,IBS是一种由多种因素如心理、免疫、感染、内分泌和遗传引起的异质性疾病,从人体生理来看,涉及整体性稳态及相关的心理、情绪和肠黏膜稳态等多种因素;从不同的IBS亚型病理来看,涉及肝脾不调、肠胃升降失司等多种因素,这些因素统一于人体生态系统中,唯有平衡才能运转正常、升降相合,平衡一旦被打破就会出现包含精神情志、消化排泄等多方面疾病。其次,作为宿主,肠道菌群组成的肠道微生态环境也是一个统一的整体,现代研究发现肠道菌群最显著的特征是其稳定性,若平衡失去破坏会发生各种肠内外疾病,IBS则为典型的肠道微生态失衡性疾病。因此,IBS的发病机制符合中医的整体观和平衡思想。
近年来,在IBS的研究方面,调查焦虑和IBS的论文总数也大幅增加。最近的研究证实了一个事实,即IBS症状在应激事件中往往会加剧,压力会加重IBS症状,精神病治疗对胃肠症状有积极影响[41]。从IBS的发病来看,焦虑或抑郁情绪往往是导致内脏高敏进而出现IBS临床症状的重要原因,而在IBS的病程中往往会加重焦虑和抑郁情绪[42],长此以往会形成恶性循环,脑肠互动失衡状况愈加严重。例如,辛英瑛等[43]对210例IBS患者进行临床试验发现:IBS患者焦虑、抑郁及失眠发生率高于健康人群;IBS-D组患者较IBS-C组患者容易伴有焦虑、入睡延迟,IBS-C组患者较IBS-D组患者容易伴有抑郁、夜间易醒及早醒;IBS-M组患者较其他两组容易同时伴有焦虑、抑郁、入睡延迟、易醒及早醒。在抑郁症的造模中,小鼠会伴随存在肠道应激症状,对其肠道菌群进行检测评估发现其结构与多样性均发生了变化[44]。中医认为,人有七情“喜怒忧思悲恐惊”,七情过极会直接影响人五脏六腑的整体气机和气血变化,七情发于脑,落于五脏六腑。例如,《景岳全书·泄泻》说:“凡遇怒气而作泄泻者……此肝脾二脏之病也,盖以肝木克土,脾气受伤而然。”怒气发于脑,伤于肝,肝木横犯脾土,则发于泄泻,肝木化火,则大便溏结失调,泻久五脏六腑皆虚,则发为便秘,此过程与IBS三种主要亚型的临床表现具有高度契合性,因此IBS的发病机制符合中医情志致病和肝脾互动的原理。
对于IBS患者而言,因情绪恶化进而加重胃肠道症状。从这个角度来说,脑-肠-微生物轴可能并不作为直线存在,而作为环形存在,每一环与症状相关。对于IBS的治疗,需要尽量扣住其中一个环节进行治疗,可以包含但不限于生物学因素、心理学因素等,基于肠道微生物角度的切入符合中医治则及中医药-脑肠轴-IBS理念。
4.3 中医药对IBS的治疗作用IBS的诊断标准在不断发展,目前,罗马Ⅳ标准应用较为广泛。根据诊断的IBS不同亚型有多种药物和非药物治疗手段。随着研究的不断深入,IBS的治疗方案逐渐向个体化方向靠拢[45]。然而中医在治疗脑肠轴紊乱疾病时使用辨病论治、辨证论治的诊疗模式,充分体现了“因人制宜”的精准诊疗思路,是实施个体化诊疗的临床实践。一人一方、一证一方和多靶点治疗是中医药治疗IBS的优势,其中,针灸治疗方案更是具有安全性高,作用力强,随证变化灵活性高等特点,与传统抗痉挛药物相比,针刺方案表现出更好缓解IBS带来的腹痛症状的效果,并且副作用发生率更小[46]。对于IBS发病时间长、腹泻程度重的患者,艾灸方案则表现出更加温和持久的改善作用[47]。另外,针灸在人体中表现出的双向调节作用使得针灸疗法不仅可以作用于IBS-D患者,对于IBS-C患者也具有良好的治疗效果[48]。总之,中医药方案在IBS的治疗中展现出独特优势。
对于肠道微生物的调节,中医偏重于“整体论”,以“天人合一” “阴阳和谐”的基本理论为基础,肠道菌群与宿主相互影响、相互关联。具体内容为:菌群为“阴”,宿主为“阳”,任何一部分出现问题都会导致机体作为一个整体的失调[49]。该点契合现代微生态学的观点,我国现代微生态学奠基人魏曦教授曾指出:“中医的四诊八纲是从整体出发,探讨人体平衡和失调的转化机制,并通过中药使失调恢复平衡。因此微生态学很可能成为打开中医奥秘大门的一把金钥匙”[50]。
研究发现,在腹泻型疾病的治疗中,中药和中药复方对肠道微生态的调节作用不可忽视。在中药复方方面,与艰难梭菌相关的体外试验结果表明,参苓白术散水煎剂展示出对艰难梭菌的抑制作用[51],可用于与艰难梭菌感染相关的腹泻型疾病;此外,中医传统方剂理中汤对于肠道菌群丰度、多样性与结构具有明显的改善作用[52],可能作为其治疗腹泻型疾病的机理之一,IBS作为以腹泻为典型症状之一的疾病,理中汤也长期作为IBS中医药治疗的有效方剂之一[53],其具体机理值得进一步试验及临床探索。
近年来,对于中医药的药理学研究不断进步,探究中药及方剂中的药理学成分及作用机制成为新的研究方向。在中药有效成分对肠道微生物的调节方面,中药多糖是值得研究的潜在活性成分。在肠道微生物中,一个特别的基因簇,即多糖利用位点的存在,成为肠道微生物可以利用多糖成分的关键所在。人类基因组只能编码帮助消化的碳水化合物活性酶,将蔗糖、乳糖和淀粉分解成单糖,但不能对复杂的多糖进行降解,而肠道微生物则可以通过多糖利用位点将复杂多糖降解为单糖,并产生短链脂肪酸。不同的中药多糖作为碳源,肠道菌群展示出不同的多糖利用特点[54],因此中药多糖可能成为靶向调节肠道微生物的有效成分。
在单味中药多糖方面,黄芪多糖和炙黄芪多糖展示出明显的肠道菌群恢复能力,经过给药,在门水平上,拟杆菌门和变形菌门占比显著减少,厚壁菌门占比明显增大(P < 0.05);在属水平上,炙黄芪多糖400 mg/kg组能显著增加3种有益菌(乳酸菌、罗斯氏菌和unidentified Ruminococcaceae)的占比(P < 0.05或P < 0.01),而黄芪多糖400 mg/kg组能显著增加拟杆菌和有益菌乳酸菌的占比(P < 0.01)[55]。在中药复方多糖方面,以参苓白术散多糖和理中汤多糖为例,一方面,复方多糖可以作为碳源影响肠道菌群的丰度、结构与多样性,达到疾病治疗的目的[56];另一方面,部分肠道菌群作为功能菌群。例如,产丁酸菌有利于中药多糖的降解及丁酸盐的产生[57],维护肠道稳态,保持人体健康。例如,瓜尔豆胶作为中药多糖之一,在临床应用中改善了患者的粪便性状,展示出对IBS的明显治疗效果[58],其机制与瓜尔豆胶增加了IBS患者短链脂肪酸、乳酸杆菌和双歧杆菌的结肠含量有关[59]。除果胶多糖外,膳食纤维类多糖在IBS的治疗中也表现出良好效果,特别是传统中药中的膳食纤维,如车前草等在临床案例中时有应用[60]。因此,对于IBS类具有肠道菌群失衡情况的疾病,中药多糖似乎成为有潜力的治疗方案之一。
目前,在IBS的治疗方面,微生态制剂已有所应用,但单纯的益生菌治疗往往面临治疗效果不持久、易复发等弊端,而中药多糖基于碳源利用原理进而调节肠道微生物的丰度及其多样性,是一个新的研究方向,也是靶点式治疗方案的新探究,可以为以IBS为代表的肠道疾病以及脑-肠-微生物轴失衡所引起的精神系统疾病的治疗提供部分微生态学试验参考。常用中医药方案的部分整理见表 1。
| Program | Type | Experimental subjects | Experimental results | Mechanism of action |
| An Chang Tang[61] | IBS-D | Male SD rats, senna decoction, restraint stress method modeling | Improvement in abdominal pain | Regulation of pPKCγ and ERK1 gene expression in the dorsal horn of the spinal cord modulates central hypersensitization of pain signaling in rats |
| Wang Shi Bao Chi Wan[62] | IBS-D | Female C57BL mice, molded by castor oil-induced diarrhea method | Increased intestinal transit, improved intestinal permeability, reduced diarrhea symptoms | Up-regulates intestinal linker proteins, increases the abundance of Bifidobacterium and Desulfovibri spp., inhibits Bacteroides fragilis, and reduces inflammatory cytokines |
| Bu Zhong Yi Qi Tang and Bifidobacterium[63] | IBS-C | 168 patients with IBS-C | Improvement of abdominal pain, bloating and constipation symptoms | Decrease serum SP, SS, 5-HT levels and increase serum NPY levels |
| Atractylodes oil[64] | IBS-D | SPF grade SD rats, colonic injection molding method with acetic acid | Improvement in diarrhea, weight gain, and decrease in stool water content | Reduces IL-10, AQP3, TNF-α, IL-6, 5-HT, VIP and SP levels |
| Spiderwort extract[65] | IBS-D | Female SD rat, Maternal and infant separation combined with restraint, ice swimming, and tail clamping modeling method | Improvement in diarrhea, improvement in depression, improvement in visceral sensitivity | Down-regulates bile acid and phenylalanine metabolism, up-regulates steroid hormone, linoleic acid, arachidonic acid and sphingolipid metabolism, and increases ceramide synthesis |
| Tongxie Yaofang[66] | IBS-D | Neonatal SD male rats, mother-offspring separation, chronic restraint, and senna gavage modeling method | Improved visceral sensitivity and depressive and anxiety-like behavior in model rats | Reduces serum 5-HT levels and decreases the number of chromophobic cells and mast cells in intestinal tissues |
| Qilian jiechangning decoction[67] | IBS-D | 96 patients with IBS-D, control group on trimebutine maleate capsules | Improvement of abdominal pain and diarrhea symptoms, fatigue and dullness | Reduces 5-HT, VIP, substance P, DAO, d-lactate, ET levels |
| Electroacupuncture points Hegu and Zusanli[68] | IBS | Wistar rats, mother-offspring separation, acetic acid enema, and colorectal dilatation modeling method | Decreased intestinal sensitivity and contractile dynamics, improved abdominal pain and diarrhea | Reduction of positive expression of M3 receptor immunoreactors in rat colon |
| Heat-sensitive moxibustion[69] | IBS | SD male rats, chronic stress modeling method | Improved intestinal propulsion rate, visceral sensitivity, and weight gain | Reduce serum CRH, ACTH, CORT levels |
| Electroacupuncture Yintang and Dachangshu points[70] | IBS | Wistar neonatal rats, mother-offspring separation, acetic acid enema and colorectal dilatation | Decreased abdominal retraction reflex and improved abdominal pain | Increased positive expression of D2 receptors in the dorsal nucleus of the vagus nerve and dopamine D2 receptors in the colonic musculature |
| Moxibustion[71] | IBS-D | Healthy male rats, chronic restraint, Senna leaf solution gavage modeling method | Relief of inflammation of the colonic mucosa and reduction of diarrhea | Reduction of TNF-α and IL-6 in serum and TLR4, MyD88, NF-κB (p65) mRNA and protein expression levels in colon tissue |
| Acupuncture points Shangjuxu, Tianshu, Taichong, Sanyinjiao and Zusanli[72] | IBS-D | 123 patients with IBS-D with liver depression and spleen deficiency | Reduced clinical symptoms and improved anxiety and depression | Regulation of ERK1 mRNA and ERK2 mRNA expression in MAPK signaling pathway and reduction of serum CGRP and VIP levels |
综上所述,本文主要从脑-肠-微生物轴出发,结合脑肠肽及神经免疫内分泌脑肠通路的IBS发生机制及治疗方案,其中重点介绍了以肠道微生物为介质的脑肠互动,评估了肠道微生态环境与IBS之间的多方向作用,并且以中医理论作为基点阐述了中医理论对脑-肠-微生物轴的认识和中西医研究的交汇点,汇总了中医药对IBS的治疗方案以及方案下的微生态调节机制。
根据以往的研究报道,我们针对IBS的中西医研究方向及相关问题提出以下展望:(1) 长时间以来,神经科学深陷于“无微生物”的理论中[73],随着对人体微生物研究的不断深入,此观念逐渐被修正,但微生物如何对人体的神经系统发挥作用、发挥着怎样的作用仍不清楚,微生物-脑-肠轴理论的兴起为微生物在神经科学中的作用研究指出了新的方向,基于研究汇总,脑-肠-微生物轴可能为环形结构,任何一个环节的改变都可能影响整体的趋势,其中肠道微生物可作为突破口,但具体机制仍需进一步探索。(2) 目前,IBS疾病的定义、机制及治疗方案尚无统一答案[74],明确的是其发病机制和症状表现具有多样性,长期以来,中医药在疾病的多靶点治疗方面一直具有良好的疗效,随着中药药理学的不断发展,证实了中药多糖成分与肠道微生物含有多糖利用位点紧密联结。肠道微生物可作为突破口治疗以IBS为代表的肠道疾病及精神系统疾病,探究肠道菌群与中药多糖的降解机制或成为有价值的研究方向。(3) 中医药方案,特别是与针灸方法的联合使用似乎在以IBS为代表所涉及的微生态-神经系统疾病的治疗中发挥着超乎预期的效果[75],此种联合方案在IBS治疗中的应用以及在其他涉及微生态-神经系统稳态调节方面疾病中的平行推广值得深入思索。(4) 以上观点及进一步探索中医药在IBS中的具体作用机制和治疗效果需要更多临床及动物试验支持。
| [1] |
BONETTO S, FAGOONEE S, BATTAGLIA E, GRASSINI M, SARACCO GM, PELLICANO R. Recent advances in the treatment of irritable bowel syndrome[J]. Polish Archives of Internal Medicine, 2021, 131(7/8): 709-715. |
| [2] |
OKA P, PARR H, BARBERIO B, BLACK CJ, SAVARINO EV, FORD AC. Global prevalence of irritable bowel syndrome according to Rome Ⅲ or Ⅳ criteria: a systematic review and meta-analysis[J]. The Lancet Gastroenterology and Hepatology, 2020, 5(10): 908-917. DOI:10.1016/S2468-1253(20)30217-X |
| [3] |
LACY BE, PIMENTEL M, BRENNER DM, CHEY WD, KEEFER LA, LONG MD, MOSHIREE B. ACG clinical guideline: management of irritable bowel syndrome[J]. American Journal of Gastroenterology, 2020, 116(1): 17-44. |
| [4] |
XIONG LL, SHU QL, TANG FR, FENG Y. Research progress of microecology of traditional Chinese medicine based on "brain-intestine axis"[J]. Lishizhen Medicine and Materia Medica Research, 2021, 32(6): 1438-1443. (in Chinese) 熊林林, 舒青龙, 唐芳瑞, 封勇. 基于"脑肠轴"的中医药微生态研究进展[J]. 时珍国医国药, 2021, 32(6): 1438-1443. |
| [5] |
SHI XD, HU YD, ZHANG B, LI WN, CHEN JD, LIU F. Ameliorating effects and mechanisms of transcutaneous auricular vagal nerve stimulation on abdominal pain and constipation[J]. JCI Insight, 2021, 6(14): e150052. DOI:10.1172/jci.insight.150052 |
| [6] |
AZIZ MNM, KUMAR J, MUHAMMAD NAWAWI KN, RAJA ALI RA, MOKHTAR NM. Irritable bowel syndrome, depression, and neurodegeneration: a bidirectional communication from gut to brain[J]. Nutrients, 2021, 13(9): 3061. DOI:10.3390/nu13093061 |
| [7] |
CHEY WD, KURLANDER J, ESWARAN S. Irritable bowel syndrome[J]. JAMA, 2015, 313(9): 949. DOI:10.1001/jama.2015.0954 |
| [8] |
LACH G, SCHELLEKENS H, DINAN TG, CRYAN JF. Anxiety, depression, and the microbiome: a role for gut peptides[J]. Neurotherapeutics, 2018, 15(1): 36-59. DOI:10.1007/s13311-017-0585-0 |
| [9] |
LI RD, CHEN SH, GU XP, AN SH, WANG ZJ. Role of the nuclear receptor subfamily 4a in mast cells in the development of irritable bowel syndrome[J]. Computational and Structural Biotechnology Journal, 2022, 20: 1198-1207. DOI:10.1016/j.csbj.2022.02.017 |
| [10] |
LIU YW, WANG YP, YEN HF, LIU PY, TZENG WJ, TSAI CF, LIN HC, LEE FY, JENG OJ, LU CL, TSAI YC. Lactobacillus plantarum PS128 ameliorated visceral hypersensitivity in rats through the gut-brain axis[J]. Probiotics and Antimicrobial Proteins, 2020, 12(3): 980-993. DOI:10.1007/s12602-019-09595-w |
| [11] |
WU HM, ZHAN K, RAO KH, ZHENG H, QIN SM, TANG XD, HUANG SG. Comparison of five diarrhea-predominant irritable bowel syndrome (IBS-D) rat models in the brain-gut-microbiota axis[J]. Biomedicine & Pharmacotherapy, 2022, 149: 112811. |
| [12] |
de PALMA G, SHIMBORI C, REED DE, YU Y, RABBIA V, LU J, JIMENEZ-VARGAS N, SESSENWEIN J, LOPEZ-LOPEZ C, PIGRAU M, JARAMILLO-POLANCO J, ZHANG Y, BAERG L, MANZAR A, PUJO J, BAI XP, PINTO-SANCHEZ MI, CAMINERO A, MADSEN K, SURETTE MG, et al. Histamine production by the gut microbiota induces visceral hyperalgesia through histamine 4 receptor signaling in mice[J]. Science Translational Medicine, 2022, 14(655): eabj1895. DOI:10.1126/scitranslmed.abj1895 |
| [13] |
GAO J, XIONG TT, GRABAUSKAS G, OWYANG C. Mucosal serotonin reuptake transporter expression in irritable bowel syndrome is modulated by gut microbiota via mast cell-prostaglandin E2[J]. Gastroenterology, 2022, 162(7): 1962-1974.e6. DOI:10.1053/j.gastro.2022.02.016 |
| [14] |
NG QX, SOH AYS, LOKE W, LIM DY, YEO WS. The role of inflammation in irritable bowel syndrome (IBS)[J]. Journal of Inflammation Research, 2018, 11: 345-349. DOI:10.2147/JIR.S174982 |
| [15] |
LI J, DING JP. Progress of applied magnetic resonance brain imaging in irritable bowel syndrome[J]. Magnetic Resonance Imaging, 2017, 8(12): 941-946. (in Chinese) 李洁, 丁建平. 肠易激综合征磁共振脑影像学应用研究进展[J]. 磁共振成像, 2017, 8(12): 941-946. |
| [16] |
ZHAO Q, YANG WR, WANG XH, LI GQ, XU LQ, CUI X, LIU Y, ZUO XL. Clostridium butyricumalleviates intestinal low-grade inflammation in TNBS-induced irritable bowel syndrome in mice by regulating functional status of Lamina propria dendritic cells[J]. World Journal of Gastroenterology, 2019, 25(36): 5469-5482. DOI:10.3748/wjg.v25.i36.5469 |
| [17] |
MISHIMA Y, ISHIHARA S. Enteric microbiota- mediated serotonergic signaling in pathogenesis of irritable bowel syndrome[J]. International Journal of Molecular Sciences, 2021, 22(19): 10235. DOI:10.3390/ijms221910235 |
| [18] |
HE L, YANG L, LING ZW, CHEN M. Effect of intestinal microbiota in regulating visceral hypersensitivity of IBS-D based on brain-gut interacting mechanism[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(11): 224-229. (in Chinese) 何力, 杨力, 凌志维, 陈敏. 基于脑肠交互机制探讨肠道微生物调节IBS-D内脏高敏的研究进展[J]. 中国实验方剂学杂志, 2019, 25(11): 224-229. DOI:10.13422/j.cnki.syfjx.20191129 |
| [19] |
MULLER PA, SCHNEEBERGER M, MATHEIS F, WANG P, KERNER Z, ILANGES A, PELLEGRINO K, del MÁRMOL J, CASTRO TBR, FURUICHI M, PERKINS M, HAN WF, RAO A, PICKARD AJ, CROSS JR, HONDA K, de ARAUJO I, MUCIDA D. Microbiota modulate sympathetic neurons via a gut-brain circuit[J]. Nature, 2020, 583(7816): 441-446. DOI:10.1038/s41586-020-2474-7 |
| [20] |
STEVENS BR, GOEL R, SEUNGBUM K, RICHARDS EM, HOLBERT RC, PEPINE CJ, RAIZADA MK. Increased human intestinal barrier permeability plasma biomarkers zonulin and FABP2 correlated with plasma LPS and altered gut microbiome in anxiety or depression[J]. Gut, 2018, 67(8): 1555-1557. |
| [21] |
SOCHOCKA M, DONSKOW-ŁYSONIEWSKA K, DINIZ BS, KURPAS D, BRZOZOWSKA E, LESZEK J. The gut microbiome alterations and inflammation-driven pathogenesis of Alzheimer's disease: a critical review[J]. Molecular Neurobiology, 2019, 56(3): 1841-1851. DOI:10.1007/s12035-018-1188-4 |
| [22] |
WU WL, ADAME MD, LIOU CW, BARLOW JT, LAI TT, SHARON G, SCHRETTER CE, NEEDHAM BD, WANG MI, TANG WY, OUSEY J, LIN YY, YAO TH, ABDEL-HAQ R, BEADLE K, GRADINARU V, ISMAGILOV RF, MAZMANIAN SK. Microbiota regulate social behaviour via stress response neurons in the brain[J]. Nature, 2021, 595(7867): 409-414. DOI:10.1038/s41586-021-03669-y |
| [23] |
OLSON CA, VUONG HE, YANO JM, LIANG QY, NUSBAUM DJ, HSIAO ELAINE Y. The gut microbiota mediates the anti-seizure effects of the ketogenic diet[J]. Cell, 2018, 173(7): 1728-1741.e13. DOI:10.1016/j.cell.2018.04.027 |
| [24] |
SHARON G, CRUZ NJ, KANG DW, GANDAL MJ, WANG B, KIM YM, ZINK EM, CASEY CP, TAYLOR BC, LANE CJ, BRAMER LM, ISERN NG, HOYT DW, NOECKER C, SWEREDOSKI MJ, MORADIAN A, BORENSTEIN E, JANSSON JK, KNIGHT R, METZ TO, et al. Human gut microbiota from autism spectrum disorder promote behavioral symptoms in mice[J]. Cell, 2019, 177(6): 1600-1618.e17. DOI:10.1016/j.cell.2019.05.004 |
| [25] |
XIONG LL, MAO ML, SHU QL. A preliminary study on the diversity of butyrate-producing bacteria in response to the treatment of depression with Xiaoyaosan[J]. Letters in Applied Microbiology, 2022, 75(4): 844-856. DOI:10.1111/lam.13737 |
| [26] |
ALTOMARE A, DI ROSA C, IMPERIA E, EMERENZIANI S, CICALA M, GUARINO MPL. Diarrhea predominant-irritable bowel syndrome (IBS-D): effects of different nutritional patterns on intestinal dysbiosis and symptoms[J]. Nutrients, 2021, 13(5): 1506. DOI:10.3390/nu13051506 |
| [27] |
QUIGLEY EMM. The gut-brain axis and the microbiome: clues to pathophysiology and opportunities for novel management strategies in irritable bowel syndrome (IBS)[J]. Journal of Clinical Medicine, 2018, 7(1): 6. DOI:10.3390/jcm7010006 |
| [28] |
SUN QH, JIA Q, SONG LJ, DUAN LP. Alterations in fecal short-chain fatty acids in patients with irritable bowel syndrome: a systematic review and meta-analysis[J]. Medicine, 2019, 98(7): e14513. DOI:10.1097/MD.0000000000014513 |
| [29] |
HANNING N, EDWINSON AL, CEULEERS H, PETERS SA, de MAN JG, HASSETT LC, de WINTER BY, GROVER M. Intestinal barrier dysfunction in irritable bowel syndrome: a systematic review[J]. Therapeutic Advances in Gastroenterology, 2021, 14: 1756284821993586. |
| [30] |
SCIAVILLA P, STRATI F, Di PAOLA M, MODESTO M, VITALI F, CAVALIERI D, PRATI GM, Di VITO M, ARAGONA G, de FILIPPO C, MATTARELLI P. Gut microbiota profiles and characterization of cultivable fungal isolates in IBS patients[J]. Applied Microbiology and Biotechnology, 2021, 105(8): 3277-3288. DOI:10.1007/s00253-021-11264-4 |
| [31] |
PETER J, FOURNIER C, DURDEVIC M, KNOBLICH L, KEIP B, DEJACO C, TRAUNER M, MOSER G. A microbial signature of psychological distress in irritable bowel syndrome[J]. Psychosomatic Medicine, 2018, 80(8): 698-709. DOI:10.1097/PSY.0000000000000630 |
| [32] |
CARBONE F, van den HOUTE K, BESARD L, TACK C, ARTS J, CAENEPEEL P, PIESSEVAUX H, VANDENBERGHE A, MATTHYS C, BIESIEKIERSKI J, CAPIAU L, CEULEMANS S, GERNAY O, JONES L, MAES S, PEETERMANS C, RAAT W, STUBBE J, van BOXSTAEL R, VANDEPUT O, et al. Diet or medication in primary care patients with IBS: the DOMINO study-a randomised trial supported by the Belgian Health Care Knowledge Centre (KCE Trials Programme) and the Rome Foundation Research Institute[J]. Gut, 2022, 71(11): 2226-2232. DOI:10.1136/gutjnl-2021-325821 |
| [33] |
NEE J, LEMBO A. Review article: current and future treatment approaches for IBS with diarrhoea (IBS-D) and IBS mixed pattern (IBS-M)[J]. Alimentary Pharmacology & Therapeutics, 2021, 54(Suppl 1): S63-S74. |
| [34] |
ASHA MZ, KHALIL SFH. Efficacy and safety of probiotics, prebiotics and synbiotics in the treatment of irritable bowel syndrome: a systematic review and meta-analysis[J]. Sultan Qaboos University Medical Journal, 2020, 20(1): e13-e24. DOI:10.18295/squmj.2020.20.01.003 |
| [35] |
GUO QQ, LIN H, CHEN PC, TAN SL, WEN ZY, LIN LJ, HE JQ, WEN JB, LU SY. Dynamic changes of intestinal flora in patients with irritable bowel syndrome combined with anxiety and depression after oral administration of enterobacteria capsules[J]. Bioengineered, 2021, 12(2): 11885-11897. DOI:10.1080/21655979.2021.1999374 |
| [36] |
MEYER C, VASSAR M. The fragility of probiotic Bifidobacterium longum NCC3001 use for depression in patients with irritable bowel syndrome[J]. Gastroenterology, 2018, 154(3): 764. |
| [37] |
PIMENTEL M. Evidence-based management of irritable bowel syndrome with diarrhea[J]. The American Journal of Managed Care, 2018, 24(3 Suppl): S35-S46. |
| [38] |
WANG X, BAI CY, WANG XY, HAN J. Based on the brain-gut axis theory, this paper discusses the diagnosis and treatment of gastrointestinal dysfunction by regulating the mind and regulating the stomach[J]. Lishizhen Medicine and Materia Medica Research, 2021, 32(6): 1415-1417. (in Chinese) 王雪, 白春瑶, 王晓燕, 韩晶. 基于脑肠轴理论探讨调神和胃法防治胃肠功能紊乱的诊疗思路[J]. 时珍国医国药, 2021, 32(6): 1415-1417. |
| [39] |
CHENG Q. Clinical observation on acupuncture based on brain-gut axis theory to improve mild and moderate depression with gastrointestinal symptoms[D]. Harbin: Master's Thesis of Heilongjiang University of Chinese Medicine, 2021 (in Chinese). 程倩. 基于脑肠轴理论针刺改善轻中度抑郁症伴胃肠道症状的临床观察[D]. 哈尔滨: 黑龙江中医药大学硕士学位论文, 2021. |
| [40] |
ZHANG SS, WANG SM, TANG YP, WANG XC, HAO HW. Based on network pharmacology and molecular docking, this paper discusses the molecular mechanism of Jianpi Zhizhi Decoction in treating Tourette's syndrome in children through brain-intestine axis[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2022, 31(5): 649-655, 667. (in Chinese) 张莎莎, 王素梅, 唐艳鹏, 王晓聪, 郝宏文. 基于网络药理学及分子对接探讨健脾止动汤通过脑肠轴治疗儿童多发性抽动症的分子机制[J]. 现代中西医结合杂志, 2022, 31(5): 649-655, 667. |
| [41] |
LIN L, FENG BC, ZHOU RC, LIU Y, LI LX, WANG KR, YU YB, LIU C, LONG X, GU X, LI B, WANG XJ, YANG XY, CONG YZ, ZUO XL, LI YQ. Acute stress disrupts intestinal homeostasis via GDNF-RET[J]. Cell Proliferation, 2020, 53(10): e12889. DOI:10.1111/cpr.12889 |
| [42] |
SIMPSON CA, MU A, HASLAM N, SCHWARTZ OS, SIMMONS JG. Feeling down? A systematic review of the gut microbiota in anxiety/depression and irritable bowel syndrome[J]. Journal of Affective Disorders, 2020, 266: 429-446. DOI:10.1016/j.jad.2020.01.124 |
| [43] |
XIN YY, WANG L, LI SB, ZHU CC, ZHUANG JB. Correlation between different types of irritable bowel syndrome and insomnia, anxiety and depression[J]. Gansu Medical Journal, 2017, 36(12): 1024-1025, 1031. (in Chinese) 辛英瑛, 王莉, 李胜兵, 朱琛琛, 庄剑波. 不同分型肠易激综合征与失眠、焦虑、抑郁的相关性[J]. 甘肃医药, 2017, 36(12): 1024-1025, 1031. DOI:10.15975/j.cnki.gsyy.2017.12.010 |
| [44] |
XIONG LL, WU YN, SHU QL, XIONG W. The pharmacological mechanism of Xiaoyaosan polysaccharide reveals improvement of CUMS-induced depression-like behavior by carbon source-triggered butyrate-producing bacteria[J]. Journal of Applied Microbiology, 2023, 134(4): lxad052. DOI:10.1093/jambio/lxad052 |
| [45] |
FORD AC, SPERBER AD, CORSETTI M, CAMILLERI M. Irritable bowel syndrome[J]. The Lancet, 2020, 396(10263): 1675-1688. DOI:10.1016/S0140-6736(20)31548-8 |
| [46] |
SHI YZ, TAO QF, QIN D, CHEN M, YU SG, ZHENG H. Acupuncture vs. antispasmodics in the treatment of irritable bowel syndrome: an adjusted indirect treatment comparison meta-analysis[J]. Frontiers in Physiology, 2022, 13: 1001978. DOI:10.3389/fphys.2022.1001978 |
| [47] |
BAO CH, WU LY, SHI Y, SHI Z, JIN XM, SHEN JC, LI J, HU ZH, CHEN JH, ZENG XQ, ZHANG W, MA Z, WENG ZJ, LI JM, LIU HR, WU HG. Long-term effect of moxibustion on irritable bowel syndrome with diarrhea: a randomized clinical trial[J]. Therapeutic Advances in Gastroenterology, 2022, 15: 175628482210751. DOI:10.1177/17562848221075131 |
| [48] |
ZHAO JM, CHEN L, ZHOU CL, SHI Y, LI YW, SHANG HX, WU LY, BAO CH, DOU CZ, WU HG. Comparison of electroacupuncture and moxibustion for relieving visceral hypersensitivity in rats with constipation-predominant irritable bowel syndrome[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2016, 2016: 9410505. |
| [49] |
ZHANG FM, ZHANG T, ZHU HM, BORODY TJ. Evolution of fecal microbiota transplantation in methodology and ethical issues[J]. Current Opinion in Pharmacology, 2019, 49: 11-16. DOI:10.1016/j.coph.2019.04.004 |
| [50] |
WEI X. Microecology[J]. Chinese Journal of Microecology, 1989, 1(1): 4-5. (in Chinese) 魏曦. 微生态学刍议[J]. 中国微生态学杂志, 1989, 1(1): 4-5. DOI:10.13381/j.cnki.cjm.1989.01.002 |
| [51] |
SHU QL, XU G, YE HP, ZHANG XL, FENG Y, WEI N. Influences of Shenglin Baizhu Powder on in vitro growth of Clostridium difficile[J]. China Industrial Economics, 2013, 19(2): 258-262. (in Chinese) 舒青龙, 徐刚, 叶荷平, 章喜林, 封勇, 魏娜. 参苓白术散对体外艰难梭菌生长的影响[J]. 中国实验方剂学杂志, 2013, 19(2): 258-262. |
| [52] |
SHU QL, WANG P, FENG Y, FENG J. Influence of Lizhong Tang intestinal flora changes in its treatment to AAD model[J]. China Industrial Economics, 2015, 21(21): 82-87. (in Chinese) 舒青龙, 王萍, 封勇, 冯洁. 理中汤对抗生素相关性腹泻模型构建中肠道菌群变化的影响[J]. 中国实验方剂学杂志, 2015, 21(21): 82-87. |
| [53] |
LI L, ZHANG HJ, QUE MQ, WANG P. Clinical observation of Lizhong Decoction combined with Zhizhu Decoction for treatment of constipation-predominant irritable bowel syndrome classified as Taiyin Yin-constipation in traditional Chinese medicine[J]. Journal of Guangzhou University of Traditional Chinese Medicine, 2019, 36(3): 332-336. (in Chinese) 李丽, 章浩军, 阙茂棋, 王苹. 理中汤合枳术汤治疗太阴阴结便秘型肠易激综合征临床观察[J]. 广州中医药大学学报, 2019, 36(3): 332-336. |
| [54] |
GU Y, QIU C, TANG FR, SHU QL. Study on the effects of in vitro mixed growth of Bacteroides and Firmicutes under polysaccharide in Shenlingbaizhu Powder as "carbon competition"[J]. Lishizhen Medicine and Materia Medica Research, 2019, 30(11): 2617-2620. (in Chinese) 辜沅, 邱超, 唐芳瑞, 舒青龙. 基于"碳源竞争"的参苓白术散多糖对拟杆菌和厚壁菌体外混合生长的影响[J]. 时珍国医国药, 2019, 30(11): 2617-2620. |
| [55] |
WU L, SHU QL, LIU YQ, TANG FR. Comparative study of Astragalus polysaccharides and honey-processed Astragalus polysaccharides on composition and diversity of gut microbiota in rats[J]. Pharmacology and Clinics of Chinese Materia Medica, 2021, 37(4): 40-47. (in Chinese) 吴莉, 舒青龙, 刘玉琼, 唐芳瑞. 黄芪多糖和炙黄芪多糖调节大鼠肠道菌群组成与多样性的比较研究[J]. 中药药理与临床, 2021, 37(4): 40-47. |
| [56] |
ZHANG LP, WU HJ, SHU QL. Study on the in vitro growths of two typical intestinal Bacteroides under influence of shenlingbaizhu powder polysaccharide as "carbon source"[J]. China Industrial Economics, 2018, 30(1): 73-78. (in Chinese) 张丽萍, 伍荷洁, 舒青龙. 基于"碳源"研究参苓白术散中药多糖对二株肠道拟杆菌体外生长的影响[J]. 天然产物研究与开发, 2018, 30(1): 73-78. |
| [57] |
LIN P, QIU C, SHU QL, FENG Y. Study on the microecological mechanism of polysaccharide degradation of Shenling Baizhu Powder in vitro based on butyric acid producing bacteria combination[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2023, 38(2): 620-625. (in Chinese) 林萍, 邱超, 舒青龙, 封勇. 基于产丁酸菌组合研究参苓白术散多糖体外降解的微生态机制[J]. 中华中医药杂志, 2023, 38(2): 620-625. |
| [58] |
YASUKAWA Z, INOUE R, OZEKI M, OKUBO T, TAKAGI T, HONDA A, NAITO Y. Effect of repeated consumption of partially hydrolyzed guar gum on fecal characteristics and gut microbiota: a randomized, double-blind, placebo-controlled, and parallel-group clinical trial[J]. Nutrients, 2019, 11(9): 2170. |
| [59] |
GIANNINI EG, MANSI C, DULBECCO P, SAVARINO V. Role of partially hydrolyzed guar gum in the treatment of irritable bowel syndrome[J]. Nutrition, 2006, 22(3): 334-342. |
| [60] |
EL-SALHY M, YSTAD SO, MAZZAWI T, GUNDERSEN D. Dietary fiber in irritable bowel syndrome (review)[J]. International Journal of Molecular Medicine, 2017, 40(3): 607-613. |
| [61] |
HUANG S, WANG S, LIN FX, LIU P, LIN CL, LEI LM, ZHAO HY, HUANG T. Exploration on anchang decoction for IBS-D rats pPKCγ, ERK1 pain genes in spinal cord dorsal horn by mediated central sensitization mechanism[J]. China Industrial Economics, 2019, 37(2): 270-273. (in Chinese) 黄适, 王松, 林福旭, 刘鹏, 林春李, 雷力民, 赵海燕, 黄婷. 介导疼痛中枢敏化探讨安肠汤对肝郁脾虚型IBS-D大鼠pPKCγ和ERK1在脊髓背角表达[J]. 中华中医药学刊, 2019, 37(2): 270-273. |
| [62] |
YIN S, SUN C, JI Y, ABDOLMALEKY H, ZHOU JR. Herbal medicine WangShiBaoChiWan improves gastrointestinal health in mice via modulation of intestinal tight junctions and gut microbiota and inhibition of inflammation[J]. Biomedicine and Pharmacotherapy, 2021, 138: 111426. |
| [63] |
ZHANG LY. Effect of Buzhong Yiqi Decoction combined with intestinal microecological regulator on IBS-C improvement and serum SP and SS levels of spleen and stomach weakness syndrome[J]. Journal of Medical Forum, 2020, 41(8): 172-174. (in Chinese) 张雷永. 补中益气汤联合肠道微生态调节剂对脾胃虚弱证IBS-C改善及血清SP、SS水平的影响[J]. 医药论坛杂志, 2020, 41(8): 172-174. |
| [64] |
XIE Y, ZHAN X, TU JY, XU K, SUN XJ, LIU CL, KE C, CAO GS, ZHOU ZS, LIU YJ. Atractylodes oil alleviates diarrhea-predominant irritable bowel syndrome by regulating intestinal inflammation and intestinal barrier via SCF/c-kit and MLCK/MLC2 pathways[J]. Journal of Ethnopharmacology, 2021, 272: 113925. |
| [65] |
LIU YY, MU FY, WANG YC, WANG MY, WANG CG, YAN XL. Metabolomics study of fecal UPLC-MS/MS in rats with diarrhea-type irritable bowel syndrome model treated with Spiderwort extract[J]. Chinese Journal of Traditional Chinese Medicine, 2021, 46(3): 678-684. (in Chinese) 刘窈玉, 穆芳园, 王一程, 王曼宇, 王春国, 闫兴丽. 蜘蛛香提取物治疗腹泻型肠易激综合征模型大鼠粪便UPLC-MS/MS代谢组学研究[J]. 中国中药杂志, 2021, 46(3): 678-684. |
| [66] |
ZHANG BH, WANG W, WANG FY, TANG XD. Effects of Tongxie Yaofang in treating IBS-D rats with syndrome of stagnation of liver qi and spleen deficiency[J]. China Industrial Economics, 2018, 33(10): 4341-4346. (in Chinese) 张北华, 王微, 王凤云, 唐旭东. 痛泻要方干预腹泻型肠易激综合征肝郁脾虚证模型大鼠的效应评价[J]. 中华中医药杂志, 2018, 33(10): 4341-4346. |
| [67] |
TAN HL, XU Y, XIAO L, JIANG SS. Clinical study on Qilian jiechangning decoction for treatment of diarrhea-predominant irritable bowel syndrome with spleen deficiency and damp heat syndrome[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2021, 28(2): 92-96. (in Chinese) 谭华梁, 徐寅, 肖麟, 蒋士生. 芪连结肠宁方治疗腹泻型肠易激综合征脾虚湿热证临床研究[J]. 中国中医药信息杂志, 2021, 28(2): 92-96. |
| [68] |
LAN Y, GAO YS, ZHU WL, REN XX, GUO MW, WANG S, WU YY, LI KG, TAN LH, JI MX. Comparison of the effects of electroacupuncture at "Hegu" and "Zusanli" points on colonic motility and colonic M3 receptor expression in rats with IBS model[J]. Journal of Beijing University of Chinese Medicine, 2017, 40(12): 1044-1049. (in Chinese) 蓝莹, 高誉珊, 朱文莲, 任晓暄, 郭孟玮, 王珊, 吴艳英, 李凯歌, 谭莉华, 吉毛先. 比较电针"合谷" "足三里"穴对IBS模型大鼠结肠动力及结肠M3受体表达的影响[J]. 北京中医药大学学报, 2017, 40(12): 1044-1049. |
| [69] |
ZHANG HF, XIE FS, GONG HB, HUANG H, CHEN ST, KANG MF, FU Y. Effects of heat-sensitive moxibustion on HPA axis in rats with irritable bowel syndrome[J]. Chinese Acupuncture & Moxibustion, 2017, 37(12): 1315-1321. (in Chinese) 章海凤, 谢芳深, 龚红斌, 黄辉, 陈树涛, 康明非, 付勇. 热敏灸对肠易激综合征模型大鼠HPA轴调节机制的研究[J]. 中国针灸, 2017, 37(12): 1315-1321. |
| [70] |
WANG YF, GUO MW, QIN Y, ZHU WL, LAN Y, WANG S, JI MX, ZHANG HL, REN XX. Effects of electroacupuncture at Yintang (EX-HN3) and Dachangshu (BL25) on colonic motility in irritable bowel syndrome rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2020, 35(7): 3379-3382. (in Chinese) 王一凡, 郭孟玮, 覃颖, 朱文莲, 蓝莹, 王珊, 吉毛先, 张红林, 任晓暄. 电针印堂与大肠俞穴对肠易激综合征模型大鼠结肠动力的影响[J]. 中华中医药杂志, 2020, 35(7): 3379-3382. |
| [71] |
CHU HR, WANG Y, TONG L, WU SB, WU LB, LI N, CHENG HL. Effect of moxibustion on TLR4/MyD88/NF-κB signaling pathway in colon of diarrhea-predo-minant irritable bowel syndrome rats[J]. Acupuncture Research, 2020, 45(8): 633-639. |
| [72] |
WANG SS, WANG XR, YANG RY, XU Y, LI MY. Efficacy and mechanism of acupuncture combined with Tongxieyaofang for diarrhea-type irritable bowel syndrome of liver depression and spleen deficiency[J]. Chinese Acupuncture & Moxibustion, 2020, 40(6): 605-609. |
| [73] |
de OLIVEIRA FL, SALGAÇO MK, de OLIVEIRA MT, MESA V, SARTORATTO A, PEREGRINO AM, RAMOS WS, SIVIERI K. Exploring the potential of Lactobacillus helveticus R0052 and Bifidobacterium longum R0175 as promising psychobiotics using SHIME[J]. Nutrients, 2023, 15(6): 1521. |
| [74] |
CAMILLERI M. Diagnosis and treatment of irritable bowel syndrome[J]. JAMA, 2021, 325(9): 865. |
| [75] |
QI LY, YANG JW, YAN SY, TU JF, SHE YF, LI Y, CHI LL, WU BQ, LIU CZ. Acupuncture for the treatment of diarrhea-predominant irritable bowel syndrome: a pilot randomized clinical trial[J]. JAMA Network Open, 2022, 5(12): e2248817. |
 2023, Vol. 50
2023, Vol. 50