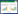扩展功能
文章信息
- 骆庆, 郭涛, 孙召新, 余大龙, 余知和
- LUO Qing, GUO Tao, SUN Zhaoxin, YU Dalong, YU Zhihe
- 大球盖菇的生物学基础、活性成分及其应用
- Biological basis and bioactive components of Stropharia rugosoannulata and its application
- 微生物学通报, 2023, 50(6): 2709-2720
- Microbiology China, 2023, 50(6): 2709-2720
- DOI: 10.13344/j.microbiol.china.220790
-
文章历史
- 收稿日期: 2022-08-21
- 接受日期: 2022-10-10
- 网络首发日期: 2022-11-15
2. 湖北省荆州市江陵县农业农村局,湖北 荆州 434101
2. Hubei Jingzhou Jiangling County Agricultural and Rural Bureau, Jingzhou 434101, Hubei, China
大球盖菇(Stropharia rugosoannulata)隶属担子菌门(Basidomycota)伞菌纲(Agaricomycetes)伞菌目(Agaricales)球盖菇科(Strophariaceae)[1],别名皱环球盖菇、酒红色大球盖菇、皱球盖菇等,商品名为“赤松茸”。美国植物学家Willian G. Farlow和Willian A. Murrill于1922年首次在草坪中发现并命名[2];德国于1969年首次对野生大球盖菇进行人工驯化,随后在波兰、捷克斯洛伐克、匈牙利、荷兰等地相继引种栽培[3]。尽管我国云南、四川、西藏和吉林有野生大球盖菇的分布[4],但人工种植起步较晚,直至1992年福建三明真菌研究所从国外引进菌种,在桔园、田间试栽并获得成功。近年来,随着农村脱贫和乡村振兴工作的实施,大球盖菇在国内的栽培规模逐年递增。目前,在福建、江西、四川、黑龙江、湖北、贵州、陕西、河北、河南、安徽、山西等省已大面积推广栽培,据不完全统计,2019年全国大球盖菇种植面积近1 500 hm2,相比2017年增长了一倍[5]。大球盖菇是联合国粮农组织推荐在发展中国家进行栽培的食用菌之一,也是国际食用菌市场上交易的主要食用菌之一。国内外对大球盖菇生物学、子实体产品营养与生物活性物质(包括菌丝体)开展了大量的研究[6-7]。我们结合湖北省现代农业产业技术体系项目要求及全国农业产业发展的需要,致力于江汉平原水稻产区大球盖菇的品种选育及“稻+菇”生态种植模式优化研究,探索大球盖菇在农林循环经济中的作用。因此,本文从大球盖菇形态学、基因组等生物学基础、子实体营养与多糖、凝集素、肽类及甾体化合物等生物活性成分及其对农林废弃物资源化利用、土壤改良、生物防治和环境修复等进行综述,以期为大球盖菇的进一步开发利用及其相关产业发展提供支撑和参考。
1 生物学基础 1.1 菌丝体大球盖菇双核菌丝在马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基上呈白色,菌落形状多样,呈放射状、绒状、毡状、絮状等,具锁状联合(图 1A),直径3−5 μm;而单核菌丝生长速度慢,菌丝较细,但在利用原生质体再生时,出现早、生长快的再生菌落中高达75.4%为单核体(图 1B)[8]。

|
| 图 1 大球盖菇菌丝体培养物的微观形态 Figure 1 Microscopic morphology of mycelia of Stropharia rugosoannulata. A:具锁状联合的双核菌丝. B:单核菌丝. C、D:棘细胞. E:分生孢子. F:膨大菌丝 A: Dikaryotic hyphae with clamp connection. B: Monokaryotic hyphae. C and D: Acanthocytes. E: Conidiums. F: Dilated hyphae. |
|
|
无论单核还是双核菌丝,培养约24 h都会产生大量的棘细胞(图 1C、1D)[9]。冷冻扫描电子显微镜观察发现,棘细胞生长发育过程主要包含侧枝形成、刺状结构形成和棘细胞成熟3个不同的阶段,即起初形成1个垂直于菌丝体的棒状短侧枝,而后产生多个突起,一些不规则的结晶沉积物附着在短枝上,不断向外延伸,随着棘细胞的成熟,产生5−12个长短不一向各个方向延伸的侧枝,长度可达90 μm,表面光滑,侧枝尖端逐渐尖锐,一侧出现孔洞,内部中空[10],这一特有结构不仅保护自身子实体免受线虫的啃食与破坏,而且通过攻击线虫获取生长所需营养,也能够预防植食类线虫对植物根部的侵害[11]。与金针菇产生粉孢子类似[12],大球盖菇菌丝培养后期,菌丝体断裂形成矩形、含1–2个小液滴的分生孢子(图 1E),甚至有些菌丝体细胞质收缩,产生膨大菌丝(图 1F)[13]。
1.2 子实体大球盖菇菌丝体在培养基质中生长一段时间后,在外界条件适宜时,菌丝扭结膨大,形成表面具白色绒毛、质地坚硬的球形原基(图 2A)[14];子实体单生或丛生,幼嫩时菌盖呈乳头状凸起,白色,具绒毛(图 2B),成熟后平展,呈红褐色、葡萄酒红褐色(图 2C),老熟后褐色或灰褐色,表面平滑,直径7−45 cm (图 2D);菌肉肥厚,色白;菌褶直生,初白色,成熟后暗紫色;菌柄直立,光滑,早期有髓,成熟后中空,近基部稍膨大;菌环膜质,幼嫩时与菌盖相连,成熟后脱落成若干片段;孢子印紫褐色,孢子椭圆形,(10−12) μm×(6−8) μm,顶端有明显的芽孔,在KOH溶液中呈浅暗黄褐色至浅褐色[2, 15]。

|
| 图 2 大球盖菇的子实体形态 Figure 2 Fruiting body morphology of Stropharia rugosoannulata. A:原基. B:幼嫩子实体. C:成熟子实体. D:老熟子实体 A: Primordium. B: Young fruiting body. C: Mature fruiting body. D: Old fruiting body. |
|
|
大球盖菇属草腐真菌,分解木质纤维素能力较强,稻草、麦秸、木屑、麦麸、米糠等农林废弃物资源可满足大球盖菇生长所需的碳素和氮素,但过高的氮素对其生长不利。用纯木屑培养大球盖菇时,几乎无原基分化,添加稻草或含纤维素的作物秸秆的木屑培养基质有利于子实体生长[16]。
菌丝生长温度为5−36 ℃,子实体形成温度为4−30 ℃;基质最适含水量为65%左右;大球盖菇是一种好气性真菌,菌丝生长阶段对通气状况不敏感,子实体生长发育阶段要求空气中二氧化碳浓度低于0.15%;菌丝生长不需要光,但散射光对子实体形成有促进作用[3]。
1.4 遗传交配型大球盖菇属四极性异宗结合真菌,由担孢子萌发产生的芽管形成单核菌丝,亲和的单核菌丝通过质配形成双核菌丝,非亲本交配型单核菌株间的遗传多样性远高于亲本交配型[17]。其交配型受A、B两个不连锁的交配位点控制,A交配位点包含一对保守的HD1和HD2基因,MIP、Sec61蛋白、甘氨酸脱氢酶(GLYDH)和β侧翼蛋白(β-fg)等保守基因位于上、下游基因且共线性较高;而B交配型位点上、下游基因的共线性较差,位点不连锁,包含5个信息素受体基因和3个信息素前体基因[18]。
1.5 基因组随着测序技术的发展与成熟,真菌基因组学研究取得了重大突破,而且为其重要基因功能、系统发生及物种进化等研究提供依据[19]。大球盖菇单核菌株测序结果表明,其基因组大小为47.9−49.4 Mb,GC含量为47.4%−47.9%[18, 20]。编码碳水化合物酶(carbohydrate active enzyme, CAZyme)的基因超过400个,外切葡萄糖酶、内切-1, 4-木聚糖酶、乙酰木聚糖酯酶等大多数CAZyme基因在菌丝阶段高表达,甲壳素合成酶和1, 3-β-葡聚糖合成酶等部分CAZyme在原基期和子实体期有较高的表达水平,在降解基质的同时参与细胞壁合成及子实体营养物质的运输[12, 16, 21]。
大球盖菇编码过氧化物酶基因数(61种)高于平菇(Pleurotus ostreatus)、云芝(Trametes versicolor)、裂褶菌(Schizophyllum commune)等常见白腐真菌,其中,编码血红素过氧化物酶基因50个、非血红素过氧化物酶基因10个及编码烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶调控子1个[16]。这些基因的存在为大球盖菇修复被多环芳烃、2, 4, 6-三硝基甲苯等有毒物质污染的土壤奠定基础[22]。
基于植物细胞壁降解酶的线性分析,进一步发现大球盖菇木质素与异源基因的比例高于褐腐菌和白腐菌,产生的胞外过氧化物酶中锰过氧化物酶是降解木质素的主要酶,缺乏木质素分解潜力强的多功能过氧化物酶和木质素过氧化物酶[16],结果为大球盖菇的栽培基质选择及配比提供了理论依据。
此外,大球盖菇基因组还含有多种次生代谢物基因簇,包括1个非核糖体肽合成酶、2个铁载体和3个吲哚簇等,对大球盖菇的生长和成熟至关重要[16]。球盖菇属除大球盖菇外,其他成员或多或少地含有裸盖菇素等毒性成分,而大球盖菇编码裸盖菇素的3个关键酶在不同的基因簇,不能合成裸盖菇素[16]。蛋白质组学研究表明,与碳代谢、能量产生和胁迫反应等生物过程相关的蛋白质表达量在菌柄处较高,而与脂肪酸合成和mRNA剪接相关的蛋白质表达量在菌盖中较高[20]。
大球盖菇在菌丝、原基及子实体3个阶段的差异表达基因有9 600多个,大多数转录因子在菌丝阶段表达水平较低,原基期水平较高,在子实体阶段显著上调,影响子实体形成、发育和有性繁殖;另外,热休克蛋白基因在原基阶段明显下调,子实体阶段上调[14],主要参与跨膜运输、氧化还原、细胞壁合成等生物学过程[23]。
不同菌株对温度的敏感性存在差异,在38 ℃条件下,耐热菌株和热敏菌株的菌丝体中热休克蛋白家族基因表达水平显著上调,差异基因主要集中在甘油磷脂代谢、蔗糖代谢及内质网蛋白质加工等途径,而且耐热菌株变异幅度高于热敏菌株,在耐热菌株中海藻糖含量增加,减少细胞的氧化损伤[24]。在10 ℃条件下,高敏菌株和低敏菌株的过氧化氢酶(CAT1、CAT2、GR和POD)基因及热休克蛋白基因上调,碳水化合物酶基因下调,减少了纤维素酶的分泌,从而降低糖代谢过程和菌丝生长,而且高敏菌株中的基因表达差异更为明显[21]。
1.6 线粒体基因组线粒体基因组因携带独立于核基因组之外的遗传信息,在真菌分子进化和系统发育过程中具有独特性和专一性。Suzuki等[25]首次报道了大球盖菇线粒体基因组是1个长达60 551 bp的环状DNA,包含57个基因,共编码14个保守蛋白、2个核糖体RNA (RNL和RNS)、29个tRNA (所有20个标准氨基酸)及12个其他开放阅读框。根据线粒体基因组的系统发育分析,大球盖菇与灰盖拟鬼伞(Coprinopsis cinerea)的亲缘关系近[25],而基因组分析表明,大球盖菇与砖红韧伞(Hypholoma sublateritium)、光盖裸盖菇(Psilocybe cyanescens)和纹缘盔孢伞(Galerina marginata)有着密切的进化关系[20]。
2 子实体营养大球盖菇子实体营养丰富、味道鲜美,每100 g干品中,灰分6.04 g、粗蛋白25.89 g、粗脂肪3.72 g、总碳水化合物64.35 g、总酚52.50 mg、黄酮类化合物1.69 mg、抗坏血酸0.83 mg,钾1 632 mg、磷729 mg、钙137 mg,脂肪酸中13.6%为饱和脂肪酸(如棕榈酸等),86.4%为不饱和脂肪酸(如油酸、亚油酸等)[26],是一种典型的高蛋白、低脂肪且具有丰富碳水化合物的优质食用菌。
成熟子实体除包含缬氨酸、赖氨酸、异亮氨酸等8种必需氨基酸外,还包含胱氨酸、天冬氨酸、谷氨酸等10种非必需氨基酸[27];另外,粗蛋白、糖类、粗纤维、粗脂肪等含量在子实体的形成过程中呈现有规律的波动,如菌环未离开菌盖时5′-核苷酸含量最高,菌环展开与菌柄脱离时总游离氨基酸、鲜味氨基酸和甜味氨基酸含量最高[28]。子实体烘干后有浓郁的香气,主要由游离氨基酸、5′-核苷酸、醇类和酯类等共同作用产生[29]。
3 生物活性成分 3.1 多糖大球盖菇多糖为淡棕色粉末,以吡喃糖为主,同时存在α糖苷键和β糖苷键,包括d-果糖、d-葡萄糖和d-木糖等5种单糖[30],对羟自由基的清除率达50%,具有免疫调节、抗肿瘤、抗癌和抗氧化等多种药理活性,对高血糖、冠心病、实体瘤S-180、腹水癌等有预防作用[31-32]。
大球盖菇菌丝液体深层发酵产生的胞外多糖与胞内多糖有相同的生理和药理功能[33],体外试验结果表明,胞外多糖具有较强的抗氧化、抗肿瘤、降血脂和降血糖作用且与其浓度呈正相关[34-35]。利用大球盖菇子实体粉末制备的乙酰化多糖能抑制脂肪合成,缓解非酒精性脂肪肝,具有保肝作用[36]。
3.2 凝集素Zhang等[37]从大球盖菇子实体中首次分离出一种分子量为38 kDa且具有独特N端序列(IKSGVYRIVSWQGALGPEAR)的凝集素糖蛋白。该凝集素由2个亚单位组成,其中N端序列与金针菇、双孢菇、侧耳等其他食用真菌中凝集素N端序列无相似性,热稳定性高,在0.05 mol/L NaOH溶液和0.1 mol/L HCl溶液中也保持稳定,不仅对肝癌Hep G2细胞和白血病L1210细胞的增殖具抑制活性,还能抑制HIV-1逆转录酶活性[37]。
3.3 肽类上海市农业科学院食用菌研究所杨焱研究员团队围绕大球盖菇的风味肽高效制备技术、呈味特性及构效关系及风味感知机理开展了系列研究,发现成熟的子实体中游离肽含量可达干重的11%−14%,显著高于游离氨基酸和核苷酸等小分子呈味物质,其中超过50%的肽具咸味和鲜味特征,Glu148、Glu301、Glu48和Ala46是呈味肽与T1R1/T1R3受体结合的关键活性氨基酸位点,为菌物源风味肽产品开发利用提供了参考[38-40]。
3.4 甾体化合物日本静冈大学Kawagishi教授团队采用乙醇、丙酮从大球盖菇新鲜子实体中分离出具独特碳骨架的甾醇类化合物9种、具类固醇骨架的甾醇strophasterols A、B、C、D和2种有独特醚环结构的甾醇,其中化合物1–5、8和9能够抑制破骨细胞的形成,化合物2和5能够抑制真菌活性,化合物2–6和strophasterols A通过减轻由ATP酶抑制剂引起的内质网应激来保护神经细胞,防止阿尔茨海默病等退行性疾病的发生,化合物3对人体肿瘤细胞Hela具细胞毒性[41-44]。此外,从子实体中还分离出4种能够调节植物生长的甾体化合物,其中,低浓度的化合物3和4能抑制生菜下胚轴生长,促进根生长,这与其甾醇骨架中的C-8和C-9或C-8和C-14之间的双键结构有关[45]。
我国广西中医药大学戴航等从大球盖菇子实体分离鉴定出类固醇(1–6)、甾体皂苷(7)、脂肪酸(8–10)、烷烃类(11)、神经酰胺(12)、酯(13)、嘧啶(14)、维生素(15)和类黄酮类(16)等16种化合物,其中β-谷甾醇、亚油酸、烟酸、尿嘧啶等普遍存在于鸡腿菇、猴头菇、灵芝等真菌,神经酰胺在球盖菇属中罕见,因此,神经酰胺(12)或可作为球盖菇属的化学分类标记[46]。
3.5 其他活性物质大球盖菇酚类物质对·OH和·O2–自由基的清除能力比维生素C强,有一定的抗油脂氧化活性[47]。抑菌试验表明,40、20和10 g/L的大球盖菇黄酮类化合物溶液对大肠杆菌有明显的抑制作用,40 g/L的大球盖菇黄酮类化合物溶液对青霉菌有抑制作用,但均对啤酒酵母无抑制作用[48]。此外,粉碎的子实体经氯仿浸提物具有抗疲劳作用[49]。
4 农林生态及环境修复应用 4.1 农林废弃物资源化利用我国有大量的农林废弃物资源,随着生态文明建设的推进,国家十分重视秸秆焚烧对环境的危害和资源浪费问题。利用水稻、玉米、小麦等作物秸秆及树木枝条等农林废弃物作为培养基质,在林地、温室及露天栽培大球盖菇符合国家产业政策。
大球盖菇菌丝体可通过分泌半纤维素酶、纤维素酶及漆酶等降解纤维素及木质素并转化为营养丰富的健康子实体产品。据测算,种植1 hm2的大球盖菇可利用约120−150 t秸秆,产出6.0−7.5 t的大球盖菇子实体[50],废弃的菌渣可作有机肥或者饲料,经济及生态效益显著。
4.2 土壤改良大球盖菇不仅有效转化秸秆和落叶等农林废弃物资源,而且菌渣内含有的菌体蛋白和营养物质为土壤微生物生长提供丰富的碳源、氮源,在土壤生态循环中占有重要的地位。
据上海农业科学院食用菌研究所监测显示,大球盖菇菌渣就地还田后土壤有机质含量显著增加,土壤蔗糖酶、多酚氧化酶、过氧化氢酶和脲酶活力分别提高113.3%、11.1%、4.2%和31.9%,其中具生物修复、分解土壤深层顽固性碳和固氮等功能的Anaerolineaceae、Bryobacter、Pseudarthrobacter等细菌相对丰度增加[51]。林下种植的大球盖菇菌渣就地还林后,0−20 cm深的土壤蔗糖酶活性、有机质、速效钾、全磷、等较未施加菌渣的土壤有不同程度的增加,而且随着时间延长,上述指标含量增加更显著[52]。另外,不同的大球盖菇林下种植模式(当年种植、种植后休耕1年、连续两年种植及间隔1年种植)均能增加土壤有机质、氮、磷、钾等含量,其中隔年种植大球盖菇的土壤养分浓度最高,土壤中氨化细菌、亚硝酸细菌、好氧自生固氮菌、好氧纤维素分解菌、无机磷细菌和硫化细菌数量较对照分别增加127.9%、82.0%、48.3%、150.8%、177.8%和117.3%;好氧菌和兼性厌氧菌为优势菌群,数量是其他种植模式的2倍[53]。
4.3 生物防治研究发现,捕食线虫真菌如亚侧耳属(Hohenbuehelia)、节丛孢属(Arthrobotrys)及亚隔指孢属(Dactylella)等成员的菌丝特化形成粘性菌网或球、收缩环等捕食器官[54],而大球盖菇菌丝特化形成的棘细胞能在2 h内固定自由生活线虫(Panagrelus redivivus)和松材线虫(Bursaphelenchus xylophilus)[11],4 h固定根结线虫(Meloidogyne hapla),固定线虫效果高于少孢节丛孢菌(Arthrobotry oligospora)[55-56]。添加l-色氨酸和l-苯丙氨酸等特定氨基酸培养,大球盖菇菌丝体分泌更多的吲哚、1-辛烯-3-醇和苯丙醛等引诱剂吸引植物寄生线虫,线虫致死率提高6倍以上[57]。而且,在种植过大球盖菇的土壤种植蔬菜时线虫对蔬菜根部的危害明显减少[58]。因此,在农田或林地种植大球盖菇可有效地预防根结线虫对其他作物的根部损害,减少农药的使用,有利于人类及环境的健康。
4.4 环境修复大球盖菇对环境的治理与修复具有应用潜力。芬兰赫尔辛基大学Hatakka教授团队筛选出9种对长期被多氯酚(五氯苯酚、四氯苯酚等)、多氯代二噁英等木材防腐剂污染的土壤有修复作用的真菌,其中大球盖菇菌丝体对五氯苯酚和2, 3, 4, 6-四氯苯酚的降解率分别为73%和43%,3个月内可降解约65%的多氯代二噁英及同系物,毒性当量下降64%[59-60]。俄罗斯植物与微生物环境研究所生物技术实验室的研究发现,大球盖菇产生木质素分解酶的同时产生胞外多糖和乳化化合物,与漆酶相互作用,增加漆酶对天然芳香族化合物(藜芦醇)和环境污染物(壬基酚、双酚A、菲)的催化氧化作用[61]。同样地,在生产2, 4, 6-三硝基甲苯(2, 4, 6-trinitrotoluene, TNT)工厂周边土壤添加长满大球盖菇菌丝的稻草秸秆,108 d后60%−85%的TNT被降解,其中2%的N被转化为NO3−和NH4+,1.4%的N被转化为N2O和N2,17.5%的N被微生物吸收合成氨基酸,C几乎不被矿化[62]。
除可降解土壤中的有害物质,大球盖菇对污水净化也有一定作用,能高效地将碱性蓝22和酸性红183等工业染料脱色[63],对抗癫痫药物卡马西平的生物降解率大于70%,对环磷酰胺和异环磷酰胺等药物去除率超过20%[64]。此外,大球盖菇分泌的一些胞外酶还能够降低水体中大肠杆菌浓度[65]。
5 展望我国是农业大国,农林业废弃物资源十分丰富,森林覆盖率逐年增加。大球盖菇作为联合国粮农组织向发展中国家推荐栽培的一种食用菌,具有栽培环境要求低、栽培技术简单、产量高等优势,在我国各地可依据地理及气候条件直接利用稻草、麦草、木屑等农林废弃物为原料进行大棚、露地闲田或林下生料栽培,产出富有营养的子实体产品,既给农业、农民带来可观的经济收益,同时还解决了农林业废弃物资源利用困难和水稻、玉米等作物焚烧带来的大气污染问题。因此,大球盖菇近年来已发展成为一种助推乡村振兴和农村产业扶贫的新兴食用菌种类,从而被广泛试种或栽培。
大球盖菇不仅子实体富含膳食纤维、维生素等营养物质,而且子实体或菌丝发酵物富含多糖、甾醇、多肽等活性成分,具有抗氧化、降血糖血脂、抑菌和抗肿瘤等功效,随着食用菌产品深加工技术的不断改进,开发大球盖菇药食同源的保健食品、功能食品或药品产业链前景广阔。
大球盖菇具有非特异性木质素、纤维素降解酶系统,利用大球盖菇降解农林业废弃物产生的菌渣可作为有机肥增加土壤有机质,参与土壤物质循环和污染物降解,改良因长期大量施用农药、化肥及其他化工产品导致的土壤肥力衰退及污染问题,与种植业、养殖业形成高效、可持续发展的循环经济,实现用地与养地相结合。随着大球盖菇全基因组序列的完成,从组学水平挖掘大球盖菇菌丝降解木质素及芳香族化合物等功能基因,探索大球盖菇的生态修复功能及市场发展空间,为进一步发挥大球盖菇在农林业可持续发展及生态修复中的作用提供科学依据。
| [1] |
BIAN YB. Edible Mushroom Cultivation[M]. 3rd ed. Beijing: Higher Education Press, 2017: 10-35. (in Chinese) 边银丙. 食用菌栽培学[M]. 3版. 北京: 高等教育出版社, 2017: 10-35. |
| [2] |
MURRILL WA. Dark-spored agarics—Ⅱ Gomphidius and Stropharia[J]. Mycologia, 1922, 14(3): 121-142. DOI:10.1080/00275514.1922.12020379 |
| [3] |
HUANG NL, LIN ZB, CHEN GL. Medicinal and Edible Fungi[M]. Shanghai: Shanghai Scientific and Technological Literature Publishing House, 2010: 632-658. (in Chinese) 黄年来, 林志彬, 陈国良. 中国食药用菌学[M]. 上海: 上海科学技术文献出版社, 2010: 632-658. |
| [4] |
MAO XL. Distribution and resource evaluation of macrofungi in China[J]. Natural Resources, 1988, 10(2): 79-84. (in Chinese) 卯晓岚. 我国大型经济真菌的分布及资源评价[J]. 自然资源, 1988, 10(2): 79-84. |
| [5] |
GAO X. Existing problems and countermeasures of Stropharia rugosoannulata industrial development in mountainous area of East Liaoning[J]. Liaoning Forestry Science and Technology, 2020(5): 68-69, 72. (in Chinese) 高旭. 辽东山区赤松茸产业发展存在问题及对策[J]. 辽宁林业科技, 2020(5): 68-69, 72. DOI:10.3969/j.issn.1001-1714.2020.05.020 |
| [6] |
LIU J, MIN DQ, TANG KL, XU P, DENG P, TANG CL. Research status and development prospect of Stropharia rugosoannulate[J]. Hunan Agricultural Sciences, 2021(6): 113-117. (in Chinese) 刘娟, 闵冬青, 唐可兰, 许佩, 邓朴, 唐昌林. 大球盖菇的研究现状及发展前景[J]. 湖南农业科学, 2021(6): 113-117. |
| [7] |
HUANG MX, CEN YX, SUN P, SU XW, PING JY, YANG CC, WEI JY, DAI H. Research progress of Stropharia rugosoannulata[J]. Heilongjiang Agricultural Sciences, 2021(12): 124-129. (in Chinese) 黄美仙, 岑燕霞, 孙朋, 粟晓微, 平静云, 杨楚楚, 韦杰玉, 戴航. 大球盖菇研究进展[J]. 黑龙江农业科学, 2021(12): 124-129. |
| [8] |
YAN PS, LI GF, JIANG JH, HUANG J. Regeneration and monokaryotation of protoplasts of Stropharia rugoso-annulata[J]. Mycosystema, 2001, 20(1): 107-110. (in Chinese) 闫培生, 李桂舫, 蒋家惠, 黄健. 大球盖菇原生质体再生及单核化特性的研究[J]. 菌物系统, 2001, 20(1): 107-110. DOI:10.3969/j.issn.1672-6472.2001.01.019 |
| [9] |
FARR DF. The acanthocyte, a unique cell type in Stropharia (Agaricales)[J]. Mycotaxon, 1980, 11(1): 241-249. |
| [10] |
YANG Y, LI CL, NI SJ, ZHANG HF, DONG CH. Ultrastructure and development of acanthocytes, specialized cells in Stropharia rugosoannulata, revealed by scanning electron microscopy (SEM) and cryo-SEM[J]. Mycologia, 2021, 113(1): 65-77. DOI:10.1080/00275514.2020.1823184 |
| [11] |
LUO H, LI X, LI GH, PAN YB, ZHANG KQ. Acanthocytes of Stropharia rugosoannulata function as a nematode-attacking device[J]. Applied and Environmental Microbiology, 2006, 72(4): 2982-2987. DOI:10.1128/AEM.72.4.2982-2987.2006 |
| [12] |
YU ZH, ZHU LB, YANG XM. Occurrence and nuclear behavior of oidida in Flammulina velutipes[J]. Journal of Huazhong Agricultural University, 1993, 12(6): 603-605, 633. (in Chinese) 余知和, 朱兰宝, 杨新美. 金针菇粉孢子的产生及核相观察[J]. 华中农业大学学报, 1993, 12(6): 603-605, 633. |
| [13] |
WALTHER G, WEIß M. Anamorphs in the Strophariaceae (Basidiomycota, Agaricales)[J]. Botany, 2008, 86(6): 551-566. DOI:10.1139/B08-036 |
| [14] |
HAO HB, ZHANG JJ, WANG Q, HUANG JC, JUAN JX, KUAI BK, FENG ZY, CHEN H. Transcriptome and differentially expressed gene profiles in mycelium, primordium and fruiting body development in Stropharia rugosoannulata[J]. Genes, 2022, 13(6): 1080. DOI:10.3390/genes13061080 |
| [15] |
BAU T, MENG TX. Strophariaceae of China (Ⅱ) Stropharia[J]. Journal of Fungal Research, 2008, 6(1): 7-34. (in Chinese) 图力古尔, 孟天晓. 中国的球盖菇科(二)球盖菇属[J]. 菌物研究, 2008, 6(1): 7-34. DOI:10.3969/j.issn.1672-3538.2008.01.003 |
| [16] |
YANG Y, MENG GL, NI SJ, ZHANG HF, DONG CH. Genomic analysis of Stropharia rugosoannulata reveals its nutritional strategy and application potential in bioremediation[J]. Journal of Fungi, 2022, 8(2): 162. DOI:10.3390/jof8020162 |
| [17] |
YAN PS, JIANG JH, LI GF, DENG CL. Mating system and DNA polymorphism of monokaryons with different mating type of Stropharia rugoso-annulata[J]. World Journal of Microbiology and Biotechnology, 2003, 19(7): 737-740. DOI:10.1023/A:1025151606096 |
| [18] |
SHANG JJ, HOU D, LI Y, ZHOU CL, GUO T, TANG LH, MAO WJ, CHEN Q, BAO DP, YANG RH. Analyses of mating systems in Stropharia rugosoannulata based on genomic data[J]. Mycosystema, 2020, 39(6): 1152-1161. (in Chinese) 尚俊军, 侯娣, 李燕, 周陈力, 郭婷, 唐利华, 茅文俊, 陈群, 鲍大鹏, 杨瑞恒. 基于基因组数据解析大球盖菇交配型系统[J]. 菌物学报, 2020, 39(6): 1152-1161. |
| [19] |
LI LC, QU JB, ZENG ZQ, HSIANG T, YU ZH. Methods and practice for fungal genome de novo sequencing and assembly[J]. Genomics and Applied Biology, 2020, 39(1): 173-180. (in Chinese) 李丽翠, 曲积彬, 曾昭清, HSIANG T, 余知和. 真菌基因组de novo测序组装的方法与实践[J]. 基因组学与应用生物学, 2020, 39(1): 173-180. |
| [20] |
LI SW, ZHAO SX, HU CH, MAO CZ, GUO LZ, YU HL, YU H. Whole genome sequence of an edible mushroom Stropharia rugosoannulata (Daqiugaigu)[J]. Journal of Fungi, 2022, 8(2): 99. DOI:10.3390/jof8020099 |
| [21] |
HAO HB, ZHANG JJ, WU SD, BAI J, ZHUO XY, ZHANG JX, KUAI BK, CHEN H. Transcriptomic analysis of Stropharia rugosoannulata reveals carbohydrate metabolism and cold resistance mechanisms under low-temperature stress[J]. AMB Express, 2022, 12(1): 56. DOI:10.1186/s13568-022-01400-2 |
| [22] |
STEFFEN KT, HATAKKA A, HOFRICHTER M. Removal and mineralization of polycyclic aromatic hydrocarbons by litter-decomposing basidiomycetous fungi[J]. Applied Microbiology and Biotechnology, 2002, 60(1): 212-217. |
| [23] |
WANG C, ZHANG XJ, ZENG ZH, SONG FF, LIN Z, CHEN LJ, CAI ZX. Transcriptome analysis explored the differential genes' expression during the development of the Stropharia rugosoannulata fruiting body[J]. Frontiers in Genetics, 2022, 13: 924050. DOI:10.3389/fgene.2022.924050 |
| [24] |
REN JF, WANG QJ, ZUO J, JIANG SX. Study of thermotolerant mechanism of Stropharia rugosoannulata under high temperature stress based on the transcriptome sequencing[J]. Mycoscience, 2021, 62(2): 95-105. DOI:10.47371/mycosci.2020.11.006 |
| [25] |
SUZUKI T, ONO A, CHOI JH, WU J, KAWAGISHI H, DOHRA H. The complete mitochondrial genome sequence of the edible mushroom Stropharia rugosoannulata (Strophariaceae, Basidiomycota)[J]. Mitochondrial DNA Part B, 2019, 4(1): 570-572. DOI:10.1080/23802359.2018.1558120 |
| [26] |
LIU YT, SUN J, LUO ZY, RAO SQ, SU YJ, XU RR, YANG YJ. Chemical composition of five wild edible mushrooms collected from Southwest China and their antihyperglycemic and antioxidant activity[J]. Food and Chemical Toxicology, 2012, 50(5): 1238-1244. DOI:10.1016/j.fct.2012.01.023 |
| [27] |
LI SR, WANG L, NI SJ, WANG HH, LIU XF, LIU CX. The amino acids content of different part of Stropharia rugoso-annulata and their nutrition evaluation[J]. Food Research and Development, 2017, 38(8): 95-99. (in Chinese) 李淑荣, 王丽, 倪淑君, 汪慧华, 刘小飞, 柳春旭. 大球盖菇不同部位氨基酸含量测定及营养评价[J]. 食品研究与开发, 2017, 38(8): 95-99. |
| [28] |
CHEN RR, LI W, WU D, MAO CF, BAO DP, CHEN WC, ZHANG JS, YANG Y. Nutrients, texture and taste characteristics of Stropharia rugosoannulata during growth and development[J]. Acta Edulis Fungi, 2022, 29(4): 42-54. (in Chinese) 陈荣荣, 李文, 吴迪, 毛传福, 鲍大鹏, 陈万超, 张劲松, 杨焱. 大球盖菇生长发育过程中营养、质构和滋味特征的动态变化[J]. 食用菌学报, 2022, 29(4): 42-54. |
| [29] |
LU H, SHANG XD, WANG XY, WANG CH, LIU JH, CHEN WZ, WANG RJ, XU N. Comparison and analysis of volatile components in different parts of fruiting body of Stropharia rugoso-annulata[J]. Modern Food Science and Technology, 2022, 38(7): 271-281, 196. (in Chinese) 陆欢, 尚晓冬, 王小艳, 王春晖, 刘建辉, 陈晚朱, 王瑞娟, 徐宁. 大球盖菇子实体不同部位挥发性成分的比较分析[J]. 现代食品科技, 2022, 38(7): 271-281, 196. |
| [30] |
WENG MJ. Extraction, structure and bioactivity of polysaccharides from Stropharia rugoso-annulata[D]. Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2010 (in Chinese). 翁敏劼. 大球盖菇多糖的提取、结构及生物活性研究[D]. 福州: 福建农林大学硕士学位论文, 2010. |
| [31] |
KODAMA N, KAKUNO T, NANBA H. Stimulation of the natural immune system in normal mice by polysaccharide from maitake mushroom[J]. Mycoscience, 2003, 44(3): 257-261. |
| [32] |
JIANG L. The research on preparation, structural identification and biological activity of polysaccharide from Stropharia rugosoannulata (SR-1) and polysaccharide from Tricholoma lascivum (Fr. ) gillet (TLG-1)[D]. Nanchong: Master's Thesis of China West Normal University, 2019 (in Chinese). 蒋琳. 大球盖菇多糖(SR-1)与草黄口蘑多糖(TLG-1)的制备、结构鉴定及生物活性研究[D]. 南充: 西华师范大学硕士学位论文, 2019. |
| [33] |
ZHOU B, JIA L, MENG FY, SONG Z, LIU XN, DENG P, FAN KM. Statistical optimization of cultivation conditions for exopolysacchride production and mycelia growth by Stropharia rugosoannulata[J]. Annals of Microbiology, 2010, 60(1): 89-96. |
| [34] |
HE PX, GENG LJ, WANG JZ, XU CP. Production, purfication, molecular characterization and bioactivities of exopolysaccharides produced by the wine cap culinary-medicinal mushroom, Stropharia rugosoannulata 2# (higher basidiomycetes)[J]. International Journal of Medicinal Mushrooms, 2012, 14(4): 365-376. |
| [35] |
ZHAI XH, ZHAO AJ, GENG LJ, XU CP. Fermentation characteristics and hypoglycemic activity of an exopolysaccharide produced by submerged culture of Stropharia rugosoannulata #2[J]. Annals of Microbiology, 2013, 63(3): 1013-1020. |
| [36] |
LI XP, CUI WJ, CUI YF, SONG XL, JIA L, ZHANG JJ. Stropharia rugoso-annulata acetylated polysaccharides alleviate NAFLD via Nrf2/JNK1/AMPK signaling pathways[J]. International Journal of Biological Macromolecules, 2022, 215: 560-570. |
| [37] |
ZHANG WW, TIAN GT, GENG XR, ZHAO YC, NG TB, ZHAO LY, WANG HX. Isolation and characterization of a novel lectin from the edible mushroom Stropharia rugosoannulata[J]. Molecules, 2014, 19(12): 19880-19891. |
| [38] |
LI W, CHEN WC, MA HL, WU D, ZHANG Z, YANG Y. Structural characterization and angiotensin-converting enzyme (ACE) inhibitory mechanism of Stropharia rugosoannulata mushroom peptides prepared by ultrasound[J]. Ultrasonics Sonochemistry, 2022, 88: 106074. |
| [39] |
CHEN WC, LI W, WU D, ZHANG Z, CHEN H, ZHANG JJ, WANG CG, WU T, YANG Y. Characterization of novel umami-active peptides from Stropharia rugoso-annulata mushroom and in silico study on action mechanism[J]. Journal of Food Composition and Analysis, 2022, 110: 104530. |
| [40] |
LI W, CHEN WC, WU D, ZHANG Z, YANG Y. Taste peptides derived from Stropharia rugosoannulata fermentation mycelium and molecular docking to the taste receptor T1R1/T1R3[J]. Frontiers in Nutrition, 2022, 9: 960218. |
| [41] |
WU J, FUSHIMI K, TOKUYAMA S, OHNO M, MIWA T, KOYAMA T, YAZAWA K, NAGAI K, MATSUMOTO T, HIRAI H, KAWAGISHI H. Functional-food constituents in the fruiting bodies of Stropharia rugosoannulata[J]. Bioscience, Biotechnology, and Biochemistry, 2011, 75(8): 1631-1634. |
| [42] |
WU J, TOKUYAMA S, NAGAI K, YASUDA N, NOGUCHI K, MATSUMOTO T, HIRAI H, KAWAGISHI H. Strophasterols A to D with an unprecedented steroid skeleton: from the mushroom Stropharia rugosoannulata[J]. Angewandte Chemie: International Edition English, 2012, 51(43): 10820-10822. |
| [43] |
WU J, SUZUKI T, CHOI JH, YASUDA N, NOGUCHI K, HIRAI H, KAWAGISHI H. An unusual sterol from the mushroom Stropharia rugosoannulata[J]. Tetrahedron Letters, 2013, 54(36): 4900-4902. |
| [44] |
SATO S, FUKUDA Y, OGURA Y, KWON E, KUWAHARA S. Synthesis of the epimeric secosteroids strophasterols A and B[J]. Angewandte Chemie: International Edition English, 2017, 56(36): 10911-10914. |
| [45] |
WU J, KOBORI H, KAWAIDE M, SUZUKI T, CHOI JH, YASUDA N, NOGUCHI K, MATSUMOTO T, HIRAI H, KAWAGISHI H. Isolation of bioactive steroids from the Stropharia rugosoannulata mushroom and absolute configuration of strophasterol B[J]. Bioscience, Biotechnology, and Biochemistry, 2013, 77(8): 1779-1781. |
| [46] |
YAN QX, HUANG MX, SUN P, CHENG SX, ZHANG Q, DAI H. Steroids, fatty acids and ceramide from the mushroom Stropharia rugosoannulata Farlow apud Murrill[J]. Biochemical Systematics and Ecology, 2020, 88: 103963. |
| [47] |
HUANG S. Study on the extraction and antioxidation of polyphenol compounds of Stropharia rugosoannulata Farlow[D]. Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2010 (in Chinese). 黄珊. 大球盖菇酚类物质的提取及其抗氧化性研究[D]. 福州: 福建农林大学硕士学位论文, 2010. |
| [48] |
DUAN YG. Nutritional quality analyse, extraction and application of flavonoids of Stropharia rugoso-annulata Farlow[D]. Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2010 (in Chinese). 段永刚. 大球盖菇营养品质分析、黄酮类化合物提取及应用研究[D]. 福州: 福建农林大学硕士学位论文, 2010. |
| [49] |
YAN QX, LUO XL, LI CQ, ZHOU YX, QIN XM, QIN J, DAI H. Anti-fatigue effect of Stropharia rugosoannulata fruiting body extracts derived from different solvents[J]. Acta Edulis Fungi, 2018, 25(4): 65-70. (in Chinese) 鄢庆祥, 罗小莉, 李潮钦, 周阳晓, 覃雄梅, 覃婕, 戴航. 皱环球盖菇抗疲劳作用活性部位筛选[J]. 食用菌学报, 2018, 25(4): 65-70. |
| [50] |
LIU BH. Selection of Stropharia rugoso-annulata Farlow ex Murrill strain for decomposition of crop residues and its application in mushroom production[D]. Chengdu: Master's Thesis of Sichuan University, 2004 (in Chinese). 刘本洪. 降解作物秸秆的大球盖菇菌株选育及应用[D]. 成都: 四川大学硕士学位论文, 2004. |
| [51] |
HONG Q, ZHAO Y, CHEN MJ, HUANG JC, FENG ZY, CHEN H, ZHANG JJ. Effects of in situ Stropharia rugosoannulata cultivation residue return on soil organic matter, enzyme activity and bacterial diversity[J]. Acta Edulis Fungi, 2022, 29(1): 27-35. (in Chinese) 洪琦, 赵勇, 陈明杰, 黄建春, 冯志勇, 陈辉, 张津京. 大球盖菇菌渣原位还田对土壤有机质、酶活力及细菌多样性的影响[J]. 食用菌学报, 2022, 29(1): 27-35. |
| [52] |
CHEN H, HAO HB, CHEN MJ, HUANG JC, ZHANG JJ. Preliminary study on effects of returning mushroom residue to forest on soil physical and chemical properties[J]. Edible Fungi, 2022, 44(2): 13-16. (in Chinese) 陈辉, 郝海波, 陈明杰, 黄建春, 张津京. 大球盖菇菌渣还林对土壤理化性状的影响初探[J]. 食用菌, 2022, 44(2): 13-16. |
| [53] |
GONG S, CHEN C, ZHU JX, QI GY, JIANG SX. Effects of wine-cap Stropharia cultivation on soil nutrients and bacterial communities in forestlands of northern China[J]. PeerJ, 2018, 6: e5741. |
| [54] |
ZHANG Y, LI GH, ZHANG KQ. A review on the research of nematophagous fungal species[J]. Mycosystema, 2011, 30(6): 836-845. (in Chinese) 张颖, 李国红, 张克勤. 食线虫真菌资源研究概况[J]. 菌物学报, 2011, 30(6): 836-845. |
| [55] |
ZOUHAR M, DOUDA O, NOVÁKOVÁ J, DOUDOVÁ E, MAZÁKOVÁ J, WENZLOVÁ J, RYŠÁNEK P, RENČO M. First report about the trapping activity of Stropharia rugosoannulata acanthocytes for northern root knot nematode[J]. Helminthologia, 2013, 50(2): 127-131. |
| [56] |
HUSSAIN M, ZOUHAR M, RYŠÁNEK P. Attraction of root knot nematodes, Meloidogyne incognita, to living mycelium of nematophagous fungi[J]. Pakistan Journal of Zoology, 2018, 50(6): 2073-2078. |
| [57] |
BIAN J, ZHANG HL, MENG S, LIU YJ. Chemotaxis of Caenorhabditis elegans toward volatile organic compounds from Stropharia rugosoannulata induced by amino acids[J]. Journal of Nematology, 2018, 50(1): 3-8. |
| [58] |
HUSSAIN M, ZOUHAR M, RYŠÁNEK P. Effect of some nematophagous fungi on reproduction of a nematode pest, Heterodera schachtii, and growth of sugar beet[J]. Pakistan Journal of Zoology, 2016, 49(1): 189-196. |
| [59] |
VALENTÍN L, OESCH-KUISMA H, STEFFEN KT, KÄHKÖNEN MA, HATAKKA A, TUOMELA M. Mycoremediation of wood and soil from an old sawmill area contaminated for decades[J]. Journal of Hazardous Materials, 2013, 260: 668-675. |
| [60] |
ANASONYE F, WINQUIST E, KLUCZEK-TURPEINEN B, RÄSÄNEN M, SALONEN K, STEFFEN KT, TUOMELA M. Fungal enzyme production and biodegradation of polychlorinated dibenzo-p-dioxins and dibenzofurans in contaminated sawmill soil[J]. Chemosphere, 2014, 110: 85-90. |
| [61] |
POZDNYAKOVA N, SCHLOSSER D, DUBROVSKAYA E, BALANDINA S, SIGIDA E, GRINEV V, TURKOVSKAYA O. The degradative activity and adaptation potential of the litter-decomposing fungus Stropharia rugosoannulata[J]. World Journal of Microbiology and Biotechnology, 2018, 34(9): 133. |
| [62] |
WEISS M, GEYER R, RUSSOW R, RICHNOW HH, KÄSTNER M. Fate and metabolism of[15N] 2, 4, 6-trinitrotoluene in soil[J]. Environmental Toxicology and Chemistry, 2004, 23(8): 1852-1860. |
| [63] |
JAROSZ-WILKOŁAZKA A, KOCHMAŃSKA-RDEST J, MALARCZ̄YK E, WARDAS W, LEONOWICZ A. Fungi and their ability to decolourize azo and anthraquinonic dyes[J]. Enzyme and Microbial Technology, 2002, 30(4): 566-572. |
| [64] |
CASTELLET-ROVIRA F, LUCAS D, VILLAGRASA M, RODRÍGUEZ-MOZAZ S, BARCELÓ D, SARRÀ M. Stropharia rugosoannulata and Gymnopilus luteofolius: promising fungal species for pharmaceutical biodegradation in contaminated water[J]. Journal of Environmental Management, 2018, 207: 396-404. |
| [65] |
HAN M. The mycoremediation of Escherichia coli by Pleurotus ostreatus, Stropharia rugosoannulata, and Trametes versicolor in contaminated water[J]. Junior Academy Research Article, 2021, 19(2): 56-63. |
 2023, Vol. 50
2023, Vol. 50