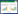扩展功能
文章信息
- 申云鑫, 赵江源, 王楠, 李铭刚, 施竹凤, 冯路遥, 李者芬, 陈齐斌, 杨佩文
- SHEN Yunxin, ZHAO Jiangyuan, WANG Nan, LI Minggang, SHI Zhufeng, FENG Luyao, LI Zhefen, CHEN Qibin, YANG Peiwen
- 具促生功能拟蕈状芽孢杆菌(Bacillus paramycoides) SH-1464发酵条件优化及其活性
- Optimization of fermentation conditions of Bacillus paramycoides SH-1464 with growth-promoting activity
- 微生物学通报, 2023, 50(6): 2436-2451
- Microbiology China, 2023, 50(6): 2436-2451
- DOI: 10.13344/j.microbiol.china.221116
-
文章历史
- 收稿日期: 2022-11-15
- 接受日期: 2023-02-07
- 网络首发日期: 2023-02-24
2. 云南省农业科学院农业环境资源研究所, 云南 昆明 650205;
3. 云南大学, 云南 昆明 650091
2. Agricultural Environment and Resources Institute, Yunnan Academy of Agricultural Sciences, Kunming 650205, Yunnan, China;
3. Yunnan University, Kunming 650091, Yunnan, China
随着中国农业现代化进程的不断加快,化肥和农药的施用量大幅增加,对生态环境造成的破坏也大幅提高,如何在农业生产中达到“减肥增效”的目标是亟须探究的问题[1]。植物根际促生菌(plant growth promoting rhizobacteria, PGPR)是植物根际非致病有益细菌的总称,不仅具有环保、安全、有效等特点,同时还可促进植物生长、提高植物系统抗性、改善土壤养分状况等功能,具有极大的潜力[2-3]。然而菌株的生长速度、生物量及次生代谢产物分泌量等与发酵条件相关,不同的生境偏好性决定菌株的生长代谢过程[4]。因此,分离筛选活性强、功能多样化的PGPR是推进农业绿色发展的有效措施,优化其发酵条件是提高其生物量、增加次生代谢物产量的有效途径,更是推进活性菌株产业化和商业化的主要措施之一。
目前,对PGPR的研究主要以伯克霍氏菌属(Burkholderia)、弗兰克氏菌属(Frankia)、固氮菌属(Azotobacter)和芽孢杆菌属(Bacillus)等为主。其中,芽孢杆菌属以解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、贝莱斯芽孢杆菌(Bacillus velezensis)、地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subtilis)和暹罗芽孢杆菌(Bacillus siamensis)等居多,而对拟蕈状芽孢杆菌(Bacillus paramycoides)的研究较少,分离自海洋的拟蕈状芽孢杆菌Gxun-30具有产角蛋白酶的活性,可有效促进动物羽毛的水解[5];拟蕈状芽孢杆菌AUUP3可显著提高盐胁迫下幼苗的根长、茎长、根鲜干重、茎鲜干重[6]。张妙宜等[7]于诺尼树植株分离得到的内生暹罗芽孢杆菌(Bacillus siamensis)可促进番茄种子萌发,显著提高植株的生长,同时对青霉素、硫酸链霉素等具有明显的抗性。庄馥璐等[8]于苹果根际土壤筛选所得的菌株PsbM4可矿化植酸钙,具有解磷活性且磷酸酶活性较强,并可刺激拟南芥植株分泌氢离子从而更好地应对低磷环境胁迫。杨华等[9]于水稻根围分离得到的5株菌均使水稻种子的萌发和根系的生长得到显著的促进,而且均对其根长、茎的生长及分蘖具有促进作用。综上可知,PGPR具有物种多样、来源广泛、功能多样化等特点,分离筛选功能多样化且对作物具有良好促生作用的菌株,可为微生物肥料的开发提供高效的菌种资源,以满足可持续发展和生态文明建设背景下的农业生产需求。
PGPR可通过分泌生长素和细胞分裂素等生理活性物质促进植物生长,通过固氮以及将有机磷水解转化为无机磷酸盐、将不溶性无机磷转化为可溶性磷酸盐等方式改善土壤养分状况,已经成为微生物肥料领域的研究热点且被广泛应用[10]。
本研究基于健康烟草根际土壤,分离筛选具溶磷和分泌吲哚乙酸(indole acetic acid, IAA)活性的菌株,基于单因素试验设计探究功能菌株最适溶磷培养条件及最适分泌IAA培养条件,以提高菌株的溶磷活性和IAA分泌量,并结合促番茄种子萌发和幼苗生长试验验证其促生活性;使用形态学、生理生化及分子生物学鉴定方法对其进行鉴定,并测定其分泌蛋白酶、纤维素酶及产铁载体活性,以期为微生物肥料的开发利用提供高效微生物资源,为菌株的开发和推广应用提供理论支撑。
1 材料与方法 1.1 材料 1.1.1 样品土壤样品:采样地点位于云南省丽江市长期轮作健康烟田,每个县(区)选择5个乡(镇),各选择3个村,共30个样点,采集健康烟株的根际土壤,混合为一个土壤样品,置于50 mL的无菌离心管中,带回实验室做土壤细菌分离。
1.1.2 培养基蒙金娜液体培养基(PVK培养基) (g/L)[8]:葡萄糖10.00,硫酸铵0.50,酵母浸粉0.50,氯化钠0.30,氯化钾0.30,硫酸镁0.30,硫酸亚铁0.03,硫酸锰0.03,磷酸钙5.00,pH 7.00,121 ℃灭菌30 min。供试磷源:磷酸三钙Ca3(PO4)2 (分析纯,P质量分数20.0%);磷酸铁FePO4 (分析纯,P质量分数16.6%);磷酸铝AlPO4 (分析纯,P质量分数25.0%),以PVK培养基为基础,进行解磷菌的研究。作为产IAA优化基础培养基的LB培养基(g/L):酵母粉5.00,蛋白胨10.00,氯化钠l0.00,l-色氨酸0.10,pH 7.20−7.50。NA培养基、固氮选择培养基、NB培养基、PDA培养基、脱脂牛奶培养基、纤维素培养基、果胶培养基、解钾选择培养基和纤维素培养基按参考文献[1, 3-5]配制。CAS双层平板:下层为显色培养基(270 mL水琼脂培养基加30 mL CAS显色液),上层为NA培养基。CAS显色液:称取0.060 5 g铬天青S (chromeazurol S, CAS)溶于50 mL去离子水中,并加入10 mL FeCl3溶液(1 mmol/L FeCl3·6H2O+10 mmol/L HCl)搅拌混匀,标记为“A液”;称取0.072 9 g十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide, HDTMA)溶于40 mL去离子水,标记为“B液”,最后将A液缓慢倒入B液中,搅拌均匀[11]。
1.1.3 主要试剂和仪器磷酸三钙、磷酸铁、磷酸铝,北京德科岛金科技有限公司;l-色氨酸、抗坏血酸、十六烷基三甲基溴化铵,上海阿拉丁生化科技股份有限公司;铬天青和酒石酸锑钾,上海麦克林生化科技股份有限公司;IAA标准品,西格玛奥德里奇(上海)贸易有限公司;钼酸铵,成都润泽本土化工有限公司;TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit,TaKaRa公司。
微型pH仪,上海仪电科学仪器股份有限公司;紫外分光光度计,上海元析仪器有限公司;超高速离心机,上海龙跃仪器设备有限公司;恒温摇床、生化培养箱,上海智城分析仪器制造有限公司;超声波清洗器,昆山市超声仪器有限公司;扫描电镜,复纳科学仪器(上海)有限公司。
1.2 方法 1.2.1 功能菌株分离及筛选取2 g土壤样品置于198 mL无菌水中(500 mL锥形瓶加玻璃珠),30 ℃、180 r/min摇床复苏1 h左右,静置2−3 min,取上清液梯度稀释至10−3、10−4、10−5,3次重复,分别吸取0.2 mL均匀涂布于PVK培养基上,30 ℃恒温培养3 d,挑取并纯化具溶磷圈的菌株作为复筛活性菌株[1]。
1.2.2 功能菌株的复筛取纯化后的菌株制成1×108 CFU/mL菌悬液,以1%的接种量接种于灭菌PVK培养基中,空白培养基为对照,3次重复,28 ℃、120 r/min培养3 d后转移至50 mL无菌离心管中加(或不加) 0.5 g无磷活性炭,采用超声波清洗器进行超声波细胞破碎(工作2 s停3 s,30%功率20 min),以释放细胞内可溶性磷,4 000 r/min离心20 min,利用钼锑抗比色法[10]测定可溶性磷含量。
1.2.3 功能菌株分泌IAA特性鉴定1) 定性检测
挑取单菌落接种于LB培养基中,30 ℃、180 r/min培养24 h,无菌条件吸取4 mL发酵液于离心管中,快速与4 mL Sackowcki’s显色剂(将150 mL的浓硫酸缓缓加入到250 mL的去离子水中,边加边搅拌,待溶液冷却后加入7.5 mL 0.5 mol/L的FeCl3·6H2O溶液)混合,常温避光静置显色40 min,观察并记录颜色变化。
2) 定量检测
称取10 mg IAA标准品溶解于少量乙醇,蒸馏水定容至100 mL (浓度为100 μg/mL),梯度稀释至0、10、20、30、40、50、60 μg/mL,各取4 mL,等体积加入显色剂,40 ℃避光静置显色40 min,测定其OD535值,绘制标准曲线。将菌悬浮液和空白对照10 000 r/min离心10 min后取上清液4 mL与显色剂1:1混合均匀,在黑暗中静置40 min,用分光光度计测定其OD535值;重复3次,以空白显色剂调零,对比绘制的标准曲线,连续测定7 d,记录不同发酵时间颜色变化,并计算各时间段菌株的IAA产量,以得出菌株产IAA最佳发酵时间[12]。
1.2.4 功能菌株SH-1464溶磷和IAA产量发酵条件的单因素试验设计以PVK液体培养基和LB培养基为基础培养基,接种量1%,培养时间分别为72 h和48 h,并以溶磷量和发酵液IAA含量为指标进行单因素条件优化,包括:碳源(葡萄糖、蔗糖、麦芽糖、乳糖、可溶性淀粉),氮源(蛋白胨、胰蛋白胨、酵母粉、氯化铵),无机盐源(针对生长素),难溶性磷源(磷酸三钙5.0 g/L、磷酸铁6.0 g/L、磷酸铝4.0 g/L)及其含量(2.5、5.0、7.5 g/L),初始pH (4.5、5.5、6.5、7.5、8.5),培养温度(21、24、27、30、33、36、39 ℃),以及摇床转速(120、140、160、180、200、220、240 r/min),以确定最佳组合。
1.2.5 菌株促番茄种子发芽能力测定共设4个处理:(1) 菌株SH-1464发酵48 h后4 ℃、8 000 r/min离心10 min,弃去上清液,用无菌水重悬菌体并调节浓度为1.0×108 CFU/mL;(2) 菌株SH-1464发酵48 h后4 ℃、8 000 r/min离心10 min,取上清液稀释1 000倍;(3) 无菌水;(4) IAA标准品(100 mg/L)。按上述分组进行24 h浸种处理后,取各组种子置于铺垫2−3层灭菌滤纸的9 cm透明培养皿中,每盒15粒,重复3次,共45颗种子,于27 ℃人工气候箱,光、暗交替时间为16 h和8 h,培养7 d测定根长及整株长。
1.2.6 菌株促番茄幼苗生长能力测定按1%的接种量将菌接种于NB液体培养基中,30 ℃、180 r/min摇床培养48 h,培养至活菌数约为1.2×1011−3.5×1011 CFU/mL,稀释1 000倍待用。筛选长势相近的番茄幼苗,移栽至直径14 cm且装有灭菌蔬菜种植基质的花盆中,每盆4株。设置试验组(菌液)、对照组(灭菌水CK1、灭菌NB液体培养基CK2),每个处理5盆共20株,室内常规处理7 d后,每周使用菌株SH-1471发酵液进行灌根,每盆200 mL。生长期间每3天浇水一次,日夜温度分别为25 ℃、20 ℃,光照时长14 h、黑暗时长10 h。35 d后测量番茄植株株高、茎围、根长、根重及地上部鲜重和地上部干重。
1.2.7 菌株形态学及生理生化特征鉴定参照《伯杰氏系统分类手册》[13]和《常见细菌系统鉴定手册》[14]中的方法对菌株SH-1464进行形态学鉴定和生理生化特性检测。
1.2.8 菌株分子生物学鉴定将菌株SH-1464接种至NB培养基中,37 ℃、180 r/min振荡培养,当发酵液OD600值近似于1.00 (约1×109 CFU/mL)时结束培养。采用TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit提取菌株基因组DNA。采用细菌16S rRNA基因通用引物27F (5′-AGAGTTTGA TCCTGGCTCAG-3′)和1492R (5′-TACGGYTA CCTTGTTACGACTT-3′)进行PCR扩增。PCR反应体系(25 μL):细菌DNA模板2 μL,2×Taq PCR Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 8.5 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 60 s,53 ℃ 60 s,72 ℃ 2 min,35个循环;72 ℃ 7 min;4 ℃保存。反应结束后,取5 μL反应产物经1.0%琼脂糖凝胶电泳在凝胶成像系统中观察。PCR扩增产物经琼脂糖凝胶电泳纯化回收后,委托北京擎科生物科技有限公司测序。结果经BLAST (https://blast. ncbi.nlm.nih.gov/Blast.cgi)后于GenBank数据库进行比较分析,选用相似性较高的模式菌株序列作为参比对象,用MEGA 7.0软件的邻接法(neighbor-joining method)构建系统发育树,bootstrap值设定为1 000,其余均为默认值。
1.2.9 功能菌株体外产酶、解钾、固氮及产铁载体能力测定将菌株分别点接到脱脂牛奶培养基、纤维素培养基、果胶培养基、解钾选择培养基和固氮选择培养基上,37 ℃培养48 h,若有透明圈生成则说明具有相应活性,使用CAS双层平板检测菌株产铁载体能力[11]。
1.3 数据处理数据采用单因素方差分析、多重比较及独立样本t检验分析比较处理间的显著性差异。选择Excel和SPSS Statistics 20.0软件进行数据统计分析,采用Origin 2021和GraphPad Prism 8制图。
2 结果与分析 2.1 溶磷菌筛选结果经分离纯化,于烟草根际土壤中分离纯化得到127个形态不同的菌株,分别接种于无机磷细菌培养基进行初筛,结果表明其中10株具有溶磷功能,溶磷能力如表 1所示,其中菌株SH-1464的溶磷圈直径最大,为16.11 mm (图 1A),而且溶磷量达119.22 mg/L,表明菌株SH-1464具有较强的溶磷能力,因此选为目的菌株。
| 菌株编号 Strain No. |
溶磷圈直径 Dissolved phosphorus ring (mm) |
溶磷量 Phosphorus soluble content (mg/L) |
| SH-1464 | 16.11±0.85a | 119.22±2.02a |
| SH-5 | 13.20±0.58b | 108.44±2.58b |
| SH-24 | 8.11±0.32c | 98.86±1.58c |
| SH-13 | 8.06±0.35c | 90.26±2.88d |
| SH-14 | 7.97±0.58c | 88.64±2.18d |
| SH-16 | 7.61±0.48c | 84.22±3.96d |
| SH-18 | 7.55±0.89c | 69.44±4.58de |
| SH-21 | 6.98±0.78c | 55.12±2.57e |
| SH-23 | 6.66±0.99c | 55.46±3.58e |
| SH-25 | 5.42±0.87c | 48.13±4.56f |
| 数据为3次重复的平均值±标准差,不同小写字母表示不同菌株之间具有显著差异(P < 0.05) The data is the mean±standard deviation of 3 replicates. Different lowercase letters indicate significant differences between different strains (P < 0.05). |
||
|
| 图 1 菌株SH-1464在固体培养基上的溶磷圈 Figure 1 Phosphoric cycle of strain SH-1464 on solid culture medium. |
|
|
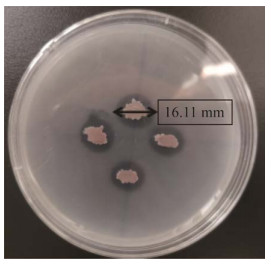
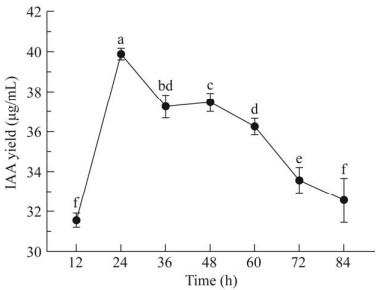
使用紫外分光光度计在OD535处测定IAA,标准曲线为y=0.006 9x+0.005 8 (r=0.998 9)。菌株SH-1464经LB培养基连续培养7 d后,结果表明,菌株SH-1464发酵液与Salkowski’s显色剂反应呈粉红色,表明菌株SH-1464具有产IAA的能力,并于发酵48 h时显色颜色最深,OD535最大,为0.281 (图 2,图 3),即IAA产生量最大,为39.88 μg/mL。经计算菌株SH-1464的IAA分泌量范围为31.56‒39.88 μg/mL。

|
| 图 2 菌株SH-1464分泌生长素活性测定 Figure 2 Determination of IAA activity of strain SH-1464. |
|
|
|
| 图 3 菌株SH-1464在不同发酵时间生长素产量测定 Figure 3 The IAA yield of strain SH-1464 was measured at different fermentation times 不同小写字母表示菌株不同发酵时间IAA产量具有显著差异(P < 0.05) Different lowercase letters indicated significant difference in IAA yield at different fermentation times (P < 0.05). |
|
|
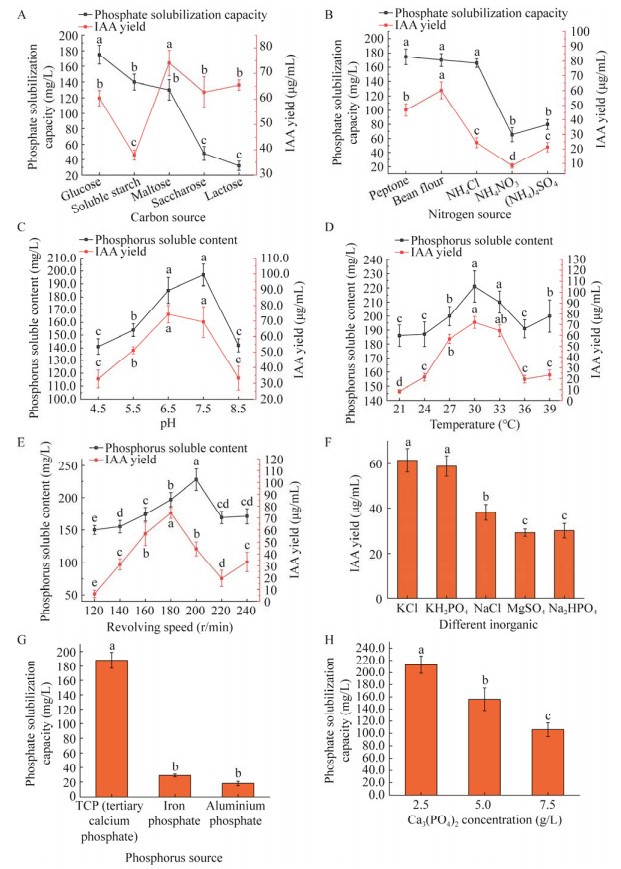
以PVK液体培养基为优化对象进行菌株SH-1464溶磷条件优化,以葡萄糖为碳源,菌株SH-1464的溶磷能力最强,溶磷量为175 mg/L (图4A);以蛋白胨(peptone)为氮源时溶磷量最高,达174.68 mg/L (图4B);此外,发酵条件对菌株溶磷能力也具有一定的影响,基于上述结果优化发酵条件,当pH为7.5时,菌株SH-1464的溶磷量达为197 mg/L (图4C);当发酵温度为30 ℃时,溶磷量达198.5 mg/L (图4D);当转速为220 r/min时,溶磷量达228 mg/L (图4E)。而且菌株SH-1464对不同难溶性磷的溶解能力不同,以2.5 g/L磷酸三钙为磷源时,溶磷量达213 mg/L (图4G、4H)。
以LB液体培养基为优化对象进行菌株SH-1464产IAA条件优化,以麦芽糖为碳源时IAA产量最高,达74.06 μg/mL (图 4A);以豆粉为氮源时(图 4B)菌株的IAA产量最高,达60.13 μg/mL;此外,培养条件优化结果表明,pH (图 4C)、温度(图 4D)、转速(图 4E)等对菌株IAA产量的增加效果在不同梯度下具有一定的差异,在初始pH值为6.5时,IAA产量为74.35 μg/mL;转速为180 r/min时最高,为74.13 μg/mL;发酵温度为30 ℃时,IAA产量高于其他培养温度,为72.13 μg/mL,以KCl为无机盐时(图 4F),IAA产量达61.45 μg/mL。
|
| 图 4 菌株SH-1464溶磷能力和分泌IAA活性的单因素优化试验结果 Figure 4 Single factor optimization of phosphorus-solubilizing ability and IAA secretion activity of strain SH-1464 A:碳源. B:氮源. C:pH. D:温度. E:转速. F:不同无机盐对菌株SH-1464 IAA产量的影响. G、H分别代表菌株SH-1464对不同无机磷的溶解能力及其最适添加量. 不同字母表示具显著差异(P < 0.05) A, B, C, D and E respectively represent the effects of different carbon sources, nitrogen sources, pH, temperature and rotational speed on the phosphorous solubility and IAA yield of strain SH-1464. F represents the effects of different inorganic salts on IAA yield of strain SH-1464. G, H represent the solubility of SH-1464 strain to different inorganic phosphorus and the optimal addition amount. Different letters indicate significant differences (P < 0.05). |
|
|
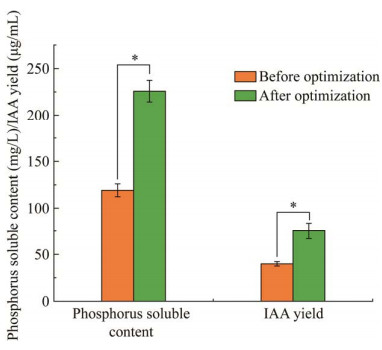
基于单因素试验结果,利用优化所得的最佳发酵配方及发酵条件进行连续3批发酵实验对比,结果如图 5所示,优化后菌株溶磷量达到225.9 mg/L,相较于优化前提升了84.5%;菌株的IAA产量达75.3 μg/mL,相较于优化前提升了88.8%。综上可见,发酵优化试验结果可靠,对菌株的溶磷量及IAA产量均具有较强的提高效果。
|
| 图 5 基于单因素优化结果前后菌株溶磷量及产IAA量变化 Figure 5 Changes in phosphorus solubility and IAA production of strains before and after optimization based on single factor. *: P < 0.05. |
|
|
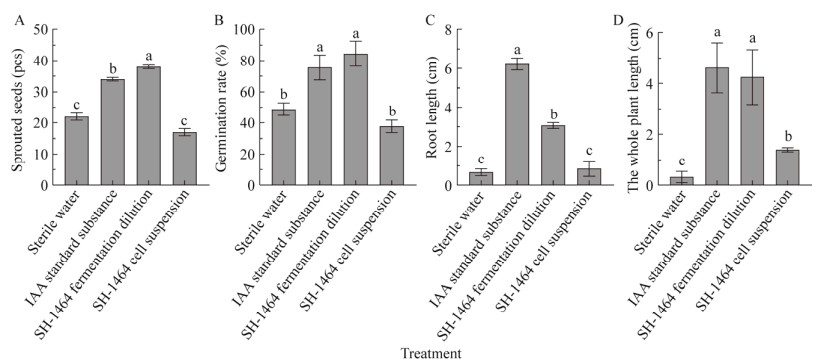
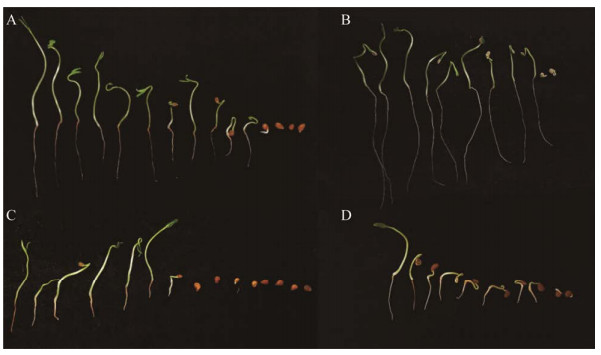
将番茄种子进行纸床培养7 d结果表明(图 6,图 7),菌株SH-1464对番茄种子发芽及其生长具有显著的促进作用,促生菌SH-1464发酵1 000倍稀释液对番茄种子萌发的促进作用最强,萌发率达84.5%,而且能促进番茄种子的根长和整株的生长,菌株发酵稀释液处理下,其根长较无菌水处理提高了218.6%,整株长是无菌水处理的13.3倍;与菌株促生效果相近,IAA标准品处理下,种子发芽率达75.6%,也可使其根长和整株长显著提高,分别是无菌水处理的4.45倍和14.4倍。在促生菌SH-1464菌悬液处理下,种子发芽率仅为37.8%,平均根长为0.65 cm,与无菌水处理相近,可能是由于菌体在纸片上缺乏营养,导致生长受阻的原因。菌株SH-1464发酵液对番茄种子促发芽效果强,对根、芽均具有良好的促生效果,菌株菌悬液对种子发芽率效果与对照无显著差异,但其对整株长具有一定的促进效果,表明菌株悬液对其生长也具有促进作用,说明菌株发酵液及菌悬液均对番茄种子萌发和生长具有促进作用。
|
| 图 6 促生菌SH-1464对番茄种子发芽的影响 Figure 6 Effects of SH-1464 on tomato seed germination A:发芽种子数. B:发芽率. C:根长. D:整株长. 不同小写字母表示不同处理具显著差异(P < 0.05) A: Sprouted seeds. B: Germination rate. C: Root length. D: The whole plant length. Different lowercase letters indicate significant differences between different treatments (P < 0.05). |
|
|
|
| 图 7 菌株SH-1464对番茄种子萌发的影响 Figure 7 Effect of SH-1464 on tomato seed germination A:SH-1464发酵稀释液. B:IAA标准品. C:SH-1464菌悬液. D:无菌水 A: SH-1464 fermentation dilution. B: IAA standard substance. C: SH-1464 cell suspension. D: Sterile water. |
|
|
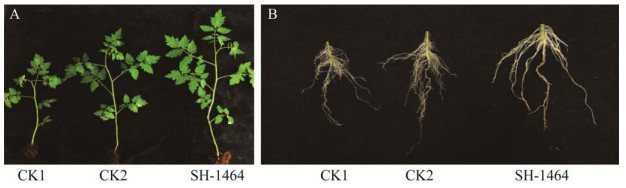
对菌株SH-1464进行番茄幼苗促生长试验,结果(表 2,图 8)表明,接种菌株SH-1464的1 000倍稀释发酵液可显著促进番茄幼苗的生长,表现为提高番茄株高、促进主根生长、增加须根数量以及增加地上部鲜重和干重,菌株发酵液处理下,与无菌水(CK1)相比番茄株高、茎围、根长、根重、地上部鲜重和地上部干重分别提高了55.1%、32.5%、16.4%、149.2%、172.2%和203.6%;与灭菌NB液体培养基(CK2)相比番茄株高、茎围、根长、根重、地上部鲜重和干重分别提高了16.3%、26.7%、6.5%、15.7%、37.1%和65.3%,表明菌株SH-1464对番茄具有良好的促生长作用,可作为高效的促生菌株资源。
| 处理 Treatment |
株高 Height (cm) |
茎围 Stem thick (cm) |
根长 Root length (cm) |
根重 Root weight (g) |
地上部分鲜重 Fresh weight of above-ground part (g) |
地上部分干重 Dry weight of above-ground part (g) |
| SH-1464 | 62.90±0.82a | 2.50±0.10a | 19.70±0.15a | 0.54±0.01a | 15.10±0.15a | 3.15±0.04a |
| CK2 | 54.10±0.70b | 1.97±0.03b | 18.50±0.15b | 0.47±0.02b | 10.90±0.18b | 1.90±0.02b |
| CK1 | 40.60±1.15c | 1.89±0.02b | 16.90±0.10c | 0.22±0.01c | 5.53±0.08c | 1.04±0.02c |
| 数据为平均值±标准差,不同字母表示不同菌株之间具有显著差异(P < 0.05) The data is the mean±standard. Different letters indicate significant differences between different strains (P < 0.05). |
||||||
|
| 图 8 菌株SH-1464对番茄生长的影响 Figure 8 Effect of strain SH-1464 on tomato growth A:番茄植株地上部分. B:番茄植株地下部分 A: The above-ground part of the tomato plant. B: The underground part of the tomato plant. |
|
|
对解磷活性菌株SH-1464进行革兰氏染色、形态学及生理生化鉴定表明(图 9),菌株SH-1464为革兰氏阳性细菌,菌落形态呈粉白色、扁平状,接触酶、淀粉水解、硝酸还原反应、吲哚反应、柠檬酸反应、精氨酸双水解、蔗糖发酵反应、葡萄糖发酵反应、固氮作用及明胶反应等均为阳性,MR反应、解钾作用和尿素酶反应为阴性。
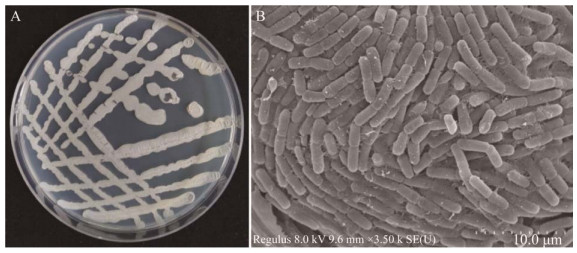
|
| 图 9 功能菌株SH-1464菌落形态及扫描电镜图 Figure 9 Colony morphology and SEM photograph of functional strain SH-1464 A:菌株SH-1464菌落形态图. B:菌株SH-1464扫描电镜图 A: Colony morphology of strain SH-1464. B: Scanning electron microscope image of strain SH-1464. |
|
|
经NCBI的BLAST分析,SH-1464的16S rRNA基因序列(GenBank登录号为ON417365)与拟蕈状芽孢杆菌MAOI01000012相似度为100%,利用邻接法构建系统发育树(图 10),结合形态学、生理生化特征及分子生物学鉴定,菌株SH-1464为拟蕈状芽孢杆菌(Bacillus paramycoides),且菌株已于2022年6月20日保存于中国典型培养物保藏中心,保藏号为CCTCC M 2022924。

|
| 图 10 菌株SH-1464基于16S rRNA基因序列构建的系统发育树 Figure 10 Phylogenetic tree of strain SH-1464 based on 16S rRNA gene sequence 括号内序号为菌株的GenBank登录号;上标“T”表明为模式菌株;分支数字表示bootstrap支持率;标尺所示长度为0.005核苷酸置换率 The serial number in parentheses is the GenBank accession number of the strain; The superscript "T" indicates the type strain; The branch number indicates the bootstrap support rate; The length indicated by the scale is 0.005 nucleotide substitution rate. |
|
|
通过底物降解法测定发现菌株SH-1464具有分泌蛋白酶、纤维素酶、固氮以及产铁载体的能力,不具备分泌果胶酶、解钾的能力(图 11)。
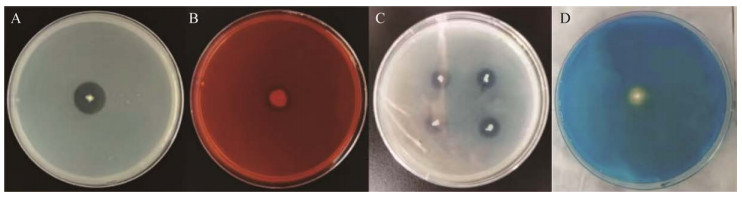
|
| 图 11 菌株SH-1464功能测定结果 Figure 11 Results of functional determination of strain SH-1464 A:蛋白酶. B:纤维素酶. C:固氮. D:产铁载体 A: Protease. B: Cellulase. C: Nitrogen fixation. D: Excreting siderophore. |
|
|
在可持续发展和生态文明建设的背景下,生物肥料产业得以快速发展,但其种类和数量远少于化学肥料,总体上呈现出市场需求较大但品种较少的现象[15]。土壤是天然的微生物菌种资源库,其中广泛存在功能多样化的有益微生物[16]。目前,从不同的植物根际土壤所筛选的PGPR种类繁多,应用在农业生产中的PGPR主要包括芽孢杆菌属(Bacillius)、根瘤菌属(Rhizobium)、青霉(Penicillium)等[2],此类微生物肥料兼具经济和环保的特点,可替代部分化肥施用,起到增加作物产量和提高品质的作用,是农业可持续发展中减施化学肥料的有效补充[17]。
目前的研究中,多数PGPR分离自作物根际土壤、植物组织内部或海洋湖泊等水体,具有来源广泛、适应能力强等特点,其大多具有固氮、溶磷、解钾、产铁载体、产IAA能力等多样化的功能。分离自番茄根际土壤和岷山红三叶根际的高效溶磷菌,分别具有溶磷、分泌生长素的功能,对病原物也具有一定的抑制活性,对作物的产量和品质均有显著的影响[18-19]。菌株PGPR LZT-5和FQG-5分别属于不动杆菌属(Acinetobacter)和嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia),对土壤理化指标、营养物质含量、作物农艺性状、产量等均具有良好的促进效果[20]。吴慧丽等[21]于镉污染地区的植物根际土壤分离得到30株耐镉细菌,其中两株具有高产IAA活性、溶磷活性,以及产1-氨基环丙烷-1-羧酸(ACC)脱氨酶和铁载体活性,在促进作物生长的同时,也促进植物对镉的吸收并促进土壤镉有效化。马骢毓等[22]使用黄芪根系和根际土壤,分离所得76株兼具固氮酶活性、溶磷及分泌IAA能力的PGPR,为研制生物菌肥提供优良菌种。高亚慧等[23]从海洋样品中分离得到一株橙色微杆菌(Microbacterium aurantiacum),其具有较强的溶有机/无机磷活性、固氮活性及产IAA活性,对作物的农艺性状具有显著的促进作用。
菌株生物量及次生代谢物分泌量与培养条件密切相关,不同培养条件对其具有一定的影响。进行发酵条件优化是提高菌株生物量以及增加次生代谢物分泌量的有效途径。前人研究表明,菌株HP2溶磷能力在不同的碳源培养基上具有一定差异,以单糖(葡萄糖、果糖)和二糖(麦芽糖、蔗糖)作为碳源时,供试菌的溶磷能力比较强[24]。牛蒡根际土壤解磷菌PSM-5,当初始pH 3.79、发酵温度28.46 ℃、盐浓度10.46 g/L时溶磷量可达198.28 mg/L[25]。本文通过对菌株SH-1464进行试验探究发现,在碳源为葡萄糖、氮源为蛋白胨、pH为7.5、温度30 ℃、转速200 r/min条件下,菌株的溶磷能力具有显著提升。菌株n3在pH值分别为5.0、6.0时产IAA能力最佳,说明其具有耐酸能力[26]。张东艳等[27]从花生根际土壤中所得的特基拉芽孢杆菌在pH 8.0时IAA产量最高。本研究中,菌株SH-1464最适pH值为6.5,这可能是由于菌株长期生存的自然环境不同,从而导致菌株的生理适应性不同。此外,氮源是菌株生长必需的物质之一,菌株满足自身生长代谢所需的营养元素大多来自氮源,但不同菌株对氮源的偏好性也具有显著差异,Sheng等[28]和Jiang等[29]的研究结果表明,以NH4NO3作为唯一氮源时,菌株发酵液酸性过强,从而导致菌株生物量大幅降低。然而在本研究中,当选用NH4NO3作为菌株生长的唯一氮源时,菌株产IAA的活性最强,但以酵母粉等作为氮源时效果不佳,说明菌株对无机氮源的适应性较强。
综合以上分析,PGPR具有物种丰富、促生能力各异、促生方式不同等特点,大多可通过解磷、溶磷、解钾、固氮等能力调整土壤营养组成与结构,提高土壤养分的有效性;也可定殖于植物根际或植物内部,通过分泌生长素等形式促进植物生长,提高植株的农艺性状及抗逆性,同时植株根系的生长会影响根际土壤微生物的生物量和生物活性,进而达到相互促进的效果。本研究筛选所得拟蕈状芽孢杆菌(Paramycoides) SH-1464具有较强的溶磷能力以及具有高产IAA活性,对其进行发酵条件优化后菌株的溶磷量提高至225.9 mg/L,IAA产量提高至75.3 μg/mL;可显著提高番茄种子的发芽率,提高番茄幼苗的株高、茎围、根长、根重、地上部分鲜重和干重等农艺性状;同时具有固氮、分泌蛋白酶、纤维素酶、铁载体等多种活性,可在生物肥料方面作为优良的菌种资源,具有极大的开发潜力。但其在土壤或植株内部的定殖能力还有待探讨,今后可进一步结合荧光定量检测技术等措施,探究菌株的定殖能力以及作用机制,为菌株的进一步开发及其推广应用提供理论依据。
| [1] |
LIU Y, LIU XD, ZHANG LL, WU Y, WANG GW, WANG Q, JIANG Y. Screening, identification of multifunctional peanut root-promoting rhizobacteria and its promoting effects on peanuts (Arachis hypogaea L.)[J]. Biotechnology Bulletin, 2017, 33(10): 125-134. (in Chinese) 刘晔, 刘晓丹, 张林利, 吴越, 王国文, 汪强, 姜瑛. 花生根际多功能高效促生菌的筛选鉴定及其效应研究[J]. 生物技术通报, 2017, 33(10): 125-134. |
| [2] |
BASU A, PRASAD P, DAS SN, KALAM S, SAYYED RZ, REDDY MS, EL ENSHASY H. Plant growth promoting rhizobacteria (PGPR) as green bioinoculants: recent developments, constraints, and prospects[J]. Sustainability, 2021, 13(3): 1140. DOI:10.3390/su13031140 |
| [3] |
JIANG MY, ZHOU Y, LIU RL, YAO F, YANG YS, HOU K, FENG DJ, WU W. Screening and plant growth promoting of grow-promoting bacteria in rhizosphere bacteria of Angelica dahurica var. Formosana[J]. Biotechnology Bulletin, 2022, 38(8): 167-178. (in Chinese) 江美彦, 周杨, 刘仁浪, 姚菲, 杨云舒, 侯凯, 冯冬菊, 吴卫. 白芷根际促生菌的筛选及其促生效果研究[J]. 生物技术通报, 2022, 38(8): 167-178. |
| [4] |
WU ZM, LAN MX, GAO X, LI MY, YUAN Y, GUO ZJ, YIN XH, WU GX. Screening of fermentation conditions for herbicidal activity of Pantoea agglomerans strain ZLSY20[J]. Journal of Southern Agriculture, 2019, 50(9): 1990-1997. (in Chinese) 吴志美, 兰明先, 高熹, 李梦月, 袁远, 郭子俊, 殷兴华, 吴国星. 除草活性成团泛菌ZLSY20菌株发酵条件的优化[J]. 南方农业学报, 2019, 50(9): 1990-1997. |
| [5] |
ZHANG HY, ZHANG N, YANG MY, LIU C, YANG LF, SHEN NK, JIANG MG. Optimization of liquid fermentation conditions of keratinase produced by Bacillus paramycoides Gxun-30[J]. Food and Fermentation Industries, 2021, 47(4): 136-143. (in Chinese) 张红岩, 张妮, 杨梦莹, 刘聪, 杨立芳, 申乃坤, 姜明国. 拟蕈状芽孢杆菌Gxun-30产角蛋白酶液体发酵条件优化[J]. 食品与发酵工业, 2021, 47(4): 136-143. |
| [6] |
PANDEY S, GUPTA S. Diversity analysis of ACC deaminase producing bacteria associated with rhizosphere of coconut tree (Cocos nucifera L.) grown in Lakshadweep Islands of India and their ability to promote plant growth under saline conditions[J]. Journal of Biotechnology, 2020, 324: 183-197. DOI:10.1016/j.jbiotec.2020.10.024 |
| [7] |
ZHANG MY, GAO ZF, TANG W, ZHAO YK, LI K, WANG W, XIE JH, ZHANG XY, HUANG MJ. Identification of probiotic bacterium Bacillus sp. QN2MO-1 and its effect on tomato growth[J]. Chinese Journal of Tropical Crops, 2020, 41(12): 2474-2481. (in Chinese) 张妙宜, 高祝芬, 唐文, 赵炎坤, 李凯, 王尉, 谢江辉, 张锡炎, 黄绵佳. 促生细菌Bacillus sp. QN2MO-1的鉴定及对番茄生长的影响[J]. 热带作物学报, 2020, 41(12): 2474-2481. DOI:10.3969/j.issn.1000-2561.2020.12.015 |
| [8] |
ZHUANG FL, CHAI XF, GAO BB, WANG Y. Isolation and screening of phosphorus-solubilizing bacteria in apple rhizosphere[J]. Journal of China Agricultural University, 2020, 25(7): 69-79. (in Chinese) 庄馥璐, 柴小粉, 高蓓蓓, 王忆. 苹果根际解磷菌的分离筛选及解磷能力[J]. 中国农业大学学报, 2020, 25(7): 69-79. |
| [9] |
YANG H, HU Z, GUO ZH, XIAO R, LUO RJ, FU ZJ, WEI XW, CAI CP, WANG YS. Screening and identification of rice growth-promoting strains and their effects on rice growth[J]. Microbiology China, 2022, 49(6): 2088-2099. (in Chinese) 杨华, 胡展, 郭照辉, 肖蓉, 罗容珺, 付祖姣, 魏小武, 蔡长平, 王玉双. 水稻促生菌的筛选、鉴定及其促生效果[J]. 微生物学通报, 2022, 49(6): 2088-2099. |
| [10] |
BHATTACHARYYA PN, JHA DK. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture[J]. World Journal of Microbiology and Biotechnology, 2012, 28(4): 1327-1350. |
| [11] |
HE X, ZHANG Q, LI C, FAN HC, LI MG, XU ST, CHEN QB, YANG MY, YANG PW. Screening of the pathogenic bacteria with siderophore-producing activity and the effect of intervention in iron uptake on its growth[J]. Plant Protection, 2020, 46(3): 85-93. (in Chinese) 何翔, 张庆, 李楚, 番华彩, 李铭刚, 徐胜涛, 陈齐斌, 杨明英, 杨佩文. 具铁载体活性病原细菌的筛选及铁摄取干预对其生长影响[J]. 植物保护, 2020, 46(3): 85-93. |
| [12] |
PRASHANTH S, MATHIVANAN N. Growth promotion of groundnut by IAA producing rhizobacteria Bacillus licheniformis MML2501[J]. Archives of Phytopathology and Plant Protection, 2010, 43(2): 191-208. |
| [13] |
BUCHANAN RE, GIBBONS NE. Bergey's Manual of Determinative Bacteriology[M]. 8th ed. Institute of Microbiology, Chinese Academy of Sciences, trans. Beijing: Science Press, 1984 (in Chinese). BUCHANAN RE, GIBBONS NE. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所, 译. 8版. 北京: 科学出版社, 1984. |
| [14] |
DONG XZ, CAI MY. Handbook of Identification of
Common Bacterial Systems[M]. Beijing: Science Press, 2001. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [15] |
Review on development of the microbial fertilizer industry in China[J]. Soil and Fertilizer Sciences in China, 2020(6): 293-298. (in Chinese) 我国微生物肥料行业发展状况[J]. 中国土壤与肥料, 2020(6): 293-298. |
| [16] |
Linking the soil microbiome to soil health[J]. Scientia Sinica (Vitae), 2021, 51(1): 1-11. (in Chinese) 土壤微生物组与土壤健康[J]. 中国科学: 生命科学, 2021, 51(1): 1-11. |
| [17] |
Development demand and technical innovation for bio-fertilizer industry in China[J]. Soil and Fertilizer Sciences in China, 2019(2): 1-5. (in Chinese) 我国微生物肥料产业需求与技术创新[J]. 中国土壤与肥料, 2019(2): 1-5. |
| [18] |
Selection of plant growth promoting rhizobacteria sharing suitable features to be commercially developed as biostimulant products[J]. Microbiological Research, 2021, 245: 126672. |
| [19] |
The inoculant potential of plant growth promoting rhizobacteria strains to improve the yield and quality of Trifolium pratense cv. Minshan[J]. Acta Prataculturae Sinica, 2014, 23(5): 231-240. (in Chinese) 岷山红三叶根际优良促生菌对其宿主生长和品质的影响[J]. 草业学报, 2014, 23(5): 231-240. |
| [20] |
Study on phosphate-solubilizing strain selection of plant growth promoting rhizobacteria and its effect on tomato growth promotion[J]. Southwest China Journal of Agricultural Sciences, 2020, 33(12): 2891-2896. (in Chinese) 植物根际促生菌(PGPR)解磷菌的筛选及其对番茄促生作用的研究[J]. 西南农业学报, 2020, 33(12): 2891-2896. |
| [21] |
Screening for plant growth-promoting rhizobacteria that promote cadmium absorption and accumulation and their effects on annual ryegrass[J]. Acta Prataculturae Sinica, 2021, 30(7): 53-61. (in Chinese) 促进镉吸收积累的植物根际促生菌的筛选及其对一年生黑麦草的影响[J]. 草业学报, 2021, 30(7): 53-61. |
| [22] |
Identification of plant growth promoting rhizobacteria Astragalus membranaceus and their effectives[J]. Acta Prataculturae Sinica, 2017, 26(1): 149-159. (in Chinese) 黄芪根际促生菌(PGPR)筛选与特性研究[J]. 草业学报, 2017, 26(1): 149-159. |
| [23] |
Screening of potential PGPR strains producing growth-promoting volatile compounds and study on their growth-promoting characteristics[J]. Biotechnology Bulletin, 2022, 38(3): 103-112. (in Chinese) 产生促生挥发性物质的潜在PGPR菌株筛选及其促生特性研究[J]. 生物技术通报, 2022, 38(3): 103-112. |
| [24] |
Solubilization capacity of insoluble phosphates and it's mechanism by two phosphate solubilizing fungi (PSF)[J]. Microbiology, 2006(5): 22-27. (in Chinese) 两株解磷真菌的解磷能力及其解磷机理的初步研究[J]. 微生物学通报, 2006(5): 22-27. |
| [25] |
Screening and identification of phosphate-solubilizing microorganism (PSM) in burdock rhizosphere soil and optimization of phosphate-solubilizing conditions[J]. China Vegetables, 2021(1): 66-72. (in Chinese) 牛蒡根际土壤中解磷菌筛选、鉴定及解磷条件优化[J]. 中国蔬菜, 2021(1): 66-72. |
| [26] |
Isolation, identification of a cellulose-degrading bacterium with IAA-producing ability and optimization of its culture conditions[J]. Biotechnology Bulletin, 2020, 36(12): 54-63. (in Chinese) 一株兼具产IAA能力纤维素降解菌的筛选、鉴定及条件优化[J]. 生物技术通报, 2020, 36(12): 54-63. |
| [27] |
Isolation and identification of IAA-producing strains from peanut rhizosphere and its promoting effects on peanut growth[J]. Chinese Journal of Oil Crop Sciences, 2016, 38(1): 104-110. (in Chinese) 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报, 2016, 38(1): 104-110. |
| [28] |
Isolation, screening, and optimization of the fermentation conditions of highly cellulolytic bacteria from the hindgut of Holotrichia parallela larvae (Coleoptera: Scarabaeidae)[J]. Applied Biochemistry and Biotechnology, 2012, 167(2): 270-284. |
| [29] |
A new isolated indole-3-acetic acid producing rhizobacteria Bacillus muralis HS4 from sandy soil: characterization and growth enhancement on peanuts[J]. Journal of Computational and Theoretical Nanoscience, 2016, 13(8): 5171-5177. |
 2023, Vol. 50
2023, Vol. 50