
扩展功能
文章信息
- 姜幸怡, 韩伟, 刘艳芳, 唐传红, 冯杰, 张劲松
- JIANG Xingyi, HAN Wei, LIU Yanfang, TANG Chuanhong, FENG Jie, ZHANG Jingsong
- 影响灵芝三萜类物质液态发酵合成的关键因素研究进展
- Identification of key factors affecting liquid fermentation of Ganoderma lucidum for triterpenes: a review
- 微生物学通报, 2023, 50(5): 2155-2172
- Microbiology China, 2023, 50(5): 2155-2172
- DOI: 10.13344/j.microbiol.china.221074
-
文章历史
- 收稿日期: 2022-10-31
- 接受日期: 2022-12-21
- 网络首发日期: 2023-02-03
2. 华东理工大学药学院 制药工程与过程化学教育部工程研究中心 上海市新药设计重点实验室, 上海 200237
2. Shanghai Key Laboratory of New Drug Design, Engineering Research Centre of Pharmaceutical Process Chemistry, Ministry of Education, School of Pharmacy, East China University of Science and Technology, Shanghai 200237, China
灵芝(Ganoderma lucidum)[1]俗称灵芝草,属担子菌门(Basidiomycota)伞菌纲(Agaricomycetes)多孔菌目(Polyporales)灵芝科(Ganodermataceae)[2],是一种在我国有着两千多年历史的食药两用型真菌,于东汉时期的《神农本草经》中最早被记载。古代医药学家对灵芝的药用价值已有充分认识,认为灵芝味甘、性温、无毒,可补心、肝、脾、肺、肾五脏之气,具有滋补强身、扶正固本之功效[3]。
灵芝中含有多糖、三萜、有机酸、可溶性蛋白质、氨基酸、生物碱、多肽等多种活性物质[2]。其中三萜类物质是灵芝次级代谢产物中的主要活性物质,具有抗肿瘤[4]、保肝排毒[5]、抗HIV病毒[6]、调节血脂[7]、抗氧化[8]、降低胆固醇[9]、抗雄激素[10]等药理活性,因此被作为灵芝重要的药用指标之一,已广泛用于预防和治疗各种类型疾病,特别是免疫调节、肝脏保护和抗肿瘤方面[11]。灵芝三萜类物质绝大部分是属于高度氧化的羊毛甾醇衍生物,由异戊二烯单元组成[12],包括灵芝酸、灵芝醇、赤芝酸和赤芝酮等,按分子中所含碳原子数分为C24、C27和C30这3大类,一般将含有羧基的三萜类物质称为灵芝酸,灵芝酸是最主要的灵芝三萜类物质,目前已分离到上百种灵芝酸,包括灵芝酸A、灵芝酸D、灵芝酸R、灵芝酸S和灵芝酸T等[13]。
现阶段获取灵芝三萜类物质有3种方式,一是野外子实体或人工栽培的子实体,二是孢子,三是发酵的菌丝体和发酵液[14]。人工栽培作为灵芝增产的一条途径,在一定程度上扩大了生产规模,提高了灵芝产量,但是人工栽培有较长的生产周期,不能合理地确定培养终点和控制产品质量参数,而且需要烦琐的破壁和浸提工艺,其中生产周期长与成本高是主要问题[15],限制了灵芝三萜酸的应用和商业化[16]。灵芝液体发酵的产物包括菌丝体和发酵液,能产生灵芝的主要活性成分且具有周期短、反应条件温和、生长的菌丝具有较高的稳定性和规范性、环境条件(温度、溶解氧、pH等)更容易控制[17]等优点,有利于灵芝三萜类物质规模化制备和工业化生产[18-19]。液体发酵技术极大地提高了生产效率[15],并且改变了人工栽培生产周期长、成本高的生产现状,是目前获得灵芝三萜类物质最有前景的培养方式。
利用液态发酵获得灵芝三萜类物质受到多种环境因素的调节,包括温度、湿度、初始pH、溶解氧、营养条件(碳源、氮源、生长因子)等。这些外界环境能够直接影响发酵过程中灵芝菌丝体的生长发育和代谢产物的积累[20]。在液态发酵时可以通过对发酵方式的优化、发酵参数(初始pH、温度、溶解氧等)的优化以及对菌株的代谢工程改造有效提高三萜类化合物的发酵产量[21-22]。本综述重点总结了灵芝三萜类物质液态发酵中关键的影响因素,主要包括代谢工程改造、液态发酵的培养工艺和培养过程中的溶解氧因素,以期更好地采用液态培养调控灵芝三萜类物质,实现灵芝三萜类物质的高产,为下一步研究及商业化应用提供借鉴。
1 灵芝三萜类物质生物合成途径灵芝三萜类物质的种类繁多,目前已在灵芝子实体、人工培养菌丝体和培养液中共分离得到了超过200种三萜类物质[23],其种类的复杂性表明了灵芝三萜类物质生物合成途径的多样性[24]。本文中所论述的灵芝种类均为赤芝。在灵芝三萜类物质代谢途径已知的情况下,可以通过发酵的手段对代谢途径进行改造,为代谢产物的调控提供方向,以此来提高目标产物的合成量,因此,灵芝三萜类物质生物合成代谢途径的研究对于液态发酵灵芝三萜类物质具有重要的意义。
灵芝三萜类物质的生物合成可以分为两个阶段:上游阶段异戊烯基焦磷酸和三萜环碳环系统的合成;下游阶段羊毛甾醇经过氧化、羟基化和糖基化生成不同结构的灵芝酸[25]。现有研究表明,灵芝三萜类物质合成的上游步骤已被基本阐明,多个关键酶已经被克隆表征并研究了其特性。合成三萜环碳环系统后,碳环骨架还需经过复杂的修饰即从羊毛甾醇之后,各种灵芝三萜或灵芝酸还需经过一系列氧化还原和酰化等反应,但目前具体的合成步骤仍不清楚[14]。
1.1 上游阶段 1.1.1 甲羟戊酸(mevalonate, MVA)途径Rohmer等[26]认为萜类物质生物合成的唯一途径是通过MVA途径,但后来在细菌和植物上的标记实验发现了一种独立于MVA的异戊二烯构建单元生物合成的替代途径,该途径被称为非甲戊酸途径或丙酮酸/甘油醛-3-磷酸途径[26-28]。因此,萜类化合物的生物合成有甲羟戊酸和丙酮酸/磷酸甘油醛两条途径[29]。
灵芝三萜类物质的前期合成途径与其他植物中的三萜类物质类似,都是通过甲羟戊酸即类异戊二烯途径合成,三萜前体至羊毛甾醇阶段的合成途径也与其他植物中三萜的合成途径类似[30]。Shiao等[31]在灵芝的液体培养基中加入13C同位素标记的MVA,并且在代谢产物中检测到了具有13C标记的3α和3β三萜类化合物。这些同位素实验[31-32]均表明灵芝三萜类物质是通过MVA途径合成的,其中甲羟戊酸被认为是唯一的前体[32]。
上游阶段分为两个过程:一是活性异戊二烯单位FPP和DMAPP的合成;二是三萜环碳环系统的生物合成[14]。截至目前,灵芝三萜合成的上游途径得到了系统性的研究且基本清楚,所涉及的11个酶已被鉴定和表征,而且多个结构基因已经被克隆和鉴定[33],它们分别编码的是乙酰辅酶A乙酰转移酶(AACT)、3-羟基-3-甲基戊二酸辅酶A合酶(HMGS)、甲羟戊酸焦磷酸脱羧酶(MVD)、3-羟基-3-甲基戊二酸辅酶A还原酶(HMGR)、鲨烯合酶(SQS)、鲨烯环氧酶(SE)、法尼基焦磷酸合酶(FPS)、羊毛甾醇合酶(LS)和异戊烯基焦磷酸异构酶(IDI)[34-41]。
上游过程以3-羟基-3-甲基戊二酸辅酶为催化剂,生物合成3-羟基-3-甲基戊二酸辅酶(HMG-CoA);之后HMG-CoA转化为甲羟戊酸,进一步转化为异戊烯基焦磷酸(IPP)[25];角鲨烯合成酶(SQS)催化角鲨烯的生物合成[42];最后,角鲨烯在氧化角鲨烯环化酶(OSC)的催化下形成羊毛甾醇,2, 3-氧化鲨烯环化形成的羊毛甾醇是GAs的环骨架,这种环化是由羊毛甾醇合成酶(LS)催化的[43],见图 1。

|
| 图 1 灵芝三萜生物合成上游途径[42-46] Figure 1 Upstream pathway of triterpenes biosynthesis[42-46]. AACT:乙酰辅酶A乙酰转移酶;HMGS:3-羟基-3-甲基戊二酰辅酶A合酶;HMGR:3-羟基-3-甲基戊二酰辅酶A还原酶;MK:甲羟戊酸激酶;MPK:磷酸甲羟戊酸激酶;MVD:甲羟戊酸焦磷酸脱羧酶;IDI:异戊烯基焦磷酸异构酶;FPS:法尼基焦磷酸合酶;FPPS:牻牛儿基焦磷酸合成酶;SQS:鲨烯合酶;SE:鲨烯环氧酶 AACT: Acetyl-CoA acetyltransferase; HMGS: 3-hydroxy-3-methylglutaryl-CoA synthase; HMGR: 3-hydroxy3-methylglutaryl-CoA reductase; MK: Mevalonate kinase; MPK: Phosphomevalonate kinase; MVD: Pyrophosphomevalonate decarboxylase; IDI: Isoper ttenyldiphosphate isomerase; FPS: Farnesyl diphos phate synthase; FPPS: Geranylgeranyl-PP synthase; SQS: Squalene synthase; SE: Squalene monooxygenase. |
|
|
Shang等[36]克隆并分析了3-羟基-3-甲基戊二酰辅酶A还原酶基因的表达,发现HMGR与灵芝重要三萜类物质(灵芝酸)的生物合成呈正相关,HMGR催化从HMG-CoA生成MVA,由于MVA的生成是一个不可逆的过程,该反应的这一步被认为是MVA途径的限速步骤,HMGR是甲羟戊酸的限速酶;甲羟戊酸焦磷酸脱羧酶(MVD)是MVA途径的关键酶,催化甲羟戊酸-5-二磷酸(MVA-PP)的脱羧反应,生成异戊烯基焦磷酸[47],这是类异戊二烯生物合成所需的基本结构[48]。研究发现对角鲨烯合成酶(SQS)、氧化角鲨烯环化酶(OSC)、法尼基焦磷酸合酶(FPS)这3个基因在灵芝菌丝体的生长阶段都可以表达,在形成原基后其表达量显著提高,对灵芝三萜类物质含量的分析表明,在原基阶段的含量比菌丝体阶段的含量高,因此这3个基因也是灵芝合成前体阶段的关键酶[39-41],目前研究的关于相关酶和基因的作用如表 1所示。
| 酶 Enzyme |
作用 Function |
| AACT | 将一个乙酰辅酶A的乙酰基转移到另一个乙酰辅酶A上,催化乙酰乙酰辅酶A的合成 Transferring the acetyl group of one acetyl-CoA to another to catalyze the synthesis of acetyl-CoA |
| HMGS | 催化乙酰乙酰辅酶A和乙酰辅酶A缩合生成HMG-CoA Catalytic condensation of acetylacetyl-CoA and acetyl-CoA to HMG-CoA |
| HMGR | 催化HMG-CoA生成MVA Catalytic HMG-CoA to MVA |
| MVD | 催化MVA-PP脱羧生成IPP Catalytic decarboxylation of MVA-PP to IPP |
| IDI | 激活IPP异构化生成DMAPP Activate IPP isomerization to generate DMAPP |
| FPS | 催化两分子IPP与DMAPP进行头尾缩合,生成10碳化合物FPP Catalytic head-to-tail condensation of two molecules of IPP and DMAPP to form 10-carbon compound FPP |
| SQS | 缩合两分子FPP成鲨烯 Condensation of two FPP molecules into squalene |
| LS | 催化2, 3-氧化鲨烯生成甾醇和三萜类前体物质羊毛甾醇 Catalytic production of sterols and triterpene precursor lanosterol from 2, 3-oxidosqualene |
| AACT:乙酰辅酶A乙酰转移酶;HMGS:3-羟基-3-甲基戊二酰辅酶A合酶;HMGR:3-羟基-3-甲基戊二酰辅酶A还原酶;MVD:甲羟戊酸焦磷酸脱羧酶;IDI:异戊烯基焦磷酸异构酶;FPS:法尼基焦磷酸合酶;SQS:鲨烯合酶;LS:羊毛甾醇合酶 AACT: Acetyl-CoA acetyltransferase; HMGS: 3-hydroxy-3-methylglutaryl-CoA synthase; HMGR: 3-hydroxy3- methylglutaryl-CoA reductase; MVD: Pyrophosphomevalonate decarboxylase; IDI: Isoper ttenyldiphosphate isomerase; FPS: Farnesyl diphos phate synthase; SQS: Squalene synthase; LS: Lanosterol synthase. |
|
灵芝三萜类物质生物合成的下游阶段主要是环上复杂的官能团反应。Shiao等[50]通过同位素标记实验表明羊毛甾醇在灵芝细胞内可以转化为灵芝酸(ganoderic acids, GAs)。Chen等[51]在灵芝全基因组测序的基础上分析推测了几种灵芝酸的可能形成途径(图 2,虚线箭头表示部分),但是目前灵芝三萜类物质生物合成下游的一系列步骤如环化、酰化、氧化还原等尚不明确,目前已知的合成途径见图 2。
细胞色素P450单加氧酶(cytochrome P450 monooxygenases, CYP450)是一个含血红素的单加氧酶超家族[57],在三萜及甾醇骨架结构多样化及功能化修饰中起着关键作用[58]。其可以催化灵芝三萜类物质合成下游的氧化反应,并对碳环骨架进行修饰,从而产生结构、功能多样的三萜类物质,催化羊毛甾醇形成不同的灵芝酸,其中一些被认为参与了羊毛甾醇骨架在甾体A/B/C/D环的C-7、C-10、C-12和/或C-15位置和/或侧链C-22、C23和/或C-26位置的修饰[23, 51]。已知与三萜类物质生物合成相关的CYP450主要分布于CYP51簇、CYP71簇、CYP72簇、CYP85簇及CYP86簇[58]。Chen等[51]对灵芝基因组进行分析,利用基因测序发现有214个cyp450基因与灵芝三萜类物质生物合成下游途径相关,其中有78个基因与羊毛甾醇合酶基因产生了共表达,猜测这些基因可能参与了灵芝酸骨架结构修饰[59],相关的CYP450如表 2所示。
| CYP450 | 作用 Function |
作用机制 Mechanism of action |
文献 References |
| gl21117 | 催化HLDOA形成灵芝酸Jb Catalytic HLDOA to form ganoderic acid Jb |
与HLDOA接触生成灵芝酸Jb Contact with HLDOA to produce ganoderic acid Jb |
[22] |
| cyp5150l8 | 催化生成HLDOA Catalytic generation of HLDOA |
参与羊毛甾醇骨架C-26位羧基的形成,催化羊毛甾醇生成HLDOA Involved in the formation of carboxyl group at C-26 of lanosterol skeleton, catalyzing the formation of HLDOA from lanosterol |
[29] |
| cyp505d13 | 配合生成环状灵芝三萜 Coordination to generate cyclic Ganoderma triterpenes |
参与ST-3的形成,配合生成环状灵芝三萜 Involved in the formation of ST-3, with the formation of annular Ganoderma triterpenes |
[45] |
| 甾醇14α-脱甲基酶基因 Sterol 14α-demethylase |
合成麦角甾醇 Synthetic ergosterol |
催化甾醇前体的14α位甲基羟基化反应 Catalytic 14α-methyl hydroxylation of sterol precursors |
[46] |
| cyp512u6 | 催化合成海南酸A、 灵芝酸Jc、灵芝酸ZXYL Catalytic synthesis of hainanic acid A, ganoderic acid Jc, ganoderic acid ZXYL |
羟基化C-23位氧化羊毛甾烷型三萜化合物与C-15-OH和/或C-7酮基 Hydroxylated C-23 oxylanostane triterpenoids with C-15-OH and/or C-7 ketone groups |
[52] |
| cyp5139g1 | 催化生成DHLDOA Catalytic generation of DHLDOA |
负责HLDOA的C-28氧化,导致工程酵母形成DHLDOA C-28 oxidation responsible for HLDOA, resulting in engineering yeast to form DHLDOA |
[53] |
| cyp512v2 | 可能参与了灵芝酸T的合成 May be involved in the synthesis of ganoderic acid T |
Unknown | [54] |
1) gl21117
王猛等[22]将从灵芝基因组中选择可能参与灵芝酸生物合成的cyp450基因克隆到酿酒酵母表达质粒中,对酿酒酵母表达质粒进行异源表达,将其转化至重组改造后的微生物酿酒酵母中,研究获得的cyp450基因gl21117,在该基因的催化下HLDOA可以形成灵芝酸Jb,与灵芝酸Jb天然化合物相比,结构一致且具有同等性能和质量,并且提供的利用cyp450基因gl21117催化制备灵芝酸Jb的方法相较于利用灵芝生长的方法具有很高的效率。
2) cyp5150l8 (gl24883)
近年来,有关灵芝酸生物合成相关的CYP450的报道逐渐增多。Wang等[29]首次报道了灵芝酸的异源生物合成,在酿酒酵母中发现cyp450基因cyp5150l8过表达,成功地鉴定了酿酒酵母中第1个负责灵芝酸生物合成的cyp5150l8,并证实该基因可产生抗肿瘤灵芝酸3-hydroxy- lanosta-8, 24-dien-26 oic acid (HLDOA);该团队以羊毛甾醇为底物进行体外酶促反应,加入NADPH和含有cyp5150l8的微粒体,从而确定cyp5150l8作为羊毛甾醇氧化酶催化的反应步骤,反应步骤分为3步且均为C-26处的氧化反应,第1步为羊毛甾醇在cyp5150l8的催化下生成3-hydroxy-lanosta-8, 24-dien-26-ol (HLDO);第2步为HLDO在cyp5150l8的催化下生成3-hydroxy-lanosta-8, 24-dien-26-al (HLDA);最后一步为HLDA在cyp5150l8的催化下生成HLDOA。cyp5150l8作为首个被报道和鉴定的参与灵芝三萜生物合成代谢途径的cyp450基因,对灵芝三萜类物质生物合成的研究具有重要意义[47]。
由于HLDOA在灵芝或异源寄主中的产量较低,阻碍了其进一步研究和应用。为了提高cpy510l8活力,Lan等[60]构建了一种双调控体系CYP510L8-iGLCPR融合蛋白(一种细胞色素P450还原酶),可以平衡cyp5150l8和灵芝P450还原酶iGLCPR的表达,从而实现促进胞内H+的转移,使灵芝酸Z的产量提升到154.45 mg/L,相比出发菌株提高了10倍。
3) cyp505d13
Song等[45]以酿酒酵母为异源宿主,在灵芝中发现可以过量表达的一种亚末端环氧化酶cyp505d13,能够使工程菌株产生2种新的角鲨烯型三萜(STs),即4, 8-二羟基-22, 23-氧化角鲨烯(ST-1),8-羟基-2, 3;22, 23-角鲨烯二氧化物(ST-2)和一种已知的2, 3;22, 23-二角鲨烯(ST-3),并且通过体外酶促实验表明,cyp505d13参与了ST-3的形成。
4) 甾醇14α-脱甲基酶基因
羊毛甾醇除了可以转化为灵芝酸外,还用于合成麦角甾醇以满足细胞生长需求。甾醇14α-脱甲基酶(sterol 14α-demethylase, P450 14-DM, CYP51)则是催化羊毛甾醇进入这一条支路途径的酶[55]。方星[46]构建了1个灵芝甾醇14α-脱甲基酶基因的超量表达载体,利用农杆菌介导的转化法实现了Gl-cyp51基因在灵芝内的超量表达,发现转化子在转录水平上显示出Gl-cyp51基因表达量和三萜含量增加。
5) cyp512u6
Yang等[52]成功克隆并鉴定了参与灵芝酸生物合成的基因cyp512u6和NADPH-细胞色素P450还原酶(GLCPR),cyp512u6基因在灵芝从菌丝体发育到原基的过程中表现出第二高的表达上调,cyp512u6在C-23位点羟基化灵芝酸DM和TR,分别生成海南酸A和灵芝酸Jc;cyp512u6还可以催化灵芝酸DM生成灵芝酸ZXYL,其中C-3酮被来自酿酒酵母的甾醇还原酶ERG27还原为羟基。此外,cyp512u6可以修饰几种底物,区域选择性地羟基化灵芝酸DM、TR和7-氧-灵芝酸Z的C-23位的H,而且不会羟基化低氧化程度的假性底物如羊毛甾醇、灵芝醇B等[52]。
6) cyp5139g1
Wang等[53]以产生HLDOA的酵母为新起点,系统筛选了可能参与灵芝酸生物合成的候选cyp450基因,鉴定了一个功能性基因cyp5139g1,并对其生物合成产物进行了纯化和鉴定,最终cyp5139g1被确定负责HLDOA的C-28氧化,导致工程酵母形成1个新的灵芝酸3, 28-dihydroxy- lanosta-8, 24-dien-26-oic acid (DHLDOA)。
7) cyp512v2
姜露熙等[54]研究分析了不同条件下14个与类固醇结合的P450基因表达量和灵芝酸T积累量的关系,研究发现cyp512v2基因的表达量与灵芝酸T的积累量呈正相关,将cyp512v2基因沉默效率较高的3株菌与野生型菌株比较,灵芝酸T含量分别降低了13%、69%、66%,结果表明cyp512v2基因可能参与了灵芝三萜类物质的生物合成且可能在灵芝酸T的生物合成过程中起着重要的作用。
1.2.2 其他调控灵芝三萜合成的酶(基因)利用基因沉默灵芝相关酶(基因)来提高灵芝三萜类物质生物合成是重要的遗传操作手段。赵明文等[20]通过沉默灵芝菌丝体中灵芝转录因子skn7基因来增加灵芝三萜类物质的生物合成量,抑制灵芝菌丝的生长;结果显示,2个skn7沉默菌株中的三萜类物质含量分别比对照菌株的三萜类物质含量高60%和55%,研究还发现skn7基因功能的缺失,可以通过提高胞内活性氧的水平来提高灵芝三萜类物质的生物合成。该团队还成功构建了1个利用RNA干扰技术沉默硫化氢合酶基因cbs的菌株,并通过沉默该菌株来提高灵芝三萜类物质的生物合成量,结果显示,灵芝三萜类物质的含量在cbs基因沉默后明显增加,与对照菌株相比,2个cbs沉默菌株中的三萜含量分别增加了1.65倍和1.64倍;同时与野生菌株相比,三萜类物质合成途径的中间代谢产物羊毛甾醇和鲨烯也有不同程度的增加,分别提高了约1.4倍和1.9倍,而且发现cbs基因功能的缺失可以通过降低胞内硫化氢的水平来提高灵芝三萜类物质的生物合成[46]。随后该团队通过沉默灵芝lag2和lag3基因,研究了神经酰胺合成酶基因对调控灵芝三萜类物质合成的影响,结果显示,与对照菌株相比,lag23i‑4和lag23i‑5沉默菌株中的三萜含量高1.6倍和1.7倍,共同沉默后能够显著提高灵芝三萜类物质的含量[61]。
目前发现78个CYP450可能参与到灵芝酸骨架结构修饰中,但是仅阐明几种基因参与下游途径,其余CYP450s的作用机制仍不清晰。通过基因工程手段对重要节点的酶基因进行过表达或抑制,可以将胞内代谢流导向灵芝酸的合成代谢分支,直接有效达到目标产物产量积累的目的[25]。
2 灵芝三萜类物质液态发酵生物合成的影响因素灵芝的液态发酵是一个耗氧的过程,灵芝的菌丝体生长和三萜类物质的生物合成都需要氧的参与,不同的液态发酵方式中摇瓶的振荡频率及搅拌速度等都与溶解氧密切相关,溶解氧这个发酵参数对发酵方式起着重要的纽带作用,液态发酵方式的不同都直接或间接影响着溶解氧的供应,不同的液态发酵方式如表 3所示,文中所提及的灵芝菌株均保藏于中国普通微生物菌种保藏管理中心(CCGMC),均属赤芝。通过溶解氧的控制可以增加三萜类物质的产量,如利用氧限制诱导灵芝细胞通过转录诱导其生物合成基因等。控制溶解氧的含量会引起灵芝菌丝体生物量和三萜含量的变化,因此,溶解氧对液态发酵中灵芝三萜类物质的合成至关重要,而灵芝液态发酵中溶解氧的控制主要通过培养方式、发酵参数的控制等方式加以调控。
| 液态培养方式 Liquid culture mode |
培养条件 Condition of culture |
灵芝三萜类物质产量 Yield of triterpenes |
参考文献 References |
| 振荡静置两阶段培养 A two-stage fermentation process by combining conventional shake-flask fermentation with static culture |
先振荡培养4 d后再静置培养12 d Shake culture for 4 d and then static culture for 12 d |
582.00 mg/L | [62] |
| 液体浅层静置培养方式(LSSC) Liquid superficial-static culture |
初始培养体积2 mL,接种量7.0 g (菌体湿重/L),在48 h补加2 mL培养液,发酵7 d Initial medium volume 2 mL, inoculum size 7.0 g/L, adding medium 2 mL in 48 h and fermentative duration 7 d |
(65.91±0.84) mg/g | [63] |
| 补料分批发酵 Fed-batch fermentation |
采用多层静态生物反应器,初始体积氧传递系数为2.1 h‒1,液面面积为0.90 cm2/mL A multilayer static bioreactor with initial volumetric oxygen transfer coefficient of 2.1 h‒1 and liquid surface area of 0.90 cm2/mL was used |
(976.00±35.00) mg/L | [64-66] |
| pH-shift,DOT-shift结合分批发酵 pH-shift and DOT-shift integrated fed-batch fermentation process |
pH值为3.0培养4 d、pH值为4.5培养6 d后,继续在溶解氧张力为25%和10%时分别培养6 d After 4 d of culture at pH 3.0 and 6 d of culture at pH 4.5, they were cultured for 6d at dissolved oxygen tensions of 25% and 10%, respectively |
754.60 mg/L | [67] |
| 3段式光照液体培养 Three-stage light irradiation strategy in the submerged fermentation |
第1阶段为2 d黑暗培养,第2阶段为后续培养6 d的0.94 W/m2白光照射培养,第3阶段为4.70 W/m2白光照射培养 The first stage was 2 d dark incubation, the second stage was 0.94 W/m2 white light irradiation for 6 d, and the third stage was 4.70 W/m2 white light irradiation |
(466.30±24.10) mg/L | [68] |
| 低强度超声辅助液态发酵 Low intensity ultrasound assisted liquid fermentation |
接种后96 h超声处理,超声频率为(28±2) kHz,超声功率密度为15 W/L,处理两次,每次时间15 min Ultrasonic treatment was performed at 96 h after inoculation. The ultrasonic frequency was (28±2) kHz and the ultrasonic power density was 15 W/L. The treatment was performed twice and each time was 15 min |
193.95 mg/L | [69] |
液态发酵生产灵芝三萜类物质受到多种因素的影响,不同的发酵控制条件、补料方式等都影响着灵芝三萜类物质的产量。Fang等[62]基于限氧对赤霉素特定生物合成的有利影响,将常规摇瓶发酵(即第1阶段培养)与静态培养(即第2阶段培养)相结合,开发了两阶段发酵工艺,前4天振荡培养后的灵芝再静置培养12 d,与振荡培养16 d相比,灵芝酸产量从1.36 mg/(100 mg-DW)提高到3.19 mg/(100 mg-DW),高效提高了灵芝酸的产量。王琼等[63]利用液体浅层静置培养方式(liquid superficial-static culture, LSSC)来提高灵芝三萜类物质的产量,结果表明,最佳反应条件为在T25细胞培养瓶中初始培养体积2 mL、接种量7.0 g (菌体湿重/L),以及在48 h时补加2 mL培养液;发酵7 d后三萜产量比摇瓶培养的最高产量高2.09倍,可达(32.95±0.51) mg/g;经不锈钢平盘放大研究发现,三萜最高产量是摇瓶培养的4.19倍,可达(65.91±0.84) mg/g。与深层液体发酵相比,液体浅层静置培养生长周期短、三萜类物质产量高,而且在发酵过程不需要搅拌摇匀,为灵芝三萜类物质的工业化应用提供了前景[63]。
Tang等[64]采用补料分批发酵的策略在反应器中提高了有效代谢物的产量,在混合生物反应器和烧瓶中灵芝产量分别为(367.1±17.4) mg/L和(297.9±13.7) mg/L。此外该团队还研究了液体深层培养中氧供应对发酵的影响[65],发现低氧浓度有利于灵芝酸的生产,并实现了在生物反应器规模的放大[66],灵芝酸含量为(4.96±0.13) mg/(100 mg-DW),总赤霉素产量为(976.00±35.00) mg/L。后来该团队又采用pH-shift和DOT-shift结合分批发酵策略研究发现,在pH值为3.0时培养4 d、pH值为4.5培养6 d后,继续25%和10%的溶解氧张力下分别培养6 d的条件,结果表明此条件能显著协同增强灵芝酸的产量,达到754.60 mg/L[67]。
Zhang等[68]提出了3段式光照射灵芝深层发酵的方法,最佳策略为第1阶段为2 d黑暗培养;第2阶段为后续培养6 d的0.94 W/m2白光照射培养,第3阶段为4.70 W/m2白光照射培养,直至发酵结束,其最大灵芝酸产量为(466.30±24.10) mg/L,这为灵芝的高效生产提供了新的途径。
Sun等[69]在灵芝液态发酵过程中使用超声处理,发现在最优超声条件下,菌丝生物量和三萜类物质产量分别为15.54 g/L和193.95 mg/L,分别提高了26.99%和33.62%。超声处理改变了灵芝菌丝体结构,提高了细胞内钙浓度,加快了细胞膜通透性,促进了细胞内ROS的积累,可促进灵芝菌丝体的生长和代谢。
2.2 基于发酵参数调节的溶解氧控制对灵芝三萜类物质生物合成的影响溶解氧的变化直接反映或影响灵芝的菌丝体生长、基质消耗,并最终影响灵芝三萜类物质的合成。溶解氧过低,不利于菌体生长和代谢产物的积累;而溶解氧过高只促进菌体大量生长,抑制代谢产物的积累[70]。在灵芝的两阶段培养中,Tang等[66]发现体系中相对溶氧保持25%时菌丝体生物量达最高,有利于灵芝菌丝体的生长;溶氧保持在10%时三萜产量最高,有利于灵芝酸合成。因此,进行正确适宜的供氧,以及选择合适的参数控制是灵芝菌丝体液态深层发酵高产灵芝三萜类物质的关键[66],不同发酵参数调节的溶氧控制对灵芝三萜类物质生物合成的影响如表 4所示,其中所选用的灵芝均为赤芝。
| 发酵参数 Fermentation parameters |
发酵参数控制 Fermentation parameter control |
灵芝三萜类物质产量 Yield of triterpenes |
参考文献 References |
| 通气量 Rate of gas flow |
在10 L发酵罐中,最佳通气量为0.4 L/(L·min) In 10 L fermentor, the best ventilation is 0.4 L/(L·min) |
171.26 mg/L | [70] |
| 在5 L发酵罐中,通气量最佳为8 L/min In a 5 L fermenter, the best ventilation is 8 L/min |
204.00 mg/L | [71] | |
| 转速 Revolution speed |
分批发酵中采用较低的剪切力(Vtip=0.51 m/s) | 306.00 mg/L | [72] |
| 采用搅拌转速控制策略,低剪切力(Vtip范围在0.154–1.234 m/s) Low shear force (Vtip=0.51 m/s) for batch fermentation, low shear force with agitation speed control strategy (Vtip range 0.154–1.234 m/s) |
798.00 mg/L | [73] | |
| 采用两阶段搅拌速度调控策略,在第40小时将搅拌速度控制在150 r/min,随后控制在100 r/min Using a two-stage stirring speed control strategy, the stirring speed is controlled at 150 r/min at 40 h and then at 100 r/min |
6.07 mg/g | [74] | |
| 采用变转速调控策略,振荡阶段最佳条件为转速由150 r/min变为100 r/min Using variable speed control strategy, the best condition for the oscillation stage is the speed from 150 r/min to 100 r/min |
58.65 mg/g | [75] | |
| 氧载体 Oxygen carrier |
在灵芝菌丝体液态深层发酵的25.63 h加29.85 mL/L的正十二烷 Adding 29.85 mL/L n-dodecane in 25.63 h of liquid submerged fermentation of Ganoderma lucidum mycelium |
840.00 mg/L | [76] |
孙金旭[70]利用正交实验,将灵芝在10 L发酵罐中进行发酵和培养,结果发现溶解氧明显影响着灵芝发酵产生灵芝酸,相较于低通气量,高通气量有利于缩短发酵时间,菌体和灵芝酸达到最大产量的时间缩短12 h;菌体和灵芝酸在适宜的通气量0.4 L/(L·min)下,最大产量分别为8.27 g/L和171.26 mg/L。冯杰等[71]将灵芝菌丝体液态发酵合成灵芝三萜类物质扩大到5 L发酵罐中,研究了不同通气量即4、6、8和10 L/min对灵芝三萜类物质合成的影响,结果表明在8、10 L/min通气量时菌体生长的迟滞期缩短,快速进入稳定期且三萜酸的合成速率明显提高;同时,菌丝体灵芝三萜类物质得率和生产强度在通气量为8 L/min时最高,分别为0.204 g/L和0.001 31 g/(L·h),菌丝体最大得率达到8.77 g/L。
在发酵中确保溶解氧浓度的直接手段是控制通气量,合适的通气量能够为灵芝生长提供足够的氧气,还能影响菌丝体代谢过程中各种关键酶的活性[77]。通气量在灵芝液体发酵过程中主要起着混合和调节溶氧的作用,间接影响菌丝球的大小和球内氧气、底物的消耗,同时也直接影响灵芝三萜类物质的合成。由于灵芝菌丝体对通气量很敏感,通气量过度或不足都会引起菌丝体积、菌丝形态和灵芝三萜类物质合成的某些变化[71]。因此,为了保证稳定而合适的溶氧环境,在灵芝液态发酵过程中必须保证稳定合适的通气量[78]。
2.2.2 转速通过改变搅拌速度可以改变供氧条件,使菌丝保持在最佳的溶解氧含量,并使菌丝悬浮起来[16]。在液体深层发酵中,过低的搅拌速度会导致菌丝团较大,供氧不足,菌丝生长停滞,其生物活性物质积累下降;而过高的搅拌速度会破坏菌丝体的正常生长,对其生长和生物活性物质产生不利影响,因此,适宜的搅拌速度显得十分重要[79]。
Gong等[72]发现在灵芝细胞分批发酵中,相对较低的剪切力(Vtip=0.51 m/s)有利于灵芝细胞生长和灵芝酸生物合成,细胞量和灵芝酸产量分别达到了13.8 g/L和306 mg/L,比高剪切力(Vtip=1.53 m/s)培养提高了30%和12%。张伟[73]研究了在搅拌转速控制策略下,剪切力对pH-shift、DOT-shift和补料策略同时使用时灵芝细胞培养过程的影响,研究发现,与高剪切力培养组相比,低剪切力促进了灵芝酸含量的提高,灵芝酸含量和产量分别为3.53 mg/(100 mg-DW)和798.00 mg/L,比高剪切力(Vtip)培养组提高了85%和276%。
在灵芝发酵过程中,菌丝体生长和生产三萜所需要的最佳搅拌速度不同,传统的恒速搅拌已不能满足生产灵芝三萜类的需要。Feng等[74]采用了两阶段搅拌速度的调控策略,在第40小时,将搅拌速度控制在150 r/min,随后将搅拌速度控制在100 r/min,采用此方法使三萜类物质含量达到6.07 mg/g,提高了36.48%,同时还大大缩短了发酵时间,节约了成本且可重复。
赵娜等[75]采用变转速调控结合液体静置培养策略来优化振荡发酵阶段,以获得高的三萜类物质产量,研究发现转速由150 r/min变为100 r/min是振荡阶段的最佳条件,最佳条件下菌丝体中的三萜类物质含量与优化前相比增加了21%,达到58.65 mg/g。这是由于降低转速减少了体系中溶氧量,使得体系各参数更利于菌丝体的生长,为后期液体静置阶段奠定生物量基础,从而促进菌丝体内灵芝三萜类物质积累[80]。
2.2.3 氧载体氧载体与发酵液形成的体系在保持能耗的前提下可以提高氧传递效率,具有氧传递速度快、能耗低、气泡生成少、剪切力小等特点[76]。冯杰等[76]在灵芝液态发酵培养基中添加具有正铺展系数的氧载体正十二烷,正十二烷加入到水中后,会在搅拌、超声波等作用下被分散和乳化,在和水的相互排斥作用下集中在气液界面,形成覆盖在气泡上的薄膜。氧载体的溶解度与氧气相比较高,增加了氧穿过水边界层的渗透力,有利于氧传递的进行[81]。优化结果发现,在灵芝菌丝体液态深层发酵的25.63 h加入29.85 mL/L的正十二烷可显著提高灵芝三萜的浓度,理论值为0.84 g/L,之后又将该方法在500 mL摇瓶和5 L发酵罐中进行验证,得到灵芝三萜类物质的浓度分别为0.85 g/L和0.88 g/L,与对照组相比分别提高了578% 和398%[76]。
3 展望利用液态发酵技术获取灵芝三萜类物质具有生产周期短、含量相对稳定、易定向调控等特点,是获取灵芝三萜类物质最有效的方法之一。目前灵芝液态发酵获取三萜类物质的研究主要集中在灵芝三萜类物质生物合成的代谢途径、液态发酵方式、基于发酵参数调节的溶解氧控制这3个方面对灵芝三萜类物质的影响。溶解氧会影响细胞生长和代谢物的形成,适宜的溶解氧会有利于灵芝的生长,目前调控溶解氧的方式主要通过参数的调节,但是溶解氧影响灵芝三萜类物质生物合成的机理尚不清楚。而且由于缺少成熟的灵芝真菌细胞基因操作手段,以及对灵芝三萜类物质生物合成途径相关基因的认知匮乏[82-83],下游途径还未完全阐明,通过基因工程改造灵芝真菌实现灵芝三萜类物质产量的大幅提高也具有极大的挑战和困难[22]。通过这几个关键因素的调节虽然可以有效提高灵芝三萜类物质的产量,但是仍不能满足市场的需求,并且现有的研究范围太局限,过于集中在这几个因素上,未考虑其他新的因素,限制了灵芝三萜类物质的应用。
结合国内外研究进展,我们认为灵芝三萜类物质液态发酵合成的研究(均是发酵中运用最多的赤芝)需要进一步加强几个方面的工作:(1) 运用基因工程的手段阐明灵芝三萜类物质生物合成下游的具体途径,完全解析灵芝三萜类物质的合成代谢途径,以及挖掘信号转导途径的深层作用机制仍是未来研究的重点方向。在目前已知的灵芝三萜类物质生物合成途径的基础上,更好地运用液态发酵的手段进行改造和调控,提高灵芝三萜类物质的产量。(2) 对于溶解氧这个发酵参数的控制不仅需要在发酵工艺的基础上寻找更好的参数调节方式,而且需要寻找更好的表征绝对溶氧的检测方法,或者从分子水平(如控氧基因)调控从而进一步控制溶解氧来控制三萜类物质的产量。(3) 通过培养基优化、代谢调控、参数优化、添加外源物质等方法找到更好的液态发酵方式,实现周期短、效价高的灵芝三萜类物质液态发酵,为灵芝三萜类物质商业应用的进一步扩大打下基础。
| [1] |
CAO Y, WU SH, DAI YC. Species clarification of the prize medicinal Ganoderma mushroom "Lingzhi"[J]. Fungal Diversity, 2012, 56(1): 49-62. DOI:10.1007/s13225-012-0178-5 |
| [2] |
XING JH. Species diversity, taxonomy and phylogeny of Ganoderma[D]. Beijing: Doctoral Dissertation of Beijing Forestry University, 2019 (in Chinese). 邢佳慧. 灵芝属的物种多样性、分类与系统发育研究[D]. 北京: 北京林业大学博士学位论文, 2019. |
| [3] |
WANG G, ZHAO J, LIU JW, HUANG YP, ZHONG JJ, TANG W. Enhancement of IL-2 and IFN-γ expression and NK cells activity involved in the anti-tumor effect of ganoderic acid Me in vivo[J]. International Immunopharmacology, 2007, 7(6): 864-870. DOI:10.1016/j.intimp.2007.02.006 |
| [4] |
TANG QJ, JI Z, HAO RX, LIU YF, YANG Y, ZHANG JS. Inhibition of tumor cell proliferation by a neutral triterpenoid fraction from Ganoderma lucidum[J]. Acta Edulis Fungi, 2010, 17(1): 60-64. (in Chinese) 唐庆九, 季哲, 郝瑞霞, 刘艳芳, 杨焱, 张劲松. 灵芝中性三萜类成分的抗肿瘤作用[J]. 食用菌学报, 2010, 17(1): 60-64. DOI:10.3969/j.issn.1005-9873.2010.01.011 |
| [5] |
WANG MY, LIU Q, CHE QM, LIN ZB. Effects of triterpenoids from Ganoderma lucidum (leyss. ex fr.) Karst on three different experimental liver injury models in mice[J]. Acta Pharmaceutica Sinica, 2000, 35(5): 326-329. (in Chinese) 王明宇, 刘强, 车庆明, 林志彬. 灵芝三萜类化合物对3种小鼠肝损伤模型的影响[J]. 药学学报, 2000, 35(5): 326-329. DOI:10.3321/j.issn:0513-4870.2000.05.002 |
| [6] |
PENG ZH, HAN BY, ZHAO SL, CHEN CY. Research anti-HIV triterpenoid components[J]. Natural Product Research and Development, 2009, 21(B05): 258-262, 143. (in Chinese) 彭珍华, 韩本勇, 赵声兰, 陈朝银. 三萜类化合物抗HIV研究进展[J]. 天然产物研究与开发, 2009, 21(B05): 258-262, 143. |
| [7] |
YI YJ, XU CS. Experimental research on lowering the serum lipid effect of ganoderma lucidium[J]. Journal of Anhui Normal University (Natural Science Edition), 2001, 24(1): 52-53. (in Chinese) 衣艳君, 徐承水. 灵芝降血脂作用的实验研究[J]. 安徽师范大学学报(自然科学版), 2001, 24(1): 52-53. DOI:10.14182/j.cnki.1001-2443.2001.01.015 |
| [8] |
MAU JL, LIN HC, CHEN CC. Antioxidant properties of several medicinal mushrooms[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6072-6077. DOI:10.1021/jf0201273 |
| [9] |
KOMODA Y, SHIMIZU M, SONODA Y, SATO Y. Ganoderic acid and its derivatives as cholesterol synthesis inhibitors[J]. Chemical & Pharmaceutical Bulletin, 1989, 37(2): 531-533. |
| [10] |
LIU J, SHIMIZU K, KONISHI F, NODA K, KUMAMOTO S, KURASHIKI K, KONDO R. Anti-androgenic activities of the triterpenoids fraction of Ganoderma lucidum[J]. Food Chemistry, 2007, 100(4): 1691-1696. DOI:10.1016/j.foodchem.2006.01.003 |
| [11] |
MA CG, ZHANG ZX, XIAO B, SUN SS. Bioactivity and potential application of triterpenoids from Ganoderma lucidum[J]. Edible and Medicinal Mushrooms, 2022, 30(3): 197-201. (in Chinese) 马传贵, 张志秀, 肖宝, 孙思胜. 灵芝三萜的生物活性及潜在应用研究[J]. 食药用菌, 2022, 30(3): 197-201. |
| [12] |
XIA Q, ZHANG HZ, SUN XF, ZHAO HJ, WU LF, ZHU D, YANG GH, SHAO YY, ZHANG XX, MAO X, ZHANG LZ, SHE GM. A comprehensive review of the structure elucidation and biological activity of triterpenoids from Ganoderma spp.[J]. Molecules (Basel, Switzerland), 2014, 19(11): 17478-17535. DOI:10.3390/molecules191117478 |
| [13] |
JIANG YT. Enzyme assisted extraction and ganoderic acid A pharmacokinetic study on main active components of Ganoderma lucidum[D]. Changchun: Master's Thesis of Jilin Agricultural University, 2015 (in Chinese). 姜沅彤. 灵芝主要活性成分的生物酶辅助提取及灵芝酸A药代动力学研究[D]. 长春: 吉林农业大学硕士学位论文, 2015. |
| [14] |
CHEN H, YANG HL, LIU GQ. Biosynthesis and fermentation control of triterpenoids from Ganoderma lingzhi[J]. Mycosystema, 2015, 34(1): 1-9. (in Chinese) 陈慧, 杨海龙, 刘高强. 灵芝三萜的生物合成和发酵调控[J]. 菌物学报, 2015, 34(1): 1-9. DOI:10.13346/j.mycosystema.130185 |
| [15] |
WEI T, ZHANG CS, CHEN QH, ZHOU YP, TIAN CE. Liquid fermentation of Ganoderma and application of its products[J]. Microbiology China, 2022, 49(1): 336-351. (in Chinese) 魏滔, 张长生, 陈琼华, 周玉萍, 田长恩. 灵芝真菌液体发酵及其产物应用的研究进展[J]. 微生物学通报, 2022, 49(1): 336-351. DOI:10.13344/j.microbiol.china.210404 |
| [16] |
ZHAO Y. Submerged fermentation of key medicinal components, triterpene acids from Ganoderma lucidum[D]. Changsha: Master's Thesis of Central South University of Forestry & Technology, 2011 (in Chinese). 赵艳. 灵芝关键成分三萜酸的深层发酵技术研究[D]. 长沙: 中南林业科技大学硕士学位论文, 2011. |
| [17] |
ZHOU XW, SU KQ, ZHANG YM. Applied modern biotechnology for cultivation of Ganoderma and development of their products[J]. Applied Microbiology and Biotechnology, 2012, 93(3): 941-963. DOI:10.1007/s00253-011-3780-7 |
| [18] |
WEI ZH, LIU LL, GUO XF, LI YJ, HOU BC, FAN QL, WANG KX, LUO YD, ZHONG JJ. Sucrose fed-batch strategy enhanced biomass, polysaccharide, and ganoderic acids production in fermentation of Ganoderma lucidum 5.26[J]. Bioprocess and Biosystems Engineering, 2016, 39(1): 37-44. DOI:10.1007/s00449-015-1480-x |
| [19] |
FENG J, ZHANG JS, FENG N, YAN MQ, YANG Y, JIA W, LIN CC. A novel Ganoderma lucidum G0119 fermentation strategy for enhanced triterpenes production by statistical process optimization and addition of oleic acid[J]. Engineering in Life Sciences, 2016, 17(4): 430-439. |
| [20] |
ZHAO MW, WANG SL, ZHU J, REN A, SHI L, YU HS, ZHAO TR. Application of Ganoderma lucidum transcription factor SKN7 gene in regulating Ganoderma triterpene biosynthesis: CN107603987A[P]. 2020-06-09 (in Chinese). 赵明文, 王胜利, 朱静, 任昂, 师亮, 于汉寿, 赵添润. 灵芝转录因子SKN7基因在调控灵芝三萜生物合成中的应用: CN107603987A[P]. 2020-06-09. |
| [21] |
XIAO H, WANG WF, ZHONG JJ. Method for heterologous biosynthesis of ganoderic acid through synthetic biological means: CN108929884A[P]. 2021-07-16 (in Chinese). 肖晗, 王文方, 钟建江. 通过合成生物学手段异源生物合成灵芝酸的方法: CN108929884A[P]. 2021-07-16. |
| [22] |
MENG W, HAN X, WEI Y. Cytochrome P450 enzyme and application thereof in synthesis of Ganoderma lucidum triterpenoids: CN113444737A[P]. 2021-09-28 (in Chinese). 王猛, 肖晗, 袁伟. 细胞色素P450酶及其在合成灵芝三萜类化合物中的应用: CN113444737A[P]. 2021-09-28. |
| [23] |
BABY S, JOHNSON AJ, GOVINDAN B. Secondary metabolites from Ganoderma[J]. Phytochemistry, 2015, 114: 66-101. DOI:10.1016/j.phytochem.2015.03.010 |
| [24] |
XU R, FAZIO GC, MATSUDA SPT. On the origins of triterpenoid skeletal diversity[J]. Phytochemistry, 2004, 65(3): 261-291. DOI:10.1016/j.phytochem.2003.11.014 |
| [25] |
YUAN K, HE W, YANG YL, ZHU WY, PENG C, AN T, LI L, ZHOU WQ. Research progress on biosynthesis and metabolic regulation of ganoderic acids[J]. Biotechnology Bulletin, 2021, 37(8): 46-54. (in Chinese) 袁恺, 何伟, 杨云丽, 朱威宇, 彭超, 安泰, 李丽, 周卫强. 灵芝酸生物合成及代谢调控研究进展[J]. 生物技术通报, 2021, 37(8): 46-54. DOI:10.13560/j.cnki.biotech.bull.1985.2021-0734 |
| [26] |
ROHMER M. The discovery of a mevalonate- independent pathway for isoprenoid biosynthesis in bacteria, algae and higher plants[J]. Natural Product Reports, 1999, 16(5): 565-574. DOI:10.1039/a709175c |
| [27] |
ROHMER M, KNANI M, SIMONIN P, SUTTER B, SAHM H. Isoprenoid biosynthesis in bacteria: a novel pathway for the early steps leading to isopentenyl diphosphate[J]. The Biochemical Journal, 1993, 295(Pt 2): 517-524. |
| [28] |
SCHWENDER J, ZEIDLER J, GRÖNER R, MÜLLER C, FOCKE M, BRAUN S, LICHTENTHALER FW, LICHTENTHALER HK. Incorporation of 1-deoxy-D-xylulose into isoprene and phytol by higher plants and algae[J]. FEBS Letters, 1997, 414(1): 129-134. DOI:10.1016/S0014-5793(97)01002-8 |
| [29] |
WANG WF, XIAO H, ZHONG JJ. Biosynthesis of a ganoderic acid in Saccharomyces cerevisiae by expressing a cytochrome P450 gene from Ganoderma lucidum[J]. Biotechnology and Bioengineering, 2018, 115(7): 1842-1854. DOI:10.1002/bit.26583 |
| [30] |
LI LP, ZHANG RR, LEI HJ, WANG XL. Advances on triterpenes of Ganoderma lingzhi production by submerged fermentation[J]. Edible and Medicinal Mushrooms, 2016, 24(5): 294-299. (in Chinese) 黎李平, 张容容, 雷含珺, 王晓玲. 灵芝三萜液体发酵技术研究进展[J]. 食药用菌, 2016, 24(5): 294-299. |
| [31] |
SHIAO MS. Natural products of the medicinal fungus Ganoderma lucidum: occurrence, biological activities, and pharmacological functions[J]. Chemical Record (New York, N Y), 2003, 3(3): 172-180. |
| [32] |
HIROTANI M, ASAKA I, FURUYA T. Investigation of the biosynthesis of 3α-hydroxy triterpenoids, ganoderic acids T and S, by application of a feeding experiment using[1, 2-13C2]acetate[J]. Journal of the Chemical Society, Perkin Transactions 1, 1990(10): 2751-2754. DOI:10.1039/P19900002751 |
| [33] |
LI N, FENG J, FENG N, LIU YF, ZHANG JS. Research progress in submerged fermentation for triterpenes of Ganoderma[J]. Microbiology China, 2020, 47(10): 3451-3469. (in Chinese) 李娜, 冯杰, 冯娜, 刘艳芳, 张劲松. 灵芝液态深层发酵三萜类化合物研究进展[J]. 微生物学通报, 2020, 47(10): 3451-3469. DOI:10.13344/j.microbiol.china.191010 |
| [34] |
XU JW, ZHONG JJ. Genetic engineering of Ganoderma lucidum for the efficient production of ganoderic acids[J]. Bioengineered, 2015, 6(6): 357-360. DOI:10.1080/21655979.2015.1119341 |
| [35] |
REN A, OUYANG X, SHI L, JIANG AL, MU DS, LI MJ, HAN Q, ZHAO MW. Molecular characterization and expression analysis of GlHMGS, a gene encoding hydroxymethylglutaryl-CoA synthase from Ganoderma lucidum (Ling-Zhi) in ganoderic acid biosynthesis pathway[J]. World Journal of Microbiology and Biotechnology, 2013, 29(3): 523-531. DOI:10.1007/s11274-012-1206-z |
| [36] |
SHANG CH, ZHU F, LI N, OU-YANG X, SHI L, ZHAO MW, LI YX. Cloning and characterization of a gene encoding HMG-CoA reductase from Ganoderma lucidum and its functional identification in yeast[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(5): 1333-1339. DOI:10.1271/bbb.80011 |
| [37] |
SHI L, QIN L, XU YJ, REN A, FANG X, MU DS, TAN Q, ZHAO MW. Molecular cloning, characterization, and function analysis of a mevalonate pyrophosphate decarboxylase gene from Ganoderma lucidum[J]. Molecular Biology Reports, 2012, 39(5): 6149-6159. DOI:10.1007/s11033-011-1431-9 |
| [38] |
ZHANG DH, JIANG LX, LI N, YU XY, ZHAO P, LI T, XU JW. Overexpression of the squalene epoxidase gene alone and in combination with the 3-hydroxy-3-methylglutaryl coenzyme a gene increases ganoderic acid production in Ganoderma lingzhi[J]. Journal of Agricultural and Food Chemistry, 2017, 65(23): 4683-4690. DOI:10.1021/acs.jafc.7b00629 |
| [39] |
ZHAO MW, LIANG WQ, ZHANG DB, WANG N, WANG CG, PAN YJ. Cloning and characterization of squalene synthase (SQS) gene from Ganoderma lucidum[J]. Journal of Microbiology and Biotechnology, 2007, 17(7): 1106-1112. |
| [40] |
SHANG CH, SHI L, REN A, QIN L, ZHAO MW. Molecular cloning, characterization, and differential expression of a lanosterol synthase gene from Ganoderma lucidum[J]. Bioscience, Biotechnology, and Biochemistry, 2010, 74(5): 974-978. DOI:10.1271/bbb.90833 |
| [41] |
DING YX, OU YANG X, SHANG CH, REN A, SHI L, LI YX, ZHAO MW. Molecular cloning, characterization, and differential expression of a farnesyl-diphosphate synthase gene from the basidiomycetous fungus Ganoderma lucidum[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(6): 1571-1579. DOI:10.1271/bbb.80067 |
| [42] |
ABE I, ROHMER M, PRESTWICH GD. Enzymatic cyclization of squalene and oxidosqualene to sterols and triterpenes[J]. Chemical Reviews, 1993, 93(6): 2189-2206. DOI:10.1021/cr00022a009 |
| [43] |
CHEN SY. The pharmacological effects of triterpenoids from Ganoderma lucidum and the regulation of its biosynthesis[J]. Advances in Biological Chemistry, 2020, 10(2): 55-65. DOI:10.4236/abc.2020.102005 |
| [44] |
SHI L, REN A, MU DS, ZHAO MW. Current progress in the study on biosynthesis and regulation of ganoderic acids[J]. Applied Microbiology and Biotechnology, 2010, 88(6): 1243-1251. DOI:10.1007/s00253-010-2871-1 |
| [45] |
SONG X, XIAO H, LUO SW, WANG XZ, WANG WF, LIN SJ. Biosynthesis of squalene-type triterpenoids in Saccharomyces cerevisiae by expression of CYP505D13 from Ganoderma lucidum[J]. Bioresources and Bioprocessing, 2019, 6(1): 19. DOI:10.1186/s40643-019-0256-6 |
| [46] |
FANG X. Cloning and overexpression of sterol 14α- demethylase gene from Ganoderma lucidum and its effect on triterpene synthesis[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2011 (in Chinese). 方星. 灵芝甾醇14α-脱甲基酶基因的克隆及超量表达对三萜合成的影响[D]. 南京: 南京农业大学硕士学位论文, 2011. |
| [47] |
TAN Y, TANG CH, FENG J, FENG N, WU YY, BAO DP, YANG Y, ZHANG JS. Current progress in the study on biosynthesis and regulation of Ganoderma triterpenoids[J]. Acta Edulis Fungi, 2019, 26(3): 125-140. (in Chinese) 谭贻, 唐传红, 冯杰, 冯娜, 吴莹莹, 鲍大鹏, 杨焱, 张劲松. 灵芝三萜生物合成及调控研究进展[J]. 食用菌学报, 2019, 26(3): 125-140. DOI:10.16488/j.cnki.1005-9873.2019.03.016 |
| [48] |
BERGÈS T, GUYONNET D, KARST F. The Saccharomyces cerevisiae mevalonate diphosphate decarboxylase is essential for viability, and a single Leu-to-Pro mutation in a conserved sequence leads to thermosensitivity[J]. Journal of Bacteriology, 1997, 179(15): 4664-4670. DOI:10.1128/jb.179.15.4664-4670.1997 |
| [49] |
LAN XT. Study on efficient bioproduction and secretion of anti-tumor ganoderic acid3-hydroxy- lanosta-8, 24-dien-26 oic acid (gahldoa) by Saccharomyces cerevisiae[D]. Shanghai: Master's Thesis of Shanghai Jiao Tong University, 2020 (in Chinese). 兰晓婷. 酿酒酵母高效生产及分泌抗肿瘤灵芝酸3-hydroxy-lanosta-8, 24-dien-26 oic acid (GA-HLDOA)的研究[D]. 上海: 上海交通大学硕士学位论文, 2020. |
| [50] |
SHIAO MS. Triterpenoid natural products in the fungus Ganoderma lucidum[J]. Journal of the Chinese Chemical Society, 1992, 39(6): 669-674. DOI:10.1002/jccs.199200102 |
| [51] |
CHEN SL, XU J, LIU C, ZHU YJ, NELSON DR, ZHOU SG, LI CF, WANG LZ, GUO X, SUN YZ, LUO HM, LI Y, SONG JY, HENRISSAT B, LEVASSEUR A, QIAN J, LI JQ, LUO X, SHI LC, HE L, et al. Genome sequence of the model medicinal mushroom Ganoderma lucidum[J]. Nature Communications, 2012, 3: 913. DOI:10.1038/ncomms1923 |
| [52] |
YANG CS, LI WC, LI C, ZHOU ZH, XIAO YL, YAN X. Metabolism of ganoderic acids by a Ganoderma lucidum cytochrome P450 and the 3-keto sterol reductase ERG27 from yeast[J]. Phytochemistry, 2018, 155: 83-92. DOI:10.1016/j.phytochem.2018.07.009 |
| [53] |
WANG WF, XIAO H, ZHONG JJ. Biosynthesis of a novel ganoderic acid by expressing CYP genes from Ganoderma lucidum in Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2022, 106(2): 523-534. DOI:10.1007/s00253-021-11717-w |
| [54] |
JIANG LX, WANG JJ, LI N, XU JW. Identification and analysis of candidate cytochrome P450 genes involved in the biosynthesis of ganoderic acid in Ganoderma lingzhi[J]. Acta Edulis Fungi, 2018, 25(2): 35-41. (in Chinese) 姜露熙, 王俊杰, 李娜, 徐军伟. 与灵芝酸生物合成相关的细胞色素P450基因的筛选与分析[J]. 食用菌学报, 2018, 25(2): 35-41. |
| [55] |
LIANG CX. Enhanced production of ganoderic acids in static liquid culture of Ganoderma lucidum by addition of small molecules and a preliminary study on their acting mechanism[D]. Shanghai: Master's Thesis of Shanghai Jiao Tong University, 2010 (in Chinese). 梁翠霞. 小分子化合物添加促进灵芝酸的发酵生产及其作用机制探索[D]. 上海: 上海交通大学硕士学位论文, 2010. |
| [56] |
CAI SQ. Study on biotransformation of 3-hydroxylanosta-8, 24-Dien-26-oic acid[D]. Shanghai: Master's Thesis of Shanghai Jiao Tong University, 2020 (in Chinese). 蔡思琴. 灵芝酸3-羟基-羊毛甾-8, 24-二烯-26-酸的生物转化研究[D]. 上海: 上海交通大学硕士学位论文, 2020. |
| [57] |
CHEN WP, LEE MK, JEFCOATE C, KIM SC, CHEN FS, YU JH. Fungal cytochrome P450 monooxygenases: their distribution, structure, functions, family expansion, and evolutionary origin[J]. Genome Biology and Evolution, 2014, 6(7): 1620-1634. DOI:10.1093/gbe/evu132 |
| [58] |
YANG J, ZHAN YG, XIAO JL, YIN J. Advances in the function of cytochrome P450 in structural modifications of triterpenoid and sterol skeletons in plants[J]. Scientia Sinica (Vitae), 2018, 48(10): 1065-1083. (in Chinese) 杨杰, 詹亚光, 肖佳雷, 尹静. 细胞色素P450在植物三萜和甾醇骨架修饰中的功能研究进展[J]. 中国科学: 生命科学, 2018, 48(10): 1065-1083. |
| [59] |
CAI SQ, WANG XZ, LIN SJ, ZHONG JJ. Bioconversion of a ganoderic acid 3-hydroxy- lanosta-8, 24-Dien-26-oic acid by a crude enzyme from Ganoderma lucidum[J]. Process Biochemistry, 2020, 95: 12-16. DOI:10.1016/j.procbio.2020.05.002 |
| [60] |
LAN XT, YUAN W, WANG M, XIAO H. Efficient biosynthesis of antitumor ganoderic acid HLDOA using a dual tunable system for optimizing the expression of CYP5150L8 and a Ganoderma P450 reductase[J]. Biotechnology and Bioengineering, 2019, 116(12): 3301-3311. DOI:10.1002/bit.27154 |
| [61] |
ZHAO MW, LU XX, WANG YX, ZHU J, REN A, SHI L, YU HS. Application of ceramide synthase genes in regulating biosynthesis of ganoderma triterpenes: CN109777814A[P]. 2022-04-08 (in Chinese). 赵明文, 鲁笑笑, 王云晓, 朱静, 任昂, 师亮, 于汉寿. 神经酰胺合成酶基因在调控灵芝三萜生物合成中的应用: CN109777814A[P]. 2022-04-08. |
| [62] |
FANG QH, ZHONG JJ. Two-stage culture process for improved production of ganoderic acid by liquid fermentation of higher fungus Ganoderma lucidum[J]. Biotechnology Progress, 2002, 18(1): 51-54. DOI:10.1021/bp010136g |
| [63] |
WANG Q, XU MM, LIU GQ, CAO CL, SHI GY, DING (C/Z)Y. An efficient strategy to enhance triterpenoid production by liquid superficial-static culture (LSSC) of Ganoderma lingzhi[J]. Mycosystema, 2021, 40(3): 656-667. (in Chinese) 王琼, 徐萌萌, 刘高强, 曹春蕾, 石贵阳, 丁重阳. 灵芝液体浅层静置培养高效生产三萜的研究[J]. 菌物学报, 2021, 40(3): 656-667. |
| [64] |
TANG YJ, ZHONG JJ. Fed-batch fermentation of Ganoderma lucidum for hyperproduction of polysaccharide and ganoderic acid[J]. Enzyme and Microbial Technology, 2002, 31(1/2): 20-28. |
| [65] |
TANG YJ, ZHONG JJ. Role of oxygen supply in submerged fermentation of Ganoderma lucidum for production of Ganoderma polysaccharide and ganoderic acid[J]. Enzyme and Microbial Technology, 2003, 32(3/4): 478-484. |
| [66] |
TANG YJ, ZHONG JJ. Scale-up of a liquid static culture process for hyperproduction of ganoderic acid by the medicinal mushroom Ganoderma lucidum[J]. Biotechnology Progress, 2003, 19(6): 1842-1846. DOI:10.1021/bp0341592 |
| [67] |
TANG YJ, ZHANG W, ZHONG JJ. Performance analyses of a pH-shift and DOT-shift integrated fed-batch fermentation process for the production of ganoderic acid and Ganoderma polysaccharides by medicinal mushroom Ganoderma lucidum[J]. Bioresource Technology, 2009, 100(5): 1852-1859. DOI:10.1016/j.biortech.2008.10.005 |
| [68] |
ZHANG W, TANG YJ. A novel three-stage light irradiation strategy in the submerged fermentation of medicinal mushroom Ganoderma lucidum for the efficient production of ganoderic acid and Ganoderma polysaccharides[J]. Biotechnology Progress, 2008, 24(6): 1249-1261. DOI:10.1002/btpr.36 |
| [69] |
SUN L, LIU LP, YANG L, WANG YZ, DABBOUR M, MINTAH B, HE RH, MA HL. Effects of low‐intensity ultrasound on the biomass and metabolite of Ganoderma lucidum in liquid fermentation[J]. Journal of Food Process Engineering, 2020, e13601. |
| [70] |
SUN JX. Effect of dissolved oxygen controlling conditions on production of ganoderic acids by Ganoderma[J]. Northern Horticulture, 2014(5): 130-132. (in Chinese) 孙金旭. 溶氧控制条件对深层灵芝发酵生产灵芝酸产量的影响[J]. 北方园艺, 2014(5): 130-132. |
| [71] |
FENG J, FENG N, YANG Y, LIU F, JIA W, ZHANG JS. Effects of aeration rate on the production of triterpenes by Ganoderma lucidum G0119 in liquid submerged fermentation[J]. Natural Product Research and Development, 2015, 27(9): 1564-1570. (in Chinese) 冯杰, 冯娜, 杨焱, 刘方, 贾薇, 张劲松. 通气量对灵芝菌丝体液态深层发酵合成灵芝三萜的影响[J]. 天然产物研究与开发, 2015, 27(9): 1564-1570. |
| [72] |
GONG HG, ZHONG JJ. Hydrodynamic shear stress affects cell growth and metabolite production by medicinal mushroom Ganoderma lucidum[J]. Chinese Journal of Chemical Engineering, 2005, 13(3): 426-428. |
| [73] |
ZHANG W. Multi-stage fermentation of medicinal mushroom Ganoderma lucidum for hyperproduction of ganoderic acid and Ganoderma polysaccharides[D]. Wuhan: Master's Thesis of Hubei University of Technology, 2008 (in Chinese). 张伟. 灵芝细胞多阶段培养高效生产灵芝酸和灵芝多糖[D]. 武汉: 湖北工业大学硕士学位论文, 2008. |
| [74] |
FENG J, FENG N, YANG Y, LIU F, ZHANG JS, JIA W, LIN CC. Simple and reproducible two-stage agitation speed control strategy for enhanced triterpene production by Lingzhi or reishi medicinal mushrooms, Ganoderma lucidum ACCC G0119 (higher basidiomycetes) based on submerged liquid fermentation[J]. International Journal of Medicinal Mushrooms, 2015, 17(12): 1151-1159. |
| [75] |
ZHAO N, JIA W, FENG J, FENG N, TANG CH, LIU YF, YANG Y, TANG QJ, ZHANG JS. Enhancement of ganoderic acid production in the two-stage fermentation by using variable speed control strategy[J]. Mycosystema, 2015, 34(1): 131-138. (in Chinese) 赵娜, 贾薇, 冯杰, 冯娜, 唐传红, 刘艳芳, 杨焱, 唐庆九, 张劲松. 变转速策略调控灵芝菌丝体发酵高产三萜[J]. 菌物学报, 2015, 34(1): 131-138. |
| [76] |
FENG J, FENG N, TANG QJ, YANG Y, LIU F, ZHANG JS. Effect of the oxygen vector n-dodecane on triterpene production in submerged cultures of Ganoderma lucidum[J]. Acta Edulis Fungi, 2016, 23(2): 52-58. (in Chinese) 冯杰, 冯娜, 唐庆九, 杨焱, 刘方, 张劲松. 氧载体正十二烷对灵芝三萜液态深层发酵的影响[J]. 食用菌学报, 2016, 23(2): 52-58. |
| [77] |
ZHAI SX, FENG J, FENG N, TANG QJ, ZHOU S, YANG Y, LIU YF, ZHANG JS. Research progress on Ganoderma triterpenes obtained by liquid submerged fermentation[J]. Journal of Agriculture, 2018, 8(1): 118-124. (in Chinese) 翟双星, 冯杰, 冯娜, 唐庆九, 周帅, 杨焱, 刘艳芳, 张劲松. 灵芝三萜液态深层发酵的研究进展[J]. 农学学报, 2018, 8(1): 118-124. |
| [78] |
WANG XL, DING ZY, ZHAO Y, LIU GQ, ZHOU GY. Efficient accumulation and in vitro antitumor activities of triterpene acids from submerged batch: cultured Lingzhi or reishi medicinal mushroom, Ganoderma lucidum (Agaricomycetes)[J]. International Journal of Medicinal Mushrooms, 2017, 19(5): 419-431. |
| [79] |
CHU XY, ZHANG RJ. Liquid submerged fermentation technology of Ganoderma lucidum[J]. Feed Industry, 2005, 26(8): 21-23. (in Chinese) 鉏晓艳, 张日俊. 灵芝真菌的液体深层发酵技术[J]. 饲料工业, 2005, 26(8): 21-23. |
| [80] |
LI L, YANG YL, YANG XF, HE W, YUAN K, ZHU WY, PENG C, HE YF, DONG YM, ZHOU WQ. Advances on process regulation of Ganoderma triterpene acids production by liquid fermentation[J]. Food and Fermentation Industries, 2021, 47(8): 304-312. (in Chinese) 李丽, 杨云丽, 杨小凡, 何伟, 袁恺, 朱威宇, 彭超, 何一凡, 董银卯, 周卫强. 液体发酵生产灵芝三萜酸的过程调控研究进展[J]. 食品与发酵工业, 2021, 47(8): 304-312. |
| [81] |
JAMSHIDI AM, SOHRABI M, VAHABZADEH F, BONAKDARPOUR B. Studies on the hydrodynamic behavior and mass transfer in a down-flow jet loop reactor with a coaxial draft tube[J]. Journal of Chemical Technology & Biotechnology, 2001, 76(1): 39-46. |
| [82] |
XIAO H, ZHONG JJ. Production of useful terpenoids by higher-fungus cell factory and synthetic biology approaches[J]. Trends in Biotechnology, 2016, 34(3): 242-255. |
| [83] |
XIAO H, ZHANG Y, WANG M. Discovery and engineering of cytochrome P450s for terpenoid biosynthesis[J]. Trends in Biotechnology, 2019, 37(6): 618-631. |
 2023, Vol. 50
2023, Vol. 50

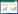


 ,
,