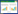扩展功能
文章信息
- 李彗菊, 李凌燕, 梁红, 高大文, 东秀珠
- LI Huiju, LI Lingyan, LIANG Hong, GAO Dawen, DONG Xiuzhu
- 扎龙盐碱湿地芦苇根际土的优势产甲烷途径分析
- Predominant methanogenic pathway in the rhizosphere soil of reed in saline-alkaline Zhalong wetland
- 微生物学通报, 2023, 50(4): 1511-1524
- Microbiology China, 2023, 50(4): 1511-1524
- DOI: 10.13344/j.microbiol.china.221166
-
文章历史
- 收稿日期: 2022-11-29
- 接受日期: 2023-01-20
- 网络首发日期: 2023-02-20
2. 北京建筑大学北京节能减排与城乡可持续发展省部共建国家协同创新中心, 北京 100044;
3. 中国科学院微生物研究所 微生物资源前期开发国家重点实验室, 北京 100101;
4. 中国科学院大学生命科学学院, 北京 100049
2. Beijing Energy Conservation & Sustainable Urban and Rural Development Provincial and Ministry Co-construction Collaboration Innovation Center, Beijing University of Civil Engineering and Architecture, Beijing 100044, China;
3. State Key Laboratory of Microbial Resources, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
4. College of Life Sciences, University of Chinese Academy of Sciences, Beijing 100049, China
甲烷(CH4)贡献了约25%的温室效应[1]。尽管大气中CH4的含量比CO2低许多,但其温室效应是CO2的28倍,而且在大气中的寿命只有12年,比CO2 (300–1 000年)短很多,因此,控制CH4排放被认为是控制全球变暖最快和最有效的措施之一[2]。天然湿地虽然仅占陆地面积的5%–8%,但储藏了陆地20%–30%的碳,是甲烷的主要排放源之一[3]。随着全球变暖,陆地碳有可能成为重要的碳源。湿地的甲烷年排放量估计为100−200 Tg,相当于全球排放总量的20%[4]。
位于黑龙江省西部乌裕尔河下游的扎龙国家级自然保护区的扎龙湿地是典型的内陆盐碱湿地,面积21万hm2,也是世界上最大的芦苇湿地[5]。扎龙盐碱湿地芦苇根际土的pH值为8.34–8.58[6]。通常认为中性和碱性湿地的CH4排放通量显著高于酸性土壤的湿地,如土壤pH值为7.7的碱性湿地的CH4平均排放量为14.81 mg/(m2·h)[7],而酸性泥炭泽的CH4平均排放量仅为0.06 mg/(m2·h)[8]。Liu等[9]测定扎龙湿地的CH4排放量时发现,不收割芦苇的湿地甲烷排放量是(7.89±1.35) mg/(m2·h),而收割芦苇的湿地甲烷排放只有(2.35±0.55) mg/(m2·h)。仝川等[10]发现芦苇生长季比非生长季的甲烷量高,在芦苇生长期的8–9月,湿地的平均CH4排放量为(10.72±5.10) mg/(m2·h),进入冻结期后显著降低至(3.94±2.25) mg/(m2·h) (P < 0.05)。Liu等[11]发现在表面覆水融化的过程中,扎龙湿地平均的CH4排放量降至(1.96±2.50) mg/(m2·h)。这些现象说明生长中的芦苇与湿地的甲烷排放有关,但内在原因目前尚未可知。
甲烷古菌是目前已知的唯一产生大量甲烷的生物,它们是严格的厌氧微生物,在无氧的湿地中大量存在。目前已知有6条甲烷古菌产甲烷途径:(1) 由氢营养型产甲烷菌以H2还原CO2产甲烷的途径[12];(2) 乙酸营养型产甲烷古菌进行的乙酸裂解产甲烷途径[13];(3) 由甲基营养型产甲烷古菌将甲醇、甲胺或甲基硫等还原成甲烷的甲基产甲烷途径[14];(4) H2还原甲基物质产甲烷途径[15];(5) 苯甲酸代谢产甲烷途径[16];(6) 长链烷烃代谢产甲烷途径[17]。Achtnich等[18]和Conrad[19]研究发现低温湿地和水稻田中乙酸产甲烷是优势途径;H2还原CO2产甲烷途径在中高温和酸性泥炭地中占主导,如热带和温带淡水沉积物[20-21];而甲基产甲烷途径主要存在海洋中,在淡水环境中少见[22]。Liu等[23]对青藏高原数个低温盐碱湖沉积物的高通量测序显示,乙酸营养型的甲烷鬃菌和甲基营养型的甲烷叶菌占优势。Sorokin等[24]对西伯利亚西南部地区盐碱湖产甲烷菌群的调查发现,盐浓度影响产甲烷古菌的分布,当盐浓度低于3 mol/L时,乙酸型产甲烷菌甲烷鬃菌属(Methanosaeta)占优势;而盐浓度高于3 mol/L时,甲基产甲烷古菌占优势,主要由甲烷叶菌属(Methanolobus)组成。任秘坊等[25]前期调查发现植被是影响青藏高原盐碱湖甲烷排放的主要因素。三甲胺产甲烷是海湾沉积物中的优势产甲烷途径,厌氧细菌可还原抗高渗物质甜菜碱或胆碱产生三甲胺,再被甲烷古菌还原为甲烷[26]。甜菜碱是一种相似相容物质,在细胞中积累有助于提高植物在干旱和盐渍环境中的生长[27]。Hanson等[28]的工作表明,盐芦叶中脯氨酸和甜菜碱的含量较高。扎龙湿地芦苇分布广泛,甜菜碱代谢产甲烷是否是扎龙湿地的优势产甲烷途径有待研究。
本研究以扎龙盐碱湿地的水生芦苇根际土为研究对象,通过16S rRNA基因多样性分析、不同底物产甲烷速率分析、RT-qPCR定量等方法,探究扎龙盐碱湿地的优势产甲烷菌及优势产甲烷途径。
1 材料与方法 1.1 材料 1.1.1 样品研究所用芦苇根际土壤样品采集于我国东北扎龙湿地自然保护区内(N46°52′−47°32′, E123°47′−124°37′),该区的年平均气温3.5 ℃。采样时间为2021年6月9日,采样地的平均水位为19.3 cm,土壤pH 8.2−8.6,采样时空气和土壤平均温度分别为25.3 ℃和17.5 ℃。使用内径38 mm的土钻在每个样方采集原状土壤(深度0–20 cm),将5个重复样品去除表面的芦苇根叶后等量混合,装入无菌自封袋中,4 ℃保存运回实验室,保藏于–80 ℃备用。
1.1.2 产甲烷培养基分别以终浓度为20 mmol/L的产甲烷底物甲醇(methanol)、三甲胺(trimethylamine, TMA)、甜菜碱(glycine betaine, GBT)、乙酸(acetate)和1.01×105 Pa H2/CO2 (H2: CO2体积比为80:20)添加到产甲烷基础培养基中,产甲烷基础培养基参考Zhang等[29]配制,并使用NaCl和NaOH调至与原位环境相同的盐度和pH,抽换气去除氧气后1.01×105 Pa灭菌20 min,备用。
1.1.3 主要试剂和仪器Fast DNA SPIN Kit for Soil,MP Biomedicals公司;琼脂糖凝胶DNA回收试剂盒,美基生物科技公司;Ex Taq PCR体系、pMD19-T Vector,TaKaRa公司;SYBR® qPCR Mix,TOYOBO公司;2.0 mL样品瓶套装,Agilent公司。PCR及RT-qPCR所用引物由生工生物工程(上海)股份有限公司合成,常规试剂主要购于中国国药集团和上海生物工程技术有限公司。
厌氧操作箱和NanoDrop ND-1000,Thermo Fisher公司;隔水式恒温培养箱,上海一恒科技有限公司;气相色谱,Shimadzu公司;气密性采样针,上海佳安分析仪器厂;多功能样品均质器,Bertin公司;PCR扩增仪,杭州朗基科学仪器公司;电泳仪,Bio-Rad公司;实时荧光定量PCR仪,Eppendorf公司。
1.2 芦苇根际土释放甲烷测定 1.2.1 不同底物土样富集物的产甲烷速率测定在厌氧手套箱中称取0–20 cm深扎龙湿地芦苇根际土壤样品各1 g,加入到5 mL已分别添加终浓度为20 mmol/L的甲醇、三甲胺、甜菜碱、乙酸和H2/CO2 (1.01×105 Pa, H2: CO2体积比为80:20)底物的厌氧产甲烷培养基中,每种培养物设4个平行,分别于18 ℃和30 ℃培养,使用50 μL进样针准确量取40 μL顶空气体,用气相色谱仪测定甲烷浓度,并在甲烷浓度增加的线性范围内计算最大产甲烷速率。
1.2.2 气相色谱仪GC-14B测定甲烷采用配备C18极性填充柱和氢焰离子检测器(flame ionization detector, FID)的气相色谱仪测定甲烷。检测条件为:柱温50 ℃,进样口温度80 ℃,检测器温度130 ℃。
1.3 DNA的提取称取0.5 g芦苇根际土土壤样品,按照Fast DNA SPIN Kit for Soil说明书提取土壤样品基因组DNA。用NanoDrop ND-1000和1%琼脂糖凝胶电泳检测DNA浓度和纯度,保存于−20 ℃待用。
1.4 PCR扩增及RT-qPCR定量分析 1.4.1 PCR扩增分别采用古菌的16S rRNA基因引物Arc-F/Arc-R及细菌的16S rRNA基因引物Bac-27F/Bac-1492R (表 1)扩增古菌和细菌的16S rRNA基因。用表 1列出的甲烷八叠球菌科(Methanosarcinaceae)特异16S rRNA基因引物[25]和甲烷马赛球菌科(Methanomassiliicoccaceae)特异的mtaB基因引物扩增它们的16S rRNA基因和mtaB基因。
| 目的基因 Target gene |
引物名称 Primer name |
引物序列 Sequence (5′→3′) |
退火温度 Tm (℃) |
目的 Purpose |
| Archaeal 16S rRNA gene | Arc-F | AGGAATTGGCGGGGGAGCAC | 53 | Amplification of 16S rRNA |
| Arc-R | GCCATGCACCWCCTCT | |||
| Bacterial 16S rRNA gene | Bac-27F | AGAGTTTGATCCTGGCTCAG | 48 | Amplification of 16S rRNA |
| Bac-1492R | GGTTACCTTGTTACGACTT | |||
| Methanosarcinaceae 16S rRNA gene | MSC-F | TTAGCAAGGGCCGGGCAA | 55 | Quantification of Methanosarcinaceae 16S rRNA |
| MSC-R | TAGCGARCATCGTTTACG | |||
| Methanomassiliicoccaceae mtaB gene | MtaB-F | GCTGATGCAGAAGTACCRYGA | 55 | Quantification of 16S rRNA |
| MtaB-R | GTADCCRATRCCGAACAGCCA | |||
| Archaeal 16S rRNA V4‒V5 | Arch-519F | CAGCCGCCGCGGTAA | 55 | Amplification for Ilumina sequencing |
| Arch-915R | GTGCTCCCCCGCCAATTCCT | |||
| Bacterial 16S rRNA V3‒V4 | Bac-341F | CCTAYGGGRBGCASCAG | 55 | Amplification for Illumina sequencing |
| Bac-806R | GGACTACNNGGGTATCTAAT |
PCR反应体系(25 μL):10×Ex Taq buffer 2.5 μL,dNTP Mixture (2.5 μmol/L) 1 μL,Ex Taq (5 U/μL) 0.25 μL,Primer F (10 μmol/L) 1 μL,Primer R (10 μmol/L) 1 μL,模板(20 ng/μL) 1 μL,ddH2O补足25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,引物Tm退火30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。PCR扩增后使用琼脂糖凝胶DNA回收试剂盒按照说明书回收目标条带。
1.4.2 T-载体连接及16S rRNA基因拷贝数的标准曲线绘制将胶回收的目标条带纯化回收,回收后目的片段连接到pMD19-T载体并转化大肠杆菌DH5α感受态细胞,抽提阳性单克隆的质粒并线性化作为模板,稀释模板为10−1–10−8,绘制RT-qPCR标准曲线。
1.4.3 RT-qPCR定量分析采用表 1列出的甲烷八叠球菌科(Methanosarcinaceae)特异16S rRNA基因引物和甲烷马赛球菌科(Methanomassiliicoccaceae)特异的mtaB基因引物,RT-qPCR定量分析它们的16S rRNA基因和mtaB基因拷贝数。RT-qPCR反应体系(25 μL):1×SYBR qPCR Mix 12.5 μL,50×ROX 0.5 μL,Primer F (10 μmol/L) 0.5 μL,Primer R (10 μmol/L) 0.5 μL,模板(20 ng/μL) 5 μL,ddH2O补足6 μL。RT-qPCR反应条件:95 ℃ 30 s;95 ℃ 10 s,引物Tm退火30 s,72 ℃ 30 s,30个循环。
1.5 细菌和古菌16S rRNA基因测序提取样品基因组DNA,检验浓度和纯度确保符合实验要求。PCR扩增样品基因组DNA中细菌16S rRNA基因的V3−V4区和古菌16S rRNA基因的V4−V5区,细菌的引物为Bac-341F/Bac-806R,古菌的引物为Arch-519F/ Arch-915R (表 1)。PCR反应体系(20 μL):5×FastPfu buffer 4 μL,dNTPs (2.5 mmol/L) 2 μL,上、下游引物(5 μmol/L)各0.8 μL,FastPfu Polymerase (2.5 U/μL) 0.4 μL,模板DNA (10 ng/μL) 1 μL,ddH2O补足20 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s;引物Tm退火30 s,72 ℃ 45 s,30个循环;72 ℃ 10 min。PCR扩增、高通量测序均由上海凌恩生物科技有限公司在Illumina平台进行PE250模式建库测序完成。
1.6 统计分析使用Excel进行数据的统计分析,使用GraphPad Prism 8.0软件进行图片绘制。
2 结果与分析 2.1 扎龙湿地原位土壤中的优势产甲烷古菌和细菌组成对扎龙湿地芦苇根际深0–20 cm的土壤进行16S rRNA基因扩增子测序和OTU聚类分析,共检测到3 786个古菌的OTU,已知分类地位的古菌科占测定总古菌的81.70%。图 1为不同产甲烷古菌科的丰度堆积图,其中氢营养型的甲烷杆菌科(Methanobacteriaceae, 32.8%)丰度最高,其次是厌氧氧化甲烷的噬甲烷菌科(Methanoperedenaceae, 31.52%)、氢营养型的Rice Cluster II (11.55%)、乙酸型的甲烷鬃菌科(Methanosaetaceae, 10.14%)、甲基型的甲烷八叠球菌科(Methanosarcinaceae, 5.88%)及H2还原甲基物质产甲烷的甲烷马赛球菌科(Methanomassiliicoccaceae, 3.64%) (图 1A)。共检测到产甲烷古菌属25个,相对丰度最高的是氢营养型的甲烷杆菌属(Methanobacterium, 36.42%),其次为厌氧氧化甲烷的噬甲烷菌属(Candidatus Methanoperedens, 35.06%)、乙酸型的甲烷鬃菌属(Methanosaeta, 11.29%)、甲基型的甲烷八叠球菌属(Methanosarcina, 6.53%)及H2还原甲基型的甲烷马赛球菌属(Methanomassiliicoccus, 4.05%) (图 1A)。
|
| 图 1 扎龙湿地芦苇根际土中产甲烷古菌(A)及细菌(B)的相对丰度 Figure 1 Relative abundances of methanogenic archaea (A) and bacteria (B) in the reed rhizosphere of Zhalong wetland. |
|
|
16S rRNA基因多样性分析共检测到6 523个细菌的OTU,已知分类地位的细菌门占检测到的芦苇根际土总细菌的64.31%。优势细菌是绿弯菌门(Chloroflexi, 21.55%),其次为变形杆菌门(Proteobacteria, 16.88%)、放线菌门(Actinobacteria, 13.37%)、酸杆菌门(Acidobacteria, 10.00%)、拟杆菌门(Bacteroidota, 7.42%)、脱硫杆菌门(Desulfobacterota, 7.77%)和厚壁菌门(Firmicutes, 5.18%) (图 1B)。已知高盐环境中的芦苇细胞积累甜菜碱和脯氨酸抗高渗胁迫[27-28],而厚壁菌门中的一些细菌可还原甜菜碱为三甲胺,后者可被甲基型的甲烷古菌转化为甲烷[30]。因此我们进一步分析厚壁菌门的细菌类群,结果发现具有还原甜菜碱产三甲胺潜力的细菌包括梭菌科(Clostridiaceae, 46.19%)、真杆菌科(Eubacteriaceae, 3.12%)和鼠胞菌科(Sporomusaceae, 1.36%) (图 1B)。
综上所述,扎龙湿地芦苇根际土的优势产甲烷古菌为氢营养型的甲烷杆菌、乙酸型的甲烷鬃菌及乙酸/甲基型的甲烷八叠球菌,并含有与还原甜菜碱产三甲胺能力的细菌相似性较高的菌群,如厚壁菌门内的梭菌科、真杆菌科和鼠胞菌科,它们具有还原甜菜碱产生三甲胺的潜力,后者可被甲基型产甲烷古菌转化为甲烷。
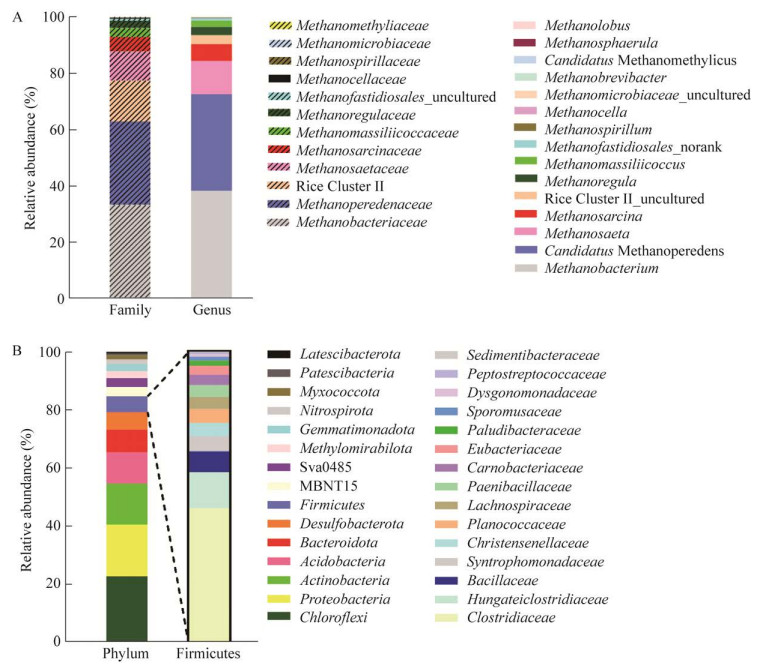
2.2 扎龙湿地芦苇根际土中甜菜碱和三甲胺产甲烷最活跃为进一步确定扎龙湿地芦苇根际土中活跃的产甲烷途径,我们在芦苇根际土壤样品中分别加入已知的产甲烷底物甲醇、三甲胺、甜菜碱、乙酸和H2/CO2,并在模拟原位环境pH 8.0于18 ℃和30 ℃培养4周;每2天测定富集物的产甲烷量,计算扎龙湿地土壤不同底物的产甲烷速率。结果显示,甜菜碱和三甲胺的土壤富集物产甲烷速率最高,而H2/CO2富集物的产甲烷速率与无底物添加土壤的产甲烷速率相同(图 2)。这说明甜菜碱和三甲胺产甲烷是扎龙湿地芦苇根际土中主要的产甲烷途径,甲醇和乙酸产甲烷途径的活力中等。尽管16S rRNA基因序列分析显示氢营养型的甲烷杆菌相对含量最高,但H2还原CO2产甲烷途径的活力很低,说明这些古菌在湿地中并不活跃。
|
| 图 2 扎龙湿地芦苇根际土样品在30 ℃ (A)和18 ℃ (B)时不同底物培养的产甲烷速率 Figure 2 Methane production of the Zhalong wetland soil enrichments with different substrates at 30 ℃ (A) and 18 ℃ (B). |
|
|
由于扎龙湿地常年处于低温,我们进一步分析该湿地是否存在耐低温的产甲烷途径。通过比较18 ℃和30 ℃不同富集物的产甲烷速率,发现18 ℃的也是三甲胺[2.89 mmol CH4/(L·d·g-soil)]和甜菜碱[1.64 mmol CH4/(L·d·g-soil)]产甲烷速率最高,但比30 ℃同样富集物的产甲烷速率[三甲胺:3.14 mmol CH4/(L·d·g-soil);甜菜碱:3.44 mmol CH4/(L·d·g-soil)]低,其中甜菜碱的产甲烷速率约为30 ℃同样富集物的1/2。而且比较2个温度下富集物开始产甲烷时间发现,18 ℃的富集物在培养10 d后才开始产甲烷(图 2B),而30 ℃的培养物在4 d时即开始产甲烷(图 2B),但18 ℃的富集物在26 d时的产甲烷量与30 ℃的相当。这说明湿地土中可能存在耐低温的甲基产甲烷菌。
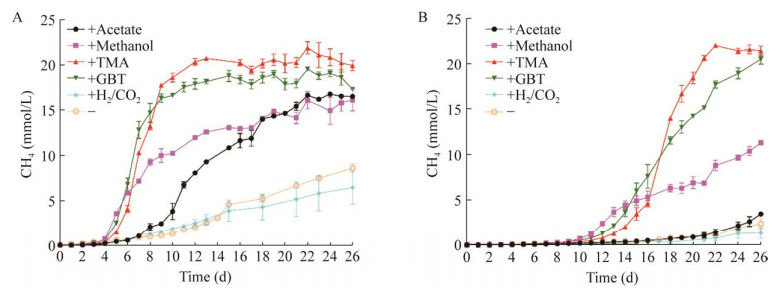
2.3 富集到扎龙湿地的优势甲基产甲烷古菌和还原甜菜碱的细菌为分析甲基型产甲烷古菌及还原甜菜碱的细菌菌群,我们提取30 ℃厌氧培养26 d的三甲胺、甜菜碱和甲醇富集物的DNA,测定其16S rRNA基因扩增子的序列。结果鉴定了388个古菌的OTU和383个细菌的OTU。三甲胺、甜菜碱和甲醇富集物中已知分类地位的古菌科分别占测定总古菌的98.22%、92.30%和91.55%;已知分类地位的细菌门分别占测定总细菌的44.51%、45.2%和86.19%。图 3和图 4分别为产甲烷古菌科和属、细菌科和属的组成及其相对丰度。与原位土壤相比,三甲胺富集物中甲基型的甲烷八叠球菌科(Methanosarcinaceae)和H2还原甲基型的甲烷马赛球菌科(Mehanomassiliicoccaceae)显著富集,分别提高6.7倍和2.7倍,甜菜碱富集物中分别提高4.4倍和2.4倍,甲醇富集物中分别提高4.8倍和1.8倍(图 3A);甲烷八叠球菌属在三甲胺、甜菜碱和甲醇富集物中分别提高了13.7、11.9和12.8倍(图 3B)。上述结果说明扎龙湿地芦苇根际土中主要的甲基产甲烷古菌包含甲烷八叠球菌属和甲烷马赛球菌科。
|
| 图 3 甲基物质30 ℃富集的扎龙湿地土壤样品中的产甲烷古菌相对丰度 Figure 3 Relative abundances of the methanogenic in the methyl substance-enriched Zhalong wetland at 30 ℃. A:产甲烷古菌科. B:产甲烷古菌属 A: Compositions of methanogenic archaea at family taxonomic ranks. B: Compositions of methanogenic archaea at genera taxonomic ranks. |
|
|
|
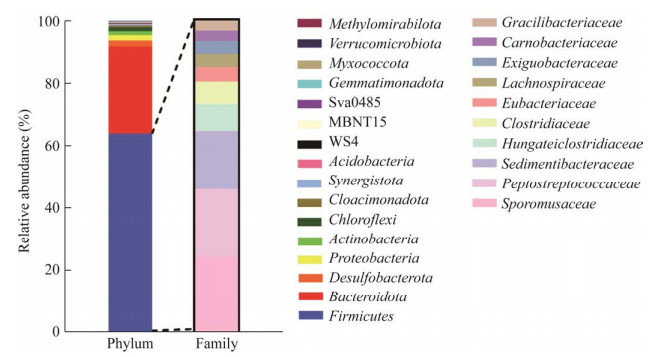
| 图 4 扎龙湿地土壤样品的甜菜碱30 ℃富集物中细菌相对丰度 Figure 4 Relative abundances of bacteria in the betaine substance-enriched Zhalong wetland soil at 30 ℃. Phylum:细菌门;Family:厚壁菌门中细菌科 Phylum: Bacterial phyla composition; Family: Firmicutes. |
|
|
16S rRNA基因多样性及相对丰度分析发现,湿地土壤的甜菜碱富集物中的细菌以厚壁菌门(Fimicutes)和拟杆菌门(Bacteroidota)为主,分别占63.93%和27.89%;厚壁菌门中的鼠胞菌科(Sporomusaceae)、沉积杆菌科(Sedimentibacteraceae)和亨盖特梭菌科(Hungateiclostridiaceae)比原位湿地分别提高了173、308和187倍(图 4);而梭菌科(Clostridiaceae)和真杆菌科(Eubacteriaceae)丰度分别比原位土提高了1.4倍和1.5倍,暗示它们可能是代谢甜菜碱的主要细菌,还原甜菜碱产生三甲胺,提供产甲烷的底物。对富集物的宏基因组分析也发现,细菌代谢甜菜碱的相关功能基因grdH和产甲烷菌代谢三甲胺的功能基因mttB丰度均提高(未展示结果)。
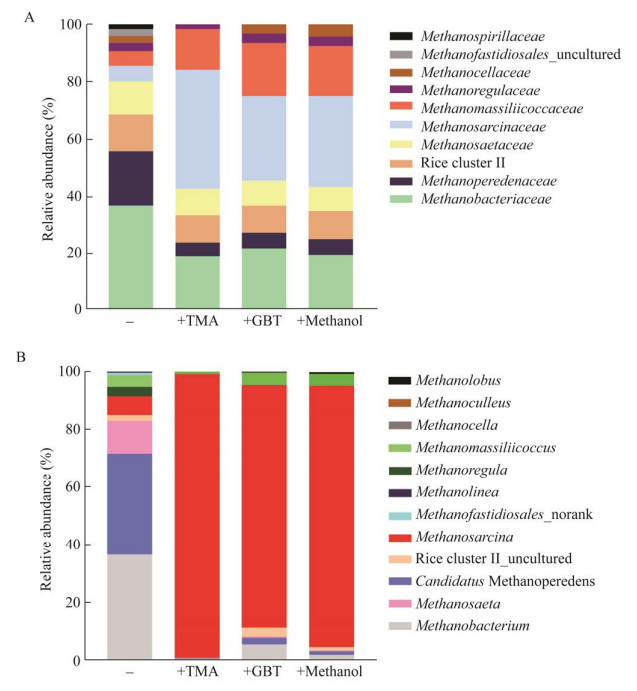
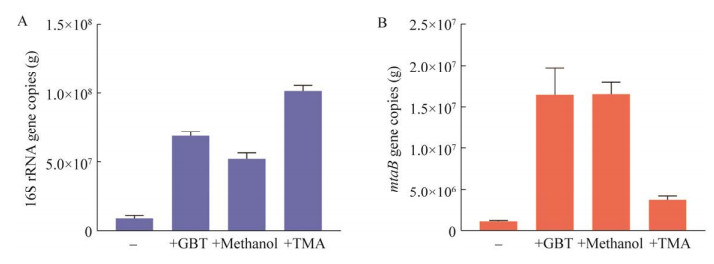
2.4 定量分析甲基物质富集的优势产甲烷古菌16S rRNA基因序列分析表明,扎龙湿地甲基物质富集物中的优势产甲烷古菌为甲烷八叠球菌和甲烷马赛球菌,为了确定这两类古菌被富集,我们采用RT-qPCR方法,定量分析了甲烷八叠球菌特异的16S rRNA基因和甲烷马赛球菌特异的甲基转移酶基因mtaB。结果发现,产甲烷八叠球菌科在三甲胺富集物(1.02×108 copies/g)中比在原位土壤(9.02×106 copies/g)提高了10.27倍,在甜菜碱富集物(6.90×107 copies/g)中提高了6.8倍,在甲醇富集物(5.24×107 copies/g)中提高了6.64倍(图 5A)。同样,甲烷马赛球菌科在甜菜碱富集物中(1.64×107 copies/g)比原位土壤(1×106 copies/g)提高了13.39倍,在甲醇(1.65×107 copies/g)和三甲胺富集物(3.72×106 copies/g)中分别提高了13.34倍和2.25倍(图 5B)。进一步证明湿地土壤中从三甲胺产甲烷的优势菌为甲烷八叠球菌,甲烷马赛球菌也发挥重要作用。
|
| 图 5 RT-qPCR定量甲基物质富集的扎龙芦苇土壤优势产甲烷古菌 Figure 5 Quantification of methylotrophic methanogens of the betaine substance-enriched Zhalong wetland soil. A:甲烷八叠球菌科. B:甲烷马赛球菌科 A: RT-qPCR was used to quantify Methanosarcinaceae specific 16S rRNA gene. B: RT-qPCR was used to quantify Methanomassiliicoccaceae specific 16S rRNA gene. |
|
|
Liu等[9]研究发现芦苇收割是影响扎龙低温高碱湿地甲烷排放的主要因素,不收割芦苇的湿地甲烷排放量高达(7.89±1.35) mg/(m2·h)。我们通过16S rRNA基因扩增子测序发现,扎龙湿地芦苇根际土的优势产甲烷古菌是甲烷杆菌、噬甲烷菌、甲烷鬃菌、甲烷八叠球菌和甲烷马赛球菌,优势细菌为绿弯菌门、变形菌门、酸杆菌门和拟杆菌门。通过富集实验发现甜菜碱来源的三甲胺产甲烷途径是扎龙湿地芦苇根际土的优势产甲烷途径,其中代谢甜菜碱的优势细菌为厚壁菌门的鼠胞菌科、沉积杆菌科和亨盖特梭菌科。RT-qPCR定量分析表明,代谢三甲胺的优势产甲烷古菌是甲基营养型的甲烷八叠球菌和H2还原甲基物质的甲烷马赛球菌。
与海洋及滨海盐沼湿地相似,扎龙湿地高盐环境中的甲基物质是三甲胺,其主要来自于细菌转化抗高渗物质甜菜碱或胆碱产生,被产甲烷古菌进一步代谢产甲烷[26]。甜菜碱是一种相似相容物质,能稳定细胞结构,保持酶、蛋白质复合物的活性和细胞膜的完整性,因此帮助细胞抵御环境中的盐碱、高低温胁迫[31]。生活在高盐环境的一些生物细胞中的甜菜碱浓度可高达1 mol/L[32]。Jameson等[33]通过对滨海盐沼沉积物16S rRNA基因多样性分析和碳同位素示踪技术及宏基因组学分析发现,暗杆菌(Pelobacter)和甲烷拟球菌(Methanococcoides)协同代谢胆碱产甲烷。另外,未获得纯培养的甜菜碱菌科Ca. “Betainaceae”可代谢甜菜碱产生三甲胺[34]。
与其他盐碱生境不同,扎龙低温湿地的优势甲基产甲烷古菌主要为甲烷八叠球菌和甲烷马赛球菌,而海洋中主要的甲基产甲烷古菌为甲烷拟球菌[31]。扎龙低温湿地中代谢甜菜碱产生三甲胺的优势细菌为厚壁菌门的鼠胞菌科和梭菌科,这与海洋生境中代谢甜菜碱的优势细菌为梭菌科较为相似,暗示梭菌科中代谢甜菜碱产生三甲胺的细菌具有生态分布的广泛性。扎龙湿地最热的7月平均温度为22.9 ℃[35],我们通过不同温度富集实验发现,扎龙湿地代谢三甲胺产甲烷古菌为耐低温产甲烷古菌,扎龙湿地代谢甜菜碱产甲烷主要发生在芦苇生长季,在寒冷的非生长季代谢甜菜碱产三甲胺的细菌活力降低,导致甲烷排放减少。黄璞祎等[36]研究了扎龙湿地生长季甲烷通量,观测期内平均甲烷通量为7.67 mg/(m2·h),估计扎龙芦苇湿地每年生长季向大气释放3.88×105 t甲烷。而Liu等[9]研究发现在芦苇生长期8–9月,平均甲烷排放量为(10.72±5.10) mg/(m2·h),进入冻结期降低至(3.94±2.25) mg/(m2·h);在湿地表面覆水融化的过程中,扎龙湿地土壤平均原位甲烷排放通量继续降低至(1.96±2.50) mg/(m2·h)。
甲烷厌氧氧化(anaerobic oxidation of methane, AOM)是缺氧环境中甲烷营养古菌的生物学过程[33],不同的生态系统中,甲烷营养古菌利用不同的电子受体氧化甲烷[37-39];Timmers等[40]发现海洋中厌氧甲烷氧化古菌(anaerobic methan-otrophic archaea, ANMEs)和硫酸盐还原菌(sulfate-reducing bacteria, SRB)协同降解甲烷,后来发现也能以硝酸盐为电子受体厌氧氧化甲烷[41]。Haroon等[42]报道了淡水环境中的Ca. Methanoperedens nitroreducens和Methylomirabilis oxyfera介导的耦联硝酸盐还原的甲烷厌氧氧化。Chen等[37]发现青藏高原若尔盖湿地中含有Ca. Methanoperedens。本研究也发现扎龙低温盐碱湿地存在丰富的Ca. Methanoperedens,可能是芦苇根际土产生的大量甲烷为其提供充足的底物。铁是地壳中分布含量第二高的金属,以三价铁为电子受体的甲烷厌氧氧化广泛存在。前期研究测得扎龙湿地土壤中硝酸盐含量0.09−0.25 mg/kg,总铁元素含量约为6.494−28.256 mg/kg[43],因此扎龙湿地也可能存在偶联三价铁还原的甲烷厌氧氧化过程,但不排除偶联硝酸盐还原的厌氧甲烷氧化过程。
综上所述,本研究证明扎龙盐碱湿地芦苇根际土中的三甲胺产甲烷是优势途径,三甲胺来自细菌转化生物抗高渗的甜菜碱,优势的产甲烷古菌是甲烷八叠球菌和甲烷马赛球菌。
| [1] |
FENG X, JIANG L, LI D, TIAN S, ZHU X, WANG H, HE C, LI K. Progress and key challenges in catalytic combustion of lean methane[J]. Journal of Energy Chemistry, 2022, 75: 173-215. DOI:10.1016/j.jechem.2022.08.001 |
| [2] |
ALEXANDER L, ALLEN S, BINDOFF N, BREON FM, CHURCH J, CUBASCH U, EMORI S, FORSTER P, FRIEDLINGSTEIN P, GILLETT N, GREGORY J, HARTMANN D, JANSEN E, KIRTMAN B, KNUTTI R, KANIKICHARLA K, LEMKE P, MAROTZKE J, MASSON-DELMOTTE V, XIE SP. Climate Change 2013: the Physical Science Basis, in Contribution of Working Group I (WGI) to the Fifth Assessment Report (AR5) of the Intergovernmental Panel on Climate Change (IPCC)[M]. Cambridge, United Kingdom and New York, NY, USA, Cambridge University Press, 2013.
|
| [3] |
HERNÁNDEZ ME, MARÍN-MUNIZ JL, OLGUÍN EJ. Effect of flooding frequency and nutrient addition on plant growth and total petroleum hydrocarbons removal in mangrove microcosms[J]. Journal of Water Resource and Protection, 2014, 6(18): 1716-1730. DOI:10.4236/jwarp.2014.618154 |
| [4] |
MATTHEWS E, FUNG I. Methane emission from natural wetlands: global distribution, area, and environmental characteristics of sources[J]. Global Biogeochemical Cycles, 1987, 1(1): 61-86. DOI:10.1029/GB001i001p00061 |
| [5] |
QIN XW, ZHANG SQ, LI XF, NA XD, PAN X. Spatial pattern of nest-site of Grus japonens in Zhalong National Nature Reserve[J]. Wetland Science, 2009, 2009, 7(2): 106-111 (in Chinese). 秦喜文, 张树清, 李晓峰, 那晓东, 潘欣. 扎龙国家级自然保护区丹顶鹤巢址的空间分布格局分析[J]. 湿地科学, 2009, 7(2): 106-111. |
| [6] |
CHEN HS, MA DL, JIANG XW, LIU MY, ZANG SY. Effects of seasonal freeze-thaw on soil microbial community structures and extracellular enzyme activities in Zhalong wetland[J]. Acta Scientiae Circumstantiae, 2020, 40(4): 1443-1451. (in Chinese) 陈泓硕, 马大龙, 姜雪薇, 刘梦洋, 臧淑英. 季节性冻融对扎龙湿地土壤微生物群落结构和胞外酶活性的影响[J]. 环境科学学报, 2020, 40(4): 1443-1451. |
| [7] |
ZHOU WC, CUI LJ, WANG YF, LI W, KANG XM. CO2 and CH4 emission fluxes from hummock and hollow in Fen in zoigê plateau in 2014[J]. Wetland Science, 2018, 16(6): 693-699. (in Chinese) 周文昌, 崔丽娟, 王义飞, 李伟, 康晓明. 2014年若尔盖泥炭沼泽中草丘和洼地CO2和CH4排放通量[J]. 湿地科学, 2018, 16(6): 693-699. |
| [8] |
HAYES DJ, KICKLIGHTER DW, DAVID MCGUIRE A, CHEN M, ZHUANG QL, YUAN FM, MELILLO JM, WULLSCHLEGER SD. The impacts of recent permafrost thaw on land-atmosphere greenhouse gas exchange[J]. Environmental Research Letters, 2014, 9(4): 045005. DOI:10.1088/1748-9326/9/4/045005 |
| [9] |
LIU FQ, ZHANG YP, LIANG H, GAO DW. Long-term harvesting of reeds affects greenhouse gas emissions and microbial functional genes in alkaline wetlands[J]. Water Research, 2019, 164: 114936. DOI:10.1016/j.watres.2019.114936 |
| [10] |
TONG C, ZENG CS, WANG WQ, YAN ZP, YANG HY. Main factors influencing CH4 flux from a Phragmites australis wetland in the Min River Estuary[J]. Acta Scientiae Circumstantiae, 2009, 29(1): 207-216. (in Chinese) 仝川, 曾从盛, 王维奇, 闫宗平, 杨红玉. 闽江河口芦苇潮汐湿地甲烷通量及主要影响因子[J]. 环境科学学报, 2009, 29(1): 207-216. |
| [11] |
LIU FQ, ZHANG YP, LIANG H, GAO DW. Resilience of methane cycle and microbial functional genes to drought and flood in an alkaline wetland: a metagenomic analysis[J]. Chemosphere, 2021, 265: 129034. DOI:10.1016/j.chemosphere.2020.129034 |
| [12] |
LEADBETTER JR, BREZNAK JA. Physiological ecology of Methanobrevibacter cuticularis sp. nov. and Methanobrevibacter curvatus sp. nov., isolated from the hindgut of the termite Reticulitermes flavipes[J]. Applied Environmental Microbiology, 1996, 62(10): 3620-3631. DOI:10.1128/aem.62.10.3620-3631.1996 |
| [13] |
FERRY JG. Enzymology of one-carbon metabolism in methanogenic pathways[J]. FEMS Microbiology Reviews, 1999, 23(1): 13-38. DOI:10.1111/j.1574-6976.1999.tb00390.x |
| [14] |
BRÄUER SL, BASILIKO N, SILJANEN HMP, ZINDER SH. Methanogenic archaea in peatlands[J]. FEMS Microbiology Letters, 2020, 367(20): fnaa172. DOI:10.1093/femsle/fnaa172 |
| [15] |
LANG K, SCHULDES J, KLINGL A, POEHLEIN A, DANIEL R, BRUNEA A. New mode of energy metabolism in the seventh order of methanogens as revealed by comparative genome analysis of "Candidatus methanoplasma termitum"[J]. Applied and Environmental Microbiology, 2015, 81(4): 1338-1352. DOI:10.1128/AEM.03389-14 |
| [16] |
MAYUMI D, MOCHIMARU H, TAMAKI H, YAMAMOTO K, YOSHIOKA H, SUZUKI Y, KAMAGATA Y, SAKATA S. Methane production from coal by a single methanogen[J]. Science, 2016, 354(6309): 222-225. DOI:10.1126/science.aaf8821 |
| [17] |
ZHOU Z, ZHANG CJ, LIU PF, FU L, LASO-PÉREZ R, YANG L, BAI LP, LI J, YANG M, LIN JZ, WANG WD, WEGENER G, LI M, CHENG L. Non-syntrophic methanogenic hydrocarbon degradation by an archaeal species[J]. Nature, 2022, 601(7892): 257-262. DOI:10.1038/s41586-021-04235-2 |
| [18] |
ACHTNICH C, SCHUHMANN A, WIND T, CONRAD R. Role of interspecies H2 transfer to sulfate and ferric iron-reducing bacteria in acetate consumption in anoxic paddy soil[J]. FEMS Microbiology Ecology, 1995, 16(1): 61-69. DOI:10.1111/j.1574-6941.1995.tb00269.x |
| [19] |
CONRAD R. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments[J]. FEMS Microbiology Ecology, 1999, 28(3): 193-202. DOI:10.1111/j.1574-6941.1999.tb00575.x |
| [20] |
CONRAD R, JI Y, NOLL M, KLOSE M, CLAUS P, ENRICH-PRAST A. Response of the methanogenic microbial communities in Amazonian oxbow lake sediments to desiccation stress[J]. Environmental Microbiology, 2014, 16(6): 1682-1694. DOI:10.1111/1462-2920.12267 |
| [21] |
METJE M, FRENZEL P. Effect of temperature on anaerobic ethanol oxidation and methanogenesis in acidic peat from a northern wetland[J]. Applied and Environmental Microbiology, 2005, 71(12): 8191-8200. DOI:10.1128/AEM.71.12.8191-8200.2005 |
| [22] |
LOVLEY DR, KLUG MJ. Methanogenesis from methanol and methylamines and acetogenesis from hydrogen and carbon dioxide in the sediments of a eutrophic lake[J]. Applied and Environmental Microbiology, 1983, 45(4): 1310-1315. DOI:10.1128/aem.45.4.1310-1315.1983 |
| [23] |
LIU YQ, YAO TD, GLEIXNER G, CLAUS P, CONRAD R. Methanogenic pathways, 13C isotope fractionation, and archaeal community composition in lake sediments and wetland soils on the Tibetan Plateau[J]. Journal of Geophysical Research: Biogeosciences, 2013, 118(2): 650-664. DOI:10.1002/jgrg.20055 |
| [24] |
SOROKIN DY, ABBAS B, GELEIJNSE M, PIMENOV NV, SUKHACHEVA MV, van LOOSDRECHT MCM. Methanogenesis at extremely haloalkaline conditions in the soda lakes of Kulunda Steppe (Altai, Russia)[J]. FEMS Microbiology Ecology, 2015, 91(4): fiv016. |
| [25] |
REN MF, LI LY, CHEN L, XING TT, LIU YQ, DONG XZ. Methanogen communities and predominant methanogenic pathways in three saline-alkaline lakes on the Tibetan Plateau[J]. Acta Microbiologica Sinica, 2020, 60(1): 161-171. (in Chinese) 任秘坊, 李凌燕, 陈琳, 邢婷婷, 刘勇勤, 东秀珠. 青藏高原三个盐碱湖的产甲烷菌群和产甲烷代谢途径分析[J]. 微生物学报, 2020, 60(1): 161-171. |
| [26] |
KING GM. Metabolism of trimethylamine, choline, and glycine betaine by sulfate-reducing and methanogenic bacteria in marine sediments[J]. Applied and Environmental Microbiology, 1984, 48(4): 719-725. DOI:10.1128/aem.48.4.719-725.1984 |
| [27] |
RHODES D, HANSON AD. Quaternary ammonium and tertiary sulfonium compounds in higher plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1993, 44: 357-384. DOI:10.1146/annurev.pp.44.060193.002041 |
| [28] |
HANSON AD, WYSE R. Biosynthesis, translocation, and accumulation of betaine in sugar beet and its progenitors in relation to salinity[J]. Plant Physiology, 1982, 70(4): 1191-1198. DOI:10.1104/pp.70.4.1191 |
| [29] |
ZHANG GS, JIANG N, LIU XL, DONG XZ. Methanogenesis from methanol at low temperatures by a novel psychrophilic methanogen, Methanolobus psychrophilus sp. nov., prevalent in Zoige wetland of the Tibetan Plateau[J]. Applied and Environmental Microbiology, 2008, 74(19): 6114-6120. DOI:10.1128/AEM.01146-08 |
| [30] |
FENNEMA D, PHILLIPS IR, SHEPHARD EA. Trimethylamine and trimethylamine N-oxide, a flavin-containing monooxygenase 3 (FMO3)-mediated host-microbiome metabolic axis implicated in health and disease[J]. Drug Metabolism and Disposition, 2016, 44(11): 1839-1850. DOI:10.1124/dmd.116.070615 |
| [31] |
WADITEE R, TANAKA Y, AOKI K, HIBINO T, JIKUYA H, TAKANO J, TAKABE T, TAKABE T. Isolation and functional characterization of N-methyltransferases that catalyze betaine synthesis from Glycine in a halotolerant photosynthetic organism Aphanothece halophytica[J]. Journal of Biological Chemistry, 2003, 278(7): 4932-4942. DOI:10.1074/jbc.M210970200 |
| [32] |
OREN A. Formation and breakdown of glycine betaine and trimethylamine in hypersaline environments[J]. Antonie Van Leeuwenhoek, 1990, 58(4): 291-298. DOI:10.1007/BF00399342 |
| [33] |
JAMESON E, STEPHENSON J, JONES H, MILLARD A, KASTER AK, PURDY KJ, AIRS R, MURRELL JC, CHEN Y. Deltaproteobacteria (Pelobacter) and Methanococcoides are responsible for choline-dependent methanogenesis in a coastal saltmarsh sediment[J]. The ISME Journal, 2019, 13(2): 277-289. DOI:10.1038/s41396-018-0269-8 |
| [34] |
JONES HJ, KRÖBER E, STEPHENSON J, MAUSZ MA, JAMESON E, MILLARD A, PURDY KJ, CHEN Y. A new family of uncultivated bacteria involved in methanogenesis from the ubiquitous osmolyte glycine betaine in coastal saltmarsh sediments[J]. Microbiome, 2019, 7(1): 120. DOI:10.1186/s40168-019-0732-4 |
| [35] |
JIAO DZ, YAN QY, JIANG QX, CAO R, YANG YF. E quantitative characteristics and interrelation of module of Phragmites australis popula-in Zhalong Wetland in Heilongjiang[J]. Chinese Journal of Ecology, 2018, 37(7): 1983-1989. (in Chinese) 焦德志, 闫秋月, 姜秋旭, 曹瑞, 杨允菲. 黑龙江扎龙湿地芦苇种群构件数量特征及其相关性[J]. 生态学杂志, 2018, 37(7): 1983-1989. |
| [36] |
HUANG PY, YU HX, CHAI LH, CHAI FY, ZHANG WF. Methane emission flux of Zhalong Phragmites australis wetlands in growth season[J]. Chinese Journal of Applied Ecology, 2011, 22(5): 1219-1224. (in Chinese) 黄璞祎, 于洪贤, 柴龙会, 柴方营, 张万峰. 扎龙芦苇湿地生长季的甲烷排放通量[J]. 应用生态学报, 2011, 22(5): 1219-1224. |
| [37] |
CHEN L, LI LY, ZHANG SJ, ZHANG WT, XUE K, WANG YF, DONG XZ. Anaerobic methane oxidation linked to Fe(III) reduction in a Candidatus Methanoperedens-enriched consortium from the cold Zoige wetland at Tibetan Plateau[J]. Environmental Microbiology, 2022, 24(2): 614-625. DOI:10.1111/1462-2920.15848 |
| [38] |
GUPTA V, SMEMO KA, YAVITT JB, FOWLE D, BRANFIREUN B, BASILIKO N. Stable isotopes reveal widespread anaerobic methane oxidation across latitude and peatland type[J]. Environmental Science & Technology, 2013, 47(15): 8273-8279. |
| [39] |
McGLYNN SE, CHADWICK GL, KEMPES CP, ORPHAN VJ. Single cell activity reveals direct electron transfer in methanotrophic consortia[J]. Nature, 2015, 526(7574): 531-535. DOI:10.1038/nature15512 |
| [40] |
TIMMERS PH, SUAREZ-ZULUAGA DA, van ROSSEM M, DIENDER M, STAMS AJ, PLUGGE CM. Anaerobic oxidation of methane associated with sulfate reduction in a natural freshwater gas source[J]. The ISME Journal, 2016, 10(6): 1400-1412. |
| [41] |
WEGENER G, KRUKENBERG V, RIEDEL D, TEGETMEYER HE, BOETIUS A. Intercellular wiring enables electron transfer between methanotrophic Archaea and bacteria[J]. Nature, 2015, 526(7574): 587-590. |
| [42] |
HAROON MF, HU SH, SHI Y, IMELFORT M, KELLER J, HUGENHOLTZ P, YUAN ZG, TYSON GW. Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage[J]. Nature, 2013, 500(7464): 567-570. |
| [43] |
JIN ZM, HAO Y, LIU LJ, ZHANG YF, ZHU K, LI D. Effects of heavy metals in Zhalong wetland soil on soil chemical properties and electrical conductivity[J]. Jiangsu Agricultural Sciences, 2015, 43(8): 333-336. (in Chinese) 金忠民, 郝宇, 刘丽杰, 张艳馥, 朱坤, 李丹. 扎龙湿地土壤重金属对土壤化学性质和电导率的影响[J]. 江苏农业科学, 2015, 43(8): 333-336. |
 2023, Vol. 50
2023, Vol. 50