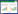扩展功能
文章信息
- 赵祎, 石瑶, 汤雯婷, 李海燕
- ZHAO Yi, SHI Yao, TANG Wenting, LI Haiyan
- 灯盏花内生真菌多样性、群落结构及生态功能预测
- Diversity, community structure, and ecological roles of endophytic fungi in Erigeron breviscapus
- 微生物学通报, 2023, 50(11): 4812-4824
- Microbiology China, 2023, 50(11): 4812-4824
- DOI: 10.13344/j.microbiol.china.230244
-
文章历史
- 收稿日期: 2023-03-28
- 接受日期: 2023-05-23
- 网络首发日期: 2023-07-20
2. 云南省农业科学院药用植物研究所, 云南 昆明 650200;
3. 昆明理工大学医学院, 云南 昆明 650500
2. Institute of Medicinal Plants, Yunnan Academy of Agricultural Sciences, Kunming 650200, Yunnan, China;
3. School of Medicine, Kunming University of Science and Technology, Kunming 650500, Yunnan, China
“植物全基因组理论”认为,每一植物个体都是植物与微生物组成的生命共同体,植物与微生物相互作用,驱动植物进化与演变[1-2]。内生真菌定殖于植物内部,是植物-微生物系统的重要组成部分[3]。它们参与宿主植物代谢,共同塑造了复杂的植物代谢谱。内生真菌不仅能代谢生成与宿主植物相同或相似的活性产物,也能通过影响和调节药用植物次生代谢产物的合成、含量及累积,直接或者间接地影响药用植物活性物质的分布和含量[4]。内生真菌的次生代谢物复杂多样、骨架结构新颖,是天然药物研究潜在的资源宝库[5]。
灯盏花[Erigeron breviscapus (Vant.) Hand.-Mazz.]以全草入药,临床上主要用于心脑血管疾病的治疗,每年市场销售额高达5亿元左右,具有较高的药用和经济价值[6]。有关灯盏花的研究主要集中于化学物质基础揭示、药理学研究及基因组辅助分子育种等方面,关于其内生真菌方面的研究目前仅限于可培养的种类[7-9]。由于自然界绝大多数微生物(99%)尚不可培养,导致其中蕴含的微生物暗物质(microbial dark matter)和难以培养微生物信息的缺失,严重影响对灯盏花内生真菌群落结构多样性的评估[10]。使用宏基因组高通量测序技术方法分析微生物群落结构是目前最重要、最迅速的菌群结构与功能认识的方法之一[11]。通常使用真菌特异性引物进行系统发育标记分子(internal transcribed spacer, ITS)的扩增,并通过测定其序列来识别微生物群落的物种组成,定量其丰度[12]。
本研究采用ITS序列的高通量测序方法,以云南产多年生成熟灯盏花为研究对象,通过分析灯盏花内生真菌多样性、群落组成和功能预测,初步阐明灯盏花内生真菌在不同植物组织中的分布特征和生态功能,以期为后续发现关键控制基因、挖掘天然产物合成基因簇、促进微生物资源的深度开发与利用奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 样品采集灯盏花植物样品于2022年1月采自云南省红河州泸西县灯盏花种植基地(24°40′25″N, 103°46′24″E),选择4个灯盏花长势一致且处于初花期的采样点,每个采样点取10株发育良好的整株植物,根部带土置于冷链箱内带回实验室,在24 h内处理样品。
1.1.2 培养基、主要试剂和仪器试验所用培养基为马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基(g/L):马铃薯200.0,葡萄糖20.0,蛋白胨5.0,琼脂20.0。
HiPure Soil DNA提取试剂盒,Magen公司;Q5® High-Fidelity PCR Kit,New England Biolabs公司;AxyPrep DNA凝胶提取试剂盒,Axygen Biosciences公司。
精密电子天平,上海菁海仪器有限公司;电热恒温水槽,上海博迅实业有限公司;小型台式高速冷冻离心机,Labogene公司;电泳仪和凝胶成像系统,北京市六一仪器厂;ABI Step One Plus实时PCR系统,Life Technologies公司;Illumina NovaSeq 6000,Illumina公司。
1.2 样品处理用自来水洗净灯盏花植株后,将其分为根、茎、叶和花等4个部位,每个部位设3个重复组,分别标记为R1−R3、S1−S3、L1−L3、F1−F3。然后置于75% (体积分数)乙醇中漂洗3 min、无菌水冲洗3次后,再置于5% NaClO溶液中漂洗2 min,无菌水冲洗3次,用无菌滤纸吸干水分。利用组织印迹法和漂洗液检验法检验组织块表面消毒是否彻底和一致。样品用铝箔纸包好后,液氮冷冻保存,用于后续内生真菌总DNA的提取。
1.3 ITS文库构建及高通量测序采用HiPure Soil DNA提取试剂盒,参照说明书提取灯盏花植物样本中总DNA,用0.8%琼脂糖凝胶电泳检测其质量。选取真菌ITS1‒ITS2区进行扩增,所用引物为ITS1F (5′-CTTGGTCA TTTAGAGGAAGTAA-3′)和ITS2R (5′-GCTGCG TTCTTCATCGATGC-3′)[13]。使用Q5® High-Fidelity PCR Kit进行PCR反应。PCR反应体系:Q5 High-Fidelity 2×Master Mix 12.5 µL,正、反向引物(10 µmol/L) 1.25 µL,dNTPs终浓度200 µmol/L,DNA模板30 ng,ddH2O补足25 µL。PCR反应条件:95 ℃ 5 min;95 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,33个循环;72 ℃ 7 min。PCR扩增产物通过2%琼脂糖凝胶电泳检测,利用AxyPrep DNA凝胶提取试剂盒进行纯化,并使用ABI Step One Plus实时PCR系统进行定量。纯化后的扩增子根据标准操作在Illumina NovaSeq 6000平台上进行双端测序,由广州基迪奥生物科技有限公司完成。
1.4 数据处理和分析原始数据通过FASTP v0.18.0进行过滤,去除接头序列后,采取FLASH v1.2.7软件进行拼接,参照QIIME软件分析流程过滤低质量碱基[14],基于UCHIME算法过滤嵌合体后得到高质量的reads数,采用UPARSE (v9.2.64)按≥97%相似度聚类为OTU。使用R语言ggplot2包(v2.2.1)绘制物种丰度堆叠图、稀释曲线和秩-丰度(rank abundance)曲线。分别通过R语言pheatmap包(v1.0.12)、Venn Diagram包(v1.6.16)绘制物种丰度热图和韦恩图。选择QIIME v1.9.1计算Shannon指数、Simpson指数、Chao1指数和ACE指数。基于OTU和物种丰度表,借助R语言Vegan包(v2.5.3)进行基于Unweighted UniFrac距离的主坐标分析(principal coordinates analysis, PCoA)。FUNGuild v1.0用于推断内生真菌的生态营养型和功能型[15]。测序原始数据已上传至NCBI,项目编号为PRJNA901262。
2 结果与分析 2.1 灯盏花内生真菌测序结果分析来自灯盏花4个不同组织共计12个样品进行ITS序列的高通量测序,共获得raw reads 1 553 799对(表 1)。原始下机数据进行双端拼接、质量控制和嵌合体过滤后进行高质量数据统计,共获得1 549 371对clean reads。经过overlap组装共获得原始tags数目为1 370 251,质控去除嵌合体后获得高质量tags数目为1 361 589,样本有效数据在78.14−93.75之间,序列读长分布在211−474 bp之间。测序数据Q20值不低于90.98%,样本的GC含量在43.90%−47.22%之间(表 1)。
| Sample | Raw reads | Clean reads | Raw tags | Clean tags | Q20 (%) | GC content (%) |
| F-1 | 134 496 | 134 186 | 118 109 | 117 420 | 94.24 | 44.89 |
| F-2 | 129 738 | 129 458 | 115 722 | 115 074 | 94.67 | 44.01 |
| F-3 | 132 601 | 132 295 | 120 541 | 119 913 | 95.36 | 44.54 |
| L-1 | 120 257 | 119 878 | 101 058 | 100 416 | 92.98 | 47.15 |
| L-2 | 132 481 | 132 238 | 120 517 | 120 070 | 95.24 | 47.22 |
| L-3 | 136 268 | 135 847 | 115 914 | 115 270 | 93.32 | 46.95 |
| R-1 | 120 539 | 120 394 | 113 183 | 112 618 | 96.29 | 46.89 |
| R-2 | 137 132 | 136 919 | 129 026 | 128 513 | 96.35 | 46.17 |
| R-3 | 121 651 | 121 448 | 114 792 | 114 204 | 96.24 | 45.19 |
| S-1 | 126 281 | 125 581 | 103 602 | 102 872 | 92.05 | 45.67 |
| S-2 | 136 002 | 135 493 | 118 249 | 117 535 | 93.76 | 43.90 |
| S-3 | 126 353 | 125 634 | 99 538 | 98 781 | 90.98 | 45.72 |
| F、L、R和S分别表示花、叶、根、茎;-1、-2和-3表示3个重复样品 F, L, R and S represent flowers, leaves, roots and stems, respectively; -1, -2, and -3 represent triplicate samples. |
||||||
样本稀释曲线间接反映样本中物种的丰富程度,如图 1所示为灯盏花不同组织样品稀释曲线,各曲线表现为先急剧上升,之后随着测序量的增加趋于平缓,表明各样品物种测序量趋于饱和,测序深度已基本覆盖样品中的所有物种。
|
| 图 1 灯盏花内生真菌稀释曲线图 F、L、R、S分别表示花、叶、根、茎;Sobs:实际观测到的物种数目 Figure 1 Rarefaction curve of endophytic fungal communities in Erigeron breviscapus. F, L, R and S represent flowers, leaves, roots and stems, respectively; Sobs: Observed species. |
|
|
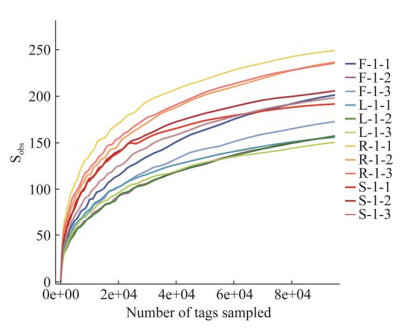
Rank-abundance曲线可直观反映样本物种多度和均匀度。图 2结果显示,灯盏花根和茎样品曲线相较其叶和花的曲线范围较宽且较平缓,提示灯盏花根和茎中内生真菌丰度大于叶和花,且物种分布比较均匀。
|
| 图 2 灯盏花内生真菌物种Rank-abundance曲线图 F、L、R、S分别表示花、叶、根、茎 Figure 2 Rank-abundance curve of endophytic fungal communities in Erigeron breviscapus. F, L, R and S represent flowers, leaves, roots and stems, respectively. |
|
|
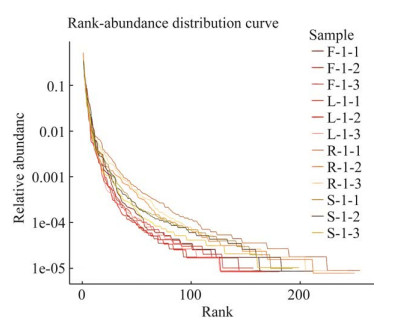
为探究灯盏花不同组织部位内生真菌的OTU共有和独有情况,通过维恩图分析发现,12个样品共得到540个OTU,其中4个组织共有OTU数目为78个,花、叶、根和茎组织中特有的OTU数目分别为75、26、148和87个(图 3)。提示灯盏花不同组织器官中内生真菌OTU组成存在一定差异。各组织特有属方面,4个组织共有属为52个,花、叶、根和茎组织中特有属分别为21、4、26和17个。已知属中,花中独有布勒掷孢酵母属(Bullera)、球腔菌属(Mycosphaerella)和Hormonema这3个菌属,叶中独有淡领瓶霉属(Cadophora)、胶被盘菌属(Crocicreas)这2个菌属,根中独有Dactylonectria、Thaumatomonas和圆孢霉属(Staphylotrichum)这3个菌属,茎中独有葡萄座腔菌属(Neofusicoccum)、斯氏格孢属(Spegazzinia)和栓菌属(Trametes)这3个菌属。这些菌属相对丰度均 < 1%。
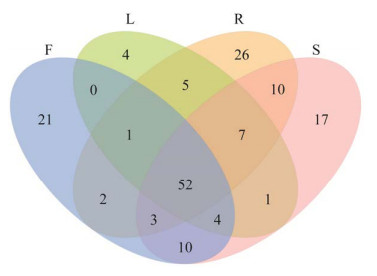
|
| 图 3 灯盏花不同组织OTU分布Venn图 F、L、R、S分别表示花、叶、根、茎 Figure 3 Venn diagram describing the OTUs distribution across Erigeron breviscapus and their tissues. F, L, R and S represent flowers, leaves, roots and stems, respectively. |
|
|
进一步将各组织部位的OTU代表序列进行群落组成分析,这些序列分属于5个门22个纲55个目114个科188个属。从物种分布堆叠图来看,在门水平上(图 4A),灯盏花不同组织的内生真菌占优势的均为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),但存在组织差异。子囊菌门真菌在灯盏花的根中平均相对丰度高达92.99%,而在花中平均相对丰度仅占31.62%。担子菌门真菌在灯盏花的花中平均相对丰度达68.33%,而在根中平均相对丰度仅为4.86%。除根中未分类的群落平均相对丰度达1.66%外,其余门平均相对丰度均小于1%。
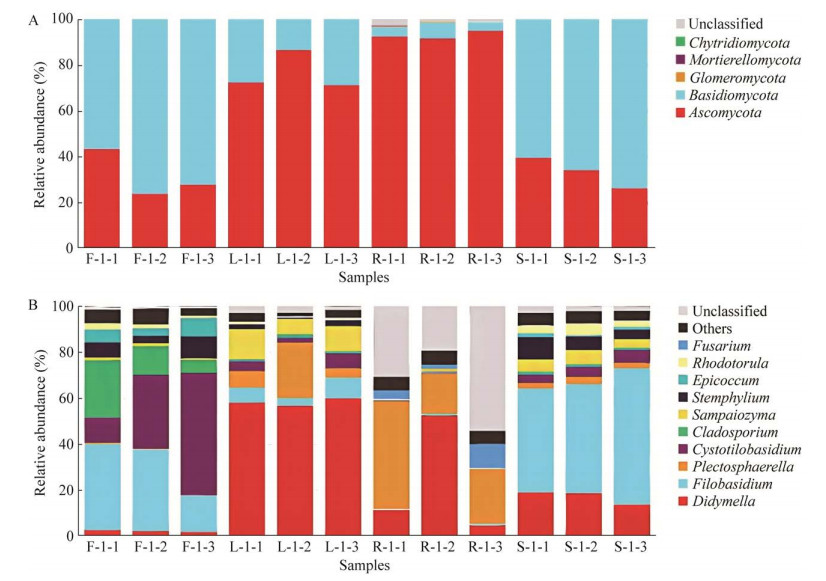
|
| 图 4 灯盏花内生真菌群落在门(A)和属(B)水平上的分布 F、L、R、S分别表示花、叶、根、茎 Figure 4 Distribution of endophytic fungal communities at phylum (A) and genus (B) levels in Erigeron breviscapus. F, L, R and S represent flowers, leaves, roots and stems, respectively. |
|
|
在属水平上(图 4B),灯盏花植物花中内生真菌优势属为Cystofilobasidium (32.50%)、线黑粉菌属(Filobasidium, 29.36%)。在叶中优势属为亚隔孢壳属(Didymella, 58.12%)、织球壳属(Plectosphaerella, 11.59%)。根中优势属则为未分类菌属(Unclassified, 34.87%)、织球壳属(29.19%)、亚隔孢壳属(22.83%)。茎中优势属为线黑粉菌属(50.41%)、亚隔孢壳属(17.13%)。从图 4B可直观地看出,亚隔孢壳属在各个组织均有分布,但主要定殖在灯盏花叶组织中。线黑粉菌属则主要定殖于花和茎组织中,而Cystofilobasidium主要定殖于花组织中。织球壳属主要定殖于根和叶组织中,这些菌属均呈现出明显的组织偏好。
选取内生真菌相对丰度Top30的属绘制物种分布热图并进行聚类分析(图 5),结果显示在属水平上,叶与茎样品可聚为一类,表现出相似的群落结构,而根样品则相对独立,群落结构与其他组织存在差异。
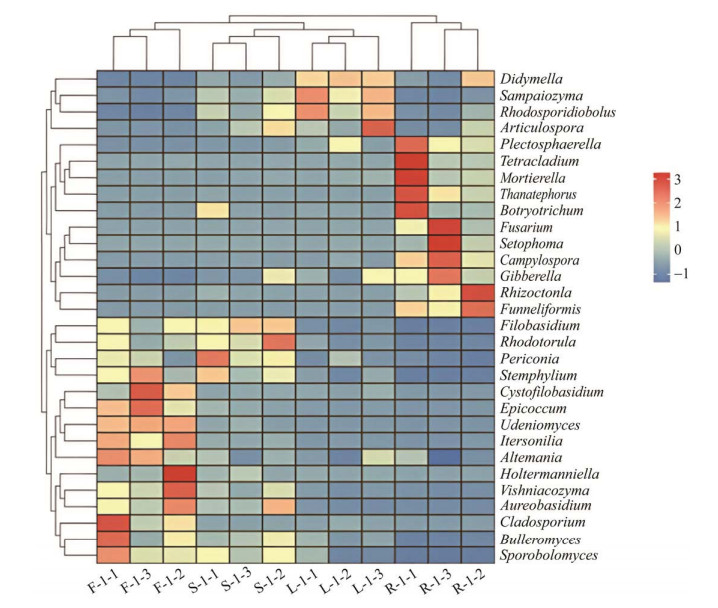
|
| 图 5 灯盏花内生真菌在属水平上的群落结构分布热图 F、L、R、S分别表示花、叶、根、茎 Figure 5 Heatmap of endophytic fungal communities at genus level in Erigeron breviscapus. F, L, R and S represent flowers, leaves, roots and stems, respectively. |
|
|
对灯盏花植物各组织中的内生真菌群落进行α多样性分析,Chao1指数和ACE指数主要反映物种的丰度,而Shannon指数和Simpson指数综合体现物种的丰度和均匀度,数值越大,多样性越高。采用Tukey HSD (Tukey’s honestly significant difference)检验对各指数进行多重比较,并通过绘制盒型图分析(图 6)。结果显示,花、茎和叶间的ACE指数及Chao1指数无显著差异(P > 0.05),而根的ACE指数及Chao1指数明显高于花、茎、叶(P < 0.05)。比较4个组织的Shannon指数和Simpson指数,结果无显著差异(P > 0.05)。提示根部内生真菌丰度明显高于其他组织,但根、茎、叶和花各组织间的多样性差异不显著。
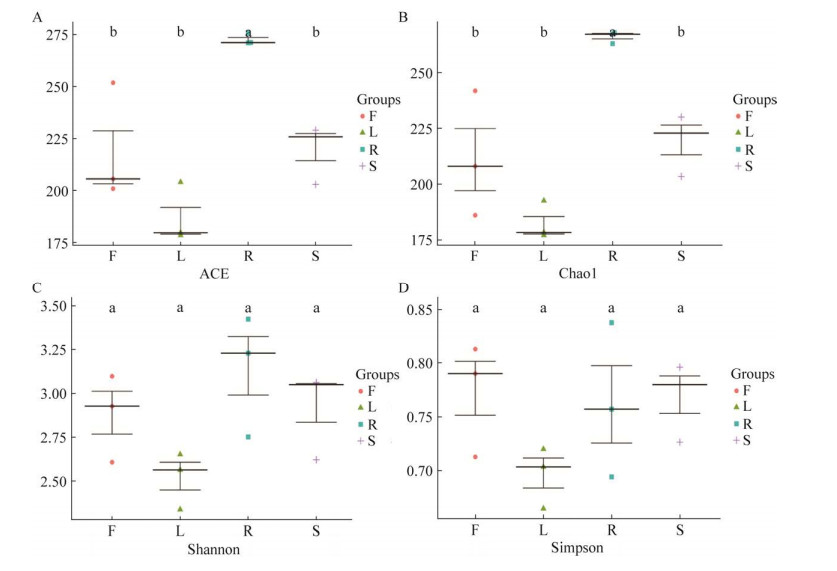
|
| 图 6 灯盏花内生真菌群落的α多样性分析 F、L、R、S分别表示花、叶、根、茎,不同小写字母表示多重比较Tukey HSD检验在0.05水平上存在显著差异,字母相同表示差异无显著性 Figure 6 Alpha diversity index of endophytic fungal communities in Erigeron breviscapus. F, L, R and S represent flowers, leaves, roots and stems, respectively. Different lowercases indicate that there are significant differences in Tukey HSD test at 0.05 level. The same letter means no significant difference. |
|
|
为深入理解不同组织样本群落组成的差异性,在OTU水平进行主坐标分析(PCoA),通过降维方式寻找复杂样本中的主要样本差异距离(图 6)。本研究基于样本间的Unweighted UniFrac数据结果绘制了PCoA图。结果显示,第一主轴(PCo1)和第二主轴(PCo2)分别解释了OTU水平真菌群落结构变化的25.46%和18.47%,两个主轴合计解释了43.93%的方差贡献率(图 7)。四个组织样品分布于第1、2、3象限中,叶与茎样品相对聚集于第3象限,而根样品明显聚集于第1象限,提示叶、茎两个组织中内生真菌菌群种类相似程度较高,而根样品与其他组织样品菌群种类差异较大,群落结构相对独立。
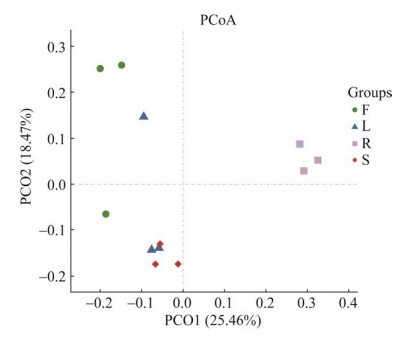
|
| 图 7 灯盏花内生真菌群落PCoA分析 F、L、R、S分别表示花、叶、根、茎 Figure 7 The PCoA analysis of endophytic fungal communities in Erigeron breviscapus. F, L, R and S represent flowers, leaves, roots and stems, respectively. |
|
|
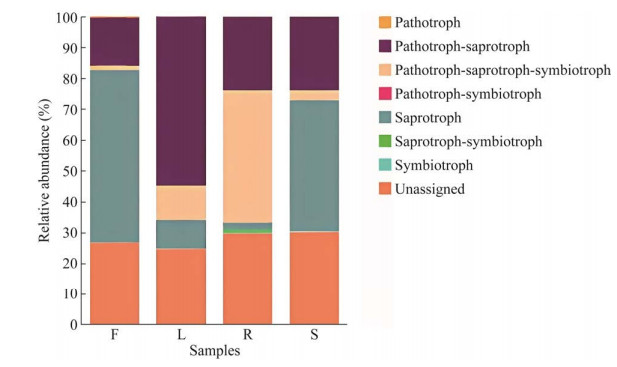
基于FUNGuild对灯盏花不同组织内生真菌群落进行功能预测分析。如图 8所示,灯盏花不同组织中均存在一定比例的未分类菌落(unassigned),其平均相对丰度占比由高到低分别为茎(30.05%) > 根(29.68%) > 花(26.62%) > 叶(24.58%)。其次,在各组织中平均相对丰度均超过10%的功能群还有病理-腐生营养型(pathotroph-saprotroph),其平均相对丰度占比由高到低分别为叶(54.84%) > 茎(23.90%) > 根(23.83%) > 花(15.54%);而腐生营养型功能群(saprotroph)在花和茎样品中占有相对较高的比例,其平均相对丰度分别达55.97%和42.73%。此外,病理-腐生-共生营养型功能群(pathotroph-saprotroph-symbiotroph)在根和叶样品中平均相对丰度分别为42.77%和11.00%。其余营养功能类群在各组织中占比均较低,其平均相对丰度≤1%。
|
| 图 8 灯盏花内生真菌营养型组成 F、L、R、S分别表示花、叶、根、茎 Figure 8 Trophic modes of endophytic fungal communities in Erigeron breviscapus. F, L, R and S represent flowers, leaves, roots and stems, respectively. |
|
|
对各组织样品中平均相对丰度超过1%的功能菌群进行详细的物种生态功能预测分类。如图 9所示,与前面分析结果一致,在灯盏花植物各组织中均存在相当比例的未分类菌落(unassigned)。灯盏花内生真菌中已鉴定出的主要生态功能菌是动物病原菌-植物病原菌-未定义腐生真菌(animal pathogen-plant pathogen- undefined saprotroph),在各组织中均有分布,且以叶组织为主,其优势类群为亚隔孢壳属。具有未定义腐生真菌(undefined saprotroph)生态功能的线黑粉菌属,主要分布于花和茎中。具有动物病原菌-内生菌-真菌寄生虫-植物病原菌-木质腐生菌(animal pathogen-endophyte-fungal parasite- plant pathogen-wood saprotroph)生态功能的织球壳属主要分布于叶和根中。值得注意的是,具有叶腐生菌(leaf saprotroph)功能的菌群为Cystofilobasidium,主要分布于花中,虽叶中也有定殖,但平均相对丰度仅有3.74%。其余生态功能群平均相对丰度占比均未超过10%。

|
| 图 9 灯盏花内生真菌群落FUNGuild详细分类 F、L、R、S分别表示花、叶、根、茎 Figure 9 FUNGuild detailed classification of endophytic fungal communities in Erigeron breviscapus. F, L, R and S represent flowers, leaves, roots and stems, respectively. |
|
|
云南是我国生物多样性最丰富的地区之一,其中蕴藏许多珍稀、特有、古老的珍贵菌群。本研究所用灯盏花采自云南省灯盏花主产地红河州。该地区处于北回归线上,独特的土壤环境和气候条件较适合种植出高质量的灯盏花药材。“红河灯盏花”已被列为中国国家地理标志产品。该药用植物中蕴含的内生真菌生物多样性、群落结构及生态功能具有重要的研究价值。
灯盏花多样性方面,从Rank-abundance曲线来看,灯盏花中内生真菌群落在根和茎中相对丰富且分布均匀。从OTU注释的物种共有和独有情况来看,4个不同药用部位共有的OTU数目仅占14.45%,而根部位的独有OTU数目最多。与该结果一致,PCoA分析结果表明,根部位的内生真菌群落结构与其他组织相比具有明显差异。叶与茎组织的内生真菌群落组成则存在一定程度的相似性。这可能是由于地上部分与地下部分定殖环境不同,造成根部内生真菌群落结构相对独立[16]。另一方面,从植物解剖学来看,叶与茎密切相连,形成了相似的定殖环境,而叶与茎进化关系密切可能是内生真菌群落来源相近的原因之一。多样性方面,α多样性分析表明,根的ACE指数及Chao1指数明显高于花、茎、叶,提示根部内生真菌丰度高于其他地上部分。与本研究结果类似,前期基于传统分离培养法发现从灯盏花根部位中分离获得的内生真菌种群和数量均最多[7, 9]。这可能与根部周围环境有关,在根和土壤之间的交界处存在许多凋落物(腐叶、枯枝)以及根际分泌物(rhizosphere exudates),它们为根际周围的真菌提供充足的碳、氮和微量元素,有利于内生真菌的定殖与繁衍[17]。
植物内生真菌群落结构受宿主种属、植物组织器官及土壤类别、气候海拔等环境因素影响而呈现多样性[18]。在诸多因素中,植物组织器官在决定群落结构组成上具有重要意义[19]。本研究中,灯盏花内生真菌群落组成分析表明,不同灯盏花组织样品中,内生真菌优势门、属和特有属不同,具有一定的组织特异性(图 4)。与此结果一致,可培养法分离到的灯盏花内生真菌种群数量分布也呈现组织专一性[7, 9]。所不同的是,可培养的灯盏花内生真菌群落中分离到5个目7个科22个属的内生菌,其中交链孢属(Alternaria)、镰孢霉属(Fusarium)为灯盏花内生真菌优势菌属[7, 9]。本研究共注释到55个目114个科188个属的内生菌,注释到的内生菌种群数量远大于可培养的灯盏花内生真菌群落。其中优势属则为亚隔孢壳属、线黑粉菌属和织球壳属。尽管我们在灯盏花各组织样本中均注释到Alternaria和Fusarium,但其平均相对丰度均小于10%。这可能是由于高通量测序能探测到的生境物种丰富,两种菌属在物种组成中的占比受到稀释所致。
FUNGuild关注真菌的营养策略,可以从复杂群落分类中提取出更易处理和理解的生态单位。该生态单位根据营养类型划分,将采用相同营养方式的相关或不相关物种归为一类。本研究中,FUNGuild功能预测结果显示,灯盏花不同组织样品以各种类型的腐生真菌为主要营养功能类群。与该研究结果一致,Wang等[20]评价了中国西北药用植物苦豆子(Sophora alopecuroides)的内生真菌多样性,发现这些内生菌可分为15个生态功能群,其中腐生真菌占绝对优势。为适应复杂多变的生存环境,真菌在植物的不同时期可采用多种生活方式,包括腐生、内生和病原等[20-21]。它们之间的角色转换关系有待深入研究。高通量测序还发现灯盏花各组织中存在大量的未知功能群,其相对丰度均 > 10%,以茎和根中最多。其中可能蕴含新的物种和珍贵的菌种资源,有待进一步挖掘。
此外,我们还在灯盏花植物中,发现了一些其他内生菌属。如在各组织中均有分布且主要分布在叶组织中的优势类群亚隔孢壳属。进一步分析发现,该物种注释到种水平为Didymella bellidis。亚隔孢壳属大多数真菌是关键的植物病原菌,在植物病理学研究方面具有重要的研究价值。近年来研究表明,D. bellidis可致雏菊(Bellis perennis)、茶树(Camellia sinensis)、当归(Angelica gigas)等多种植物发生叶斑病[22-24]。关于灯盏花叶斑病病原菌,目前普遍认为是由链格孢属的细交链孢(Alternaria alternata)侵染所致[25]。本研究在灯盏花各组织中发现了亚隔孢壳属,其是否是灯盏花叶斑病的潜在病原菌有待深入研究。
灯盏花植物主要有效成分以黄酮类化合物为主,以灯盏花乙素又名野黄芩苷(scutellarin)为代表。本研究中,线黑粉菌属为灯盏花植物花和茎样品的优势属。Su等[26]从陈皮中分离出一株担子菌酵母菌Filobasidium magnum,其发酵液能将川陈皮素(nobiletin)代谢生成黄酮类物质。线黑粉菌属在灯盏花乙素(scutellarin)代谢网中的作用值得继续探究。以上研究为灯盏花病虫害防治、植物资源保护提供了新的研究视角,同时为筛选获得高效的产黄酮内生真菌珍贵菌株提供了线索。
| [1] |
TRIVEDI P, LEACH JE, TRINGE SG, SA TM, SINGH BK. Plant-microbiome interactions: from community assembly to plant health[J]. Nature Reviews Microbiology, 2020, 18(11): 607-621. DOI:10.1038/s41579-020-0412-1 |
| [2] |
DELAUX PM, SCHORNACK S. Plant evolution driven by interactions with symbiotic and pathogenic microbes[J]. Science, 2021, 371(6531): eaba6605. DOI:10.1126/science.aba6605 |
| [3] |
KHATTAB AR, FARAG MA. Marine and terrestrial endophytic fungi: a mine of bioactive xanthone compounds, recent progress, limitations, and novel applications[J]. Critical Reviews in Biotechnology, 2022, 42(3): 403-430. DOI:10.1080/07388551.2021.1940087 |
| [4] |
ZHENG RH, LI SJ, ZHANG X, ZHAO CQ. Biological activities of some new secondary metabolites isolated from endophytic fungi: a review study[J]. International Journal of Molecular Sciences, 2021, 22(2): 959. DOI:10.3390/ijms22020959 |
| [5] |
GÓMEZ OC, LUIZ JHH. Endophytic fungi isolated from medicinal plants: future prospects of bioactive natural products from Tabebuia/Handroanthus endophytes[J]. Applied Microbiology and Biotechnology, 2018, 102(21): 9105-9119. DOI:10.1007/s00253-018-9344-3 |
| [6] |
FAN H, LIN P, KANG Q, ZHAO ZL, WANG J, CHENG JY. Metabolism and pharmacological mechanisms of active ingredients in Erigeron breviscapus[J]. Current Drug Metabolism, 2021, 22(1): 24-39. DOI:10.2174/1389200221666201217093255 |
| [7] |
LI ZY, YANG LY, ZHOU B, LI SL, CHEN YW, ZHANG Q. Study on endophytic fungi in Erigeron breviscapus Ⅰ: isolation and identification of endophytic fungi[J]. Journal of Yunnan University (Natural Sciences Edition), 2003, 25(1): 65-68. (in Chinese) 李治滢, 杨丽源, 周斌, 李绍兰, 陈有为, 张琦. 灯盏细辛内生真菌的研究Ⅰ: 菌种分离及其分类鉴定[J]. 云南大学学报(自然科学版), 2003, 25(1): 65-68. DOI:10.3321/j.issn:0258-7971.2003.01.017 |
| [8] |
HE YM, ZHAN FD, XUAN L, ZU YQ, GAO ZH, LI Y. Selection and flavonoid producing capacity of endophytic fungi isolated from Erigeron breviscapus[J]. Journal of Agro-Environment Science, 2010, 29(S1): 226-229. (in Chinese) 何永美, 湛方栋, 宣灵, 祖艳群, 高召华, 李元. 灯盏花产黄酮内生真菌的筛选及其产黄酮能力的初步研究[J]. 农业环境科学学报, 2010, 29(增刊1): 226-229. |
| [9] |
YANG ML, LAI YH, GUO FG, CUI XL, WANG YX, XIAO W, LI ZY. Isolation and selection of flavones-forming endophytic fungi from Erigeron breviscapus[J]. Southwest China Journal of Agricultural Sciences, 2018, 31(2): 318-321. (in Chinese) 杨梦莉, 赖泳红, 郭凤根, 崔晓龙, 王永霞, 肖炜, 李治滢. 灯盏花内生真菌分离及其产黄酮内生真菌的初步研究[J]. 西南农业学报, 2018, 31(2): 318-321. DOI:10.16213/j.cnki.scjas.2018.2.017 |
| [10] |
RINKE C, SCHWIENTEK P, SCZYRBA A, IVANOVA NN, ANDERSON IJ, CHENG JF, DARLING A, MALFATTI S, SWAN BK, GIES EA, DODSWORTH JA, HEDLUND BP, TSIAMIS G, SIEVERT SM, LIU WT, EISEN JA, HALLAM SJ, KYRPIDES NC, STEPANAUSKAS R, RUBIN EM, et al. Insights into the phylogeny and coding potential of microbial dark matter[J]. Nature, 2013, 499(7459): 431-437. DOI:10.1038/nature12352 |
| [11] |
SAGITA R, QUAX WJ, HASLINGER K. Current state and future directions of genetics and genomics of endophytic fungi for bioprospecting efforts[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9: 649906. DOI:10.3389/fbioe.2021.649906 |
| [12] |
U'REN JM, RIDDLE JM, MONACELL JT, CARBONE I, MIADLIKOWSKA J, ARNOLD AE. Tissue storage and primer selection influence pyrosequencing-based inferences of diversity and community composition of endolichenic and endophytic fungi[J]. Molecular Ecology Resources, 2014, 14(5): 1032-1048. DOI:10.1111/1755-0998.12252 |
| [13] |
GRAPER AL, NOYSZEWSKI AK, ANDERSON NO, SMITH AG. Variability in ITS1 and ITS2 sequences of historic herbaria and extant (fresh) Phalaris species (Poaceae)[J]. BMC Plant Biology, 2021, 21(1): 515. DOI:10.1186/s12870-021-03284-z |
| [14] |
CAPORASO JG, KUCZYNSKI J, STOMBAUGH J, BITTINGER K, BUSHMAN FD, COSTELLO EK, FIERER N, PEÑA AG, GOODRICH JK, GORDON JI, HUTTLEY GA, KELLEY ST, KNIGHTS D, KOENIG JE, LEY RE, LOZUPONE CA, MCDONALD D, MUEGGE BD, PIRRUNG M, REEDER J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [15] |
NGUYEN NH, SONG ZW, BATES ST, BRANCO S, TEDERSOO L, MENKE J, SCHILLING JS, KENNEDY PG. FUNGuild: an open annotation tool for parsing fungal community datasets by ecological guild[J]. Fungal Ecology, 2016, 20: 241-248. DOI:10.1016/j.funeco.2015.06.006 |
| [16] |
ZHOU J, MIAO YF, FANG K, CHEN L, YANG ZP, DONG XF, ZHANG HB. Diversity of the endophytic and rhizosphere soil fungi of Ageratina adenophora[J]. Ecological Science, 2019, 38(5): 1-7. (in Chinese) 周婕, 苗一方, 方楷, 陈林, 杨志平, 董星凡, 张汉波. 紫茎泽兰内生真菌及其根际土壤真菌的多样性研究[J]. 生态科学, 2019, 38(5): 1-7. DOI:10.14108/j.cnki.1008-8873.2019.05.001 |
| [17] |
CHEN M, CHEN JZ, LIU JM, WU MY, YAN Q, LI P, HUANG LT, XIAO XF. Diversity analysis of rhizosphere soil fungi and endophytic fungi in Ampelocalamus luodianensis[J]. Acta Ecologica Sinica, 2021, 41(10): 4120-4130. |
| [18] |
ZHAO Y, XIONG Z, WU GL, BAI WX, ZHU ZQ, GAO YH, PARMAR S, SHARMA VK, LI HY. Fungal endophytic communities of two wild Rosa varieties with different powdery mildew susceptibilities[J]. Frontiers in Microbiology, 2018, 9: 2462. DOI:10.3389/fmicb.2018.02462 |
| [19] |
SIDDIQUE AB, BIELLA P, UNTERSEHER M, ALBRECTSEN BR. Mycobiomes of young beech trees are distinguished by organ rather than by habitat, and community analyses suggest competitive interactions among twig fungi[J]. Frontiers in Microbiology, 2021, 12: 646302. DOI:10.3389/fmicb.2021.646302 |
| [20] |
WANG RT, ZHANG QC, JU MX, YAN SY, ZHANG QQ, GU PW. The endophytic fungi diversity, community structure, and ecological function prediction of Sophora alopecuroides in Ningxia, China[J]. Microorganisms, 2022, 10(11): 2099. DOI:10.3390/microorganisms10112099 |
| [21] |
ARNOLD AE, LUTZONI F. Diversity and host range of foliar fungal endophytes: are tropical leaves biodiversity hotspots?[J]. Ecology, 2007, 88(3): 541-549. DOI:10.1890/05-1459 |
| [22] |
CHEN Q, JIANG JR, ZHANG GZ, CAI L, CROUS PW. Resolving the Phoma enigma[J]. Studies in Mycology, 2015, 82: 137-217. DOI:10.1016/j.simyco.2015.10.003 |
| [23] |
LEE DH, CHOI KM, JUNG CR, LEE SH. First report of Didymella bellidis causing leaf spots on Angelica gigas in Korea[J]. Journal of Plant Pathology, 2020, 102(4): 1297. DOI:10.1007/s42161-020-00576-5 |
| [24] |
WANG X, WU X, JIANG SL, YIN QX, LI DX, WANG Y, WANG DL, CHEN Z. Whole genome sequence and gene annotation resource for Didymella bellidis associated with tea leaf spot[J]. Plant Disease, 2021, 105(4): 1168-1170. DOI:10.1094/PDIS-05-20-0939-A |
| [25] |
LIN LF, HU XQ, LIU CG. Isolation and identification of the pathogens causing leaf rot disease of Erigeron breviscapus[J]. Plant Protection, 2006, 32(4): 92-93. (in Chinese) 林丽飞, 胡先奇, 刘春国. 灯盏花叶斑病病原物的分离及鉴定[J]. 植物保护, 2006, 32(4): 92-93. |
| [26] |
SU SW, ZHAO DG, YUAN B, MA YY, ZHU SY, XU KY, LEE G, HO CT, HUANG QR. Biosynthesis of 6- and 7-mono-demethylated nobiletins by a newly isolated strain of yeast[J]. Journal of Agricultural and Food Chemistry, 2022, 70(49): 15439-15448. DOI:10.1021/acs.jafc.2c03822 |
 2023, Vol. 50
2023, Vol. 50