
扩展功能
文章信息
- 李哲, 张豪, 霍雪雪, 黄艳华, 郝永任
- LI Zhe, ZHANG Hao, HUO Xuexue, HUANG Yanhua, HAO Yongren
- 产褪黑素绿色木霉工程菌的构建及生理特性分析
- Construction and characterization of melatonin-producing engineering strain of Trichoderma viride
- 微生物学通报, 2023, 50(1): 148-162
- Microbiology China, 2023, 50(1): 148-162
- DOI: 10.13344/j.microbiol.china.220399
-
文章历史
- 收稿日期: 2022-04-19
- 接受日期: 2022-05-12
- 网络首发日期: 2022-05-31
2. 中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室, 北京 100085
2. State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
褪黑素(melatonin),学名N-乙酰基-5-甲氧基色胺,又称松果体素,是动植物体内广泛存在的一种小分子生物胺类物质,具有重要的生理作用。褪黑素在人体和动物体内的含量极少,只有pg/mL水平,但生理作用十分重要[1],主要作用有调节昼夜节律[2]、缓解睡眠障碍、抗氧化、抗衰老、抗肿瘤[3]等。褪黑素在植物体中也广泛存在,其含量分布差异巨大,从pg/g到μg/g都有分布,但一般含量高于人体和动物体,其在植物中的主要作用包括促进植物生长、侧根形成[4-7]及提高环境耐受性等,褪黑素在植物体内可以作为一种信号分子,调节逆境胁迫对植物的影响[8]。有研究报道在细菌、真菌和藻类中也存在褪黑素[9-11]。
动物中褪黑素的合成主要在松果体细胞中合成,其合成的前体物是色氨酸[12]。松果体细胞从血液中摄取色氨酸,在色氨酸羧化酶(tryptophan hydroxylase, TPH)、5-羟色氨酸脱羧酶(5-hydroxytryptophan decarboxylase, 5-HTPDC)、芳烷基胺N-乙酰转移酶(aralkylamine N-acetyltransferase, AANAT)[13]、乙酰复合胺-O-甲基转移酶(acetylserotonin O-methyltransferase, ASMT)等一系列酶的作用下,经过羟化、脱羧、N-乙酰化和氧甲基化,最终形成褪黑素。褪黑素在植物中的合成和在动物中类似,也是由植物中的色氨酸生物合成的[14]。首先通过色氨酸脱羧酶(tryptophan decarboxylase, TDC)和5-羟化酶将色氨酸转化为色胺和5-羟色氨酸。然后分别通过色胺5-羟化酶和氨基酸脱羧酶作用将色胺和5-羟色氨酸转化为5-羟色胺(serotonin)[15-16],5-羟色胺再通过5-羟色胺-N-乙酰转移酶转变为N-乙酰羟色胺,最终通过ASMT的甲基化作用将N-乙酰羟色胺合成为褪黑素[17-20]。
有研究发现,经酿酒酵母发酵后葡萄酒中褪黑素大量产生,但用于发酵的葡萄浆却并未检出褪黑素的存在,表明了酿酒酵母与褪黑素之间关系密切。在发酵的整个过程中,褪黑素存在先升后降的趋势,这个趋势与酵母的生长曲线有关联,推断褪黑素与酵母的生长代谢关系密切,可能是作为一种信号分子参与酵母的生长代谢[21]。有研究者以酿酒酵母为宿主细胞,通过异源表达哺乳动物体内褪黑素合成相关的酶,重构了褪黑素合成路线。
木霉(Trichoderma)是一类重要的多功能丝状真菌,种类众多[22],是农业生产中重要的生防菌株和植物促生菌株,也是工业生产中重要的酶和代谢产物的工程菌。木霉产生的次级代谢产物种类繁多,具有各种各样的生物活性。目前已从木霉代谢产物中分离出了180余种化合物[23],例如聚酮类化合物[24-25]、蒽醌(萜类)、氨基酸及其衍生物等。其在农药、医药、食品等领域有广泛的开发应用前景,例如开发为杀菌剂、除草剂、杀虫剂及抗肿瘤药物等。然而,目前尚无木霉代谢合成褪黑素的报道,在其菌体和发酵液内也未检测到褪黑素。绿色木霉(Trichoderma viride) Tv-1511是我们前期分离鉴定的一株具有良好植物促生和生物防治功能的优势菌株[26-27],其菌剂与生物肥料已获授权国家发明专利(ZL201910626525.9)[28],同时该菌株也已完成了全基因组精细图谱的绘制[DDBJ/ENA/GenBank (accession No: VCEC00000000; BioProject ID:PRJNA543939; BioSample accession: SAMN11791795)]和功能基因的鉴定。我们在Tv-1511基因组中鉴定出了褪黑素合成途径中的关键基因,包括色氨酸合成酶(tryptophan synthase, TvTRPS)、色氨酸羟化酶(tryptophan hydroxylase, TvTPH)、色氨酸脱羧酶(l-tryptophan decarboxylase, TvTDC)的编码基因,但是未发现AANAT和ASMT的编码基因。因此,通过引入外源AANAT和ASMT基因可能是实现木霉合成褪黑素的可能途径。
木霉具有发酵周期短、培养条件简单、反应条件温和、不涉及有毒有害的化学试剂、发酵产物易于下游分离的特点,同时能够实现高密度发酵,产物合成效率高,是优良的宿主表达系统和良好的异源蛋白生物反应器。利用基因组分析和基因工程技术,调控木霉中重要代谢产物的表达是提高木霉抗逆性、促生能力的有效途径。构建筛选能够合成褪黑素的木霉工程菌株,可为促进生物肥料的研发等提供出发菌株,也可为褪黑素的工业化生产提供优良底盘,对促进木霉菌在农业和工业生产中的应用具有重要意义。
1 材料与方法 1.1 材料 1.1.1 样品绿色木霉(Trichoderma viride) Tv-1511,本实验室分离保存,在中国普通微生物菌种保藏中心的保藏号为CGMCC 16800。
质粒pCAMBIA1303-Hygro和pCAMBIA1303- Ble由pCAMBIA1303质粒改造而来。供试植物为小麦(济麦22)和黄瓜(津研四号)。
1.1.2 培养基PDA培养基(g/L):马铃薯浸粉6.0,葡萄糖20.0,琼脂20.0。LB培养基(g/L):胰蛋白胨10.0,酵母浸粉5.0,氯化钠10.0,琼脂15.0。
1.1.3 主要试剂和仪器潮霉素、氨苄青霉素、Hoagland营养液、溶解酶和褪黑素标准品,Merck/Sigma-Aldrich公司;限制性内切酶Spe Ⅰ和BstE Ⅱ,NEB公司;高保真PCR聚合酶预混液2×Phanta Master Mix、DNA回收试剂盒FastPure Gel DNA Extraction Mini Kit,南京诺唯赞生物科技股份有限公司。溶液Ⅰ:1.2 mol/L d-sorbitol,0.1 mol/L KH2PO4,pH 5.6。溶解酶液:取0.15 g溶解酶溶于20 mL溶液Ⅰ,0.22 μm滤膜过滤除菌。溶液Ⅱ:1 mol/L sorbitol,50 mmol/L CaCl2,10 mmol/L Tris-HCl,pH 7.5。Polyethylene glycol (PEG)溶液:25% PEG600,50 mmol/L CaCl2,10 mmol/L Tris-HCl,pH 7.5。
温度梯度PCR仪,Applied Biosystems公司;冷冻离心机,Eppendorf公司;高效液相色谱仪,Agilent公司;电泳仪,Tanon公司;凝胶成像仪,Gensens公司。
1.2 方法 1.2.1 hAANAThAaNAT和hASMT基因序列的克隆及表达载体的构建(1) hAANAThAaNAT和hASMT基因表达盒的克隆
在NCBI GenBank中查询hAANAThAaNAT (gene ID: 15)和hASMT (gene ID:438)的基因序列,用化学合成的方法获得密码子优化后的hAANAThAaNAT和hASMT基因序列。以密码子优化后的hAANAThAANAT基因序列作为模板,采用引物hAANAThAANAT-YH-SpeI- Forward (5′-CGGACTAGTATGAGCACCCAGT CCACGCA-3′)和hAANAThAANAT-YH-BstEII- Reverse (5′-GGGTTACCTCAACACCCCGAGT TGCGTCG-3′)扩增,克隆获得带有酶切连接位点(Spe I和BstE II)的hAANAThAANAT基因表达盒;以密码子优化后的hASMThASMT基因序列作为模板,采用引物hASMThASMT-YH- SpeI-Forward (5′-CGGACTAGTATGGGCTCAT CTGAAGACCA-3′)和hASMThASMT-YH-BstEII- Reverse (5′-GGGTTACCTCATTTTCTCGCCAG TATGCCGT-3′)扩增克隆获得带有酶切连接位点(Spe I和BstE II)的hASMThASMT基因表达盒。
利用高保真PCR聚合酶预混液2×Phanta Master Mix进行PCR扩增,获得带有酶切连接位点(Spe I和BstE II)的hAANAT和hASMT基因表达盒;对PCR产物进行1%琼脂糖凝胶电泳,利用DNA回收试剂盒FastPure Gel DNA Extraction Mini Kit回收扩增的DNA片段;将DNA片段连接T载体,测序验证序列的正确性,获得hAANAT和hASMT基因表达盒的完整序列。
(2) DNA片段及表达载体双酶切
将回收得到的hAANAT和hASMT的基因表达盒与载体pCAMBIA1303-Hygro和pCAMBIA1303- Bleo用限制性内切酶Spe I和BstE II进行双酶切;对酶切产物进行1%琼脂糖凝胶电泳,将目的条带切胶,利用DNA回收试剂盒FastPure Gel DNA Extraction Mini Kit回收酶切后的基因表达盒和线性化的pCAMBIA1303-Hygro和pCAMBIA1303-Bleo质粒。
(3) 表达载体的构建及转化
DNA片段与表达载体的连接采用T4连接酶进行,将以上获得的hAANAT基因和hASMT基因的表达盒分别连入pCAMBIA1303-Hygro和pCAMBIA1303-Bleo线性载体中,反应体系10 μL。
取50 μL大肠杆菌DH5α感受态细胞与10 μL连接体系混匀孵育进行质粒转化,转化后涂布到含有100 μg/mL卡那霉素的LB平板上;37 ℃培养12−20 h后,挑取菌落至含有100 μg/mL卡那霉素的LB液体培养基中,37 ℃、200 r/min培养12−20 h后菌落PCR验证。
1.2.2 原生质体制备及过表达工程菌株的构建(1) 原生质体制备
接种绿色木霉Tv-1511于PDA平板,28 ℃培养10 d以产生大量新鲜分生孢子。用10 mL生理盐水(0.9% NaCl,0.05% Tween-20)洗涤菌丝表面,经玻璃绒纸过滤,去除菌丝体得到孢子悬液。在玻璃纸覆盖的PDA平板上,取200 μL孢子悬液涂布,28 ℃避光培养24 h,使PDA平板上的孢子萌发。配制溶解酶溶液:取0.15 g溶解酶溶于20 mL溶液Ⅰ,0.22 μm滤膜过滤除菌。取出PDA平板,将长有菌丝的纤维膜取出并反向贴在含有3−4 mL裂解液的平板上,28 ℃、100 r/min条件下处理100 min。在无菌超净台将平板中的纤维膜取出,确保大部分菌丝体保留在平板中,在此过程中可以用溶液Ⅰ冲洗纤维膜上残留的菌丝块,利用枪头反复吹吸液体中的菌丝块,充分释放内部的原生质体。用装有纱布的1.5 mL管过滤上述混合液,保留下层滤液并于4 ℃、2 000 r/min离心10 min,弃上清,保留底部的原生质体,加1 mL溶液Ⅰ,再次离心,弃上清。加1 mL 4 ℃预冷的溶液Ⅱ,冰上得到原生质体。用血球计数板观察计数,稀释原生质体至107个/mL。
(2) 原生质体转化及突变子筛选
冰上放置15 mL离心管,分别加入200 μL原生质悬浮液、10 μL质粒载体和50 μL PEG溶液,用枪头混匀,冰上放置20 min。加2 mL PEG溶液,轻轻混匀,常温下放置5 min。加2 mL溶液Ⅱ轻轻混匀,取2 mL混合液涂布在覆盖层析纸的含1 mol/L蔗糖PDA平板上,层析纸预先剪成条形,28 ℃避光培养24 h。将条形层析纸转导含300 μg/mL潮霉素和200 μg/mL博来霉素两种抗生素的PDA平板上,28 ℃避光培养36 h,待条形层析纸边缘长出菌落后挑取菌落,转接至新鲜的含抗生素PDA平板上,培养2 d。
转化成功获得转化子后,采用荧光定量PCR的方法检测hAANAT和hASMThASMT的转录表达,扩增引物分别为:hAANAT-qPCR- sense (5′-GAGATTCGCCACTTCCTG-3′)和hAANAT-qPCR-antisense (5′-GCATCAGTCGTTCCT TGT-3′),以及hASMT-qPCR-sense (5′-GGTCAGCCA AGTCCTCTT-3′)和hASMT-qPCR-antisense (5′-CAGCAGCGGTAAGAAGTG-3′)。
(3) 转化子的遗传稳定性测定
将转化子接种到PDA培养基上于28 ℃条件下培养,每隔7 d挑取菌落边缘成熟孢子转接一次,连续转接20次。分别取转接的第5次、第10次和第20次的培养物用于实验。
1.2.3 绿色木霉出发菌株及工程菌株Tv-1511- hAANAThAANAT/hASMThASMT发酵液中褪黑素含量的检测将200 μL木霉出发菌株和工程菌株(Tv- 1511-hAANAT/hASMThASMT)的孢子分别接种于PDB液体培养基中,28 ℃、180 r/min培养96 h,每间隔24 h取一次样。通过2层无菌纱布过滤菌丝体后,回收液体发酵液,回收的发酵液经10 000 r/min离心15 min后取上清,将上清液用0.45 μm的滤膜过滤后待用。利用高效液相色谱仪对褪黑素进行定量定性检测。采用外标峰高法检测木霉发酵液中的褪黑素含量。
1.2.4 绿色木霉出发菌株及工程菌株Tv-1511- hAANAThAANAT/hASMThASMT生长和产孢特性的分析(1) 无菌孢子的收集
接种绿色木霉出发菌株及工程菌株于PDA平板上,28 ℃培养10 d后,产生大量新鲜分生孢子;用10 mL生理盐水(0.9% NaCl, 0.05% Tween-80)洗涤菌丝表面,经玻璃绒纸过滤,去除菌丝体得到孢子悬液。用30%的甘油悬浮,充分混匀,分装到1.5 mL离心管中,标记好名称和时间,−80 ℃冻存。取一管孢子液进行活菌计数,确定孢子液的浓度。
(2) 生长和产孢特性的分析
将200 μL木霉出发菌株和工程菌株Tv-1511- hAANAThAANAT/hASMT的孢子分别接种于PDB液体培养基中,28 ℃、180 r/min培养48 h,通过2层无菌纱布过滤获得菌丝体。收集菌丝体,烘干后测定菌体生物量。
在PDA平板上活化木霉出发菌株和工程菌株Tv-1511-hAANAT/hASMThASMT,28 ℃避光培养48−72 h,使得出发菌株和突变工程菌株长势均一,再使用打孔器制备大小均一的菌块并转移到含有PDA平板中央。将接有菌块的平板置于28 ℃培养10 d后,用10 mL生理盐水(0.9% NaCl, 0.05% Tween-80)洗涤菌丝表面,经玻璃绒纸过滤,去除菌丝体得到孢子悬液,活菌计数,确定孢子液的浓度。
1.2.5 绿色木霉出发菌株及工程菌株耐受胁迫能力的分析木霉无菌孢子的收集方法如1.2.4所述。
(1) 液体摇瓶耐盐实验
将200 μL木霉出发菌株和工程菌株Tv-1511-hAANAThAANAT/hASMThASMT的孢子分别接种于PDB液体培养基中,28 ℃、180 r/min培养48 h,通过2层无菌纱布过滤获得无菌的菌丝体。将等量的菌丝体分别接种于含有300 mmol/L NaCl的PDB液体培养基中,28 ℃、180 r/min培养72 h,收集菌丝体,烘干后测定菌体生物量。
(2) 液体摇瓶耐热实验
将200 μL木霉出发菌株和工程菌株Tv- 1511-hAANAThAANAT/hASMThASMT的孢子分别接种于PDB液体培养基中,28 ℃、180 r/min培养48 h,通过2层无菌纱布过滤获得无菌的菌丝体。将等量的菌丝体分别接种于新的PDB液体培养基中,35 ℃、180 r/min培养48 h,收集菌丝体,烘干后测定菌体生物量。
1.2.6 绿色木霉(Trichoderma viride) Tv-1511出发菌株及其工程菌株对病原菌的生物防治能力分析(1) 病原菌平板对峙试验
先在PDA平板上活化木霉出发菌株和工程菌株Tv-1511-hAANAThAANAT/hASMThASMT,28 ℃避光培养48−72 h,使得出发菌株和工程菌木霉长势均一。同时在PDA平板上活化不同的植物病原菌株。使用打孔器分别切取木霉菌菌饼(直径5 mm)与病原菌菌饼(直径5 mm)接种于直径为9 cm的PDA培养皿中,使2个菌饼直线距离为6 cm,28 ℃暗培养3 d,每天观察抑制作用,测量病原菌菌落半径。
(2) 发酵液平板抑菌试验
将200 μL木霉出发菌株和工程菌株Tv-1511- hAANAThAANAT/hASMThASMT的孢子分别接种于PDB液体培养基中,28 ℃、180 r/min培养48 h,通过2层无菌纱布过滤获得无菌的菌丝体。将等量的菌丝体转接于PDB培养基中,28 ℃、180 r/min培养7 d,收集其发酵液,0.22 μm无菌滤膜过滤,滤液置于无菌离心管中备用。将10 mL无菌木霉菌发酵液与40 mL PDA培养基混合均匀后倒平板,待其冷却后在平板一侧转接病原菌,28 ℃静置培养,每天观察抑制作用,测量病原菌菌落半径。对照为10 mL无菌PDB培养基与40 mL PDA培养基均匀混合倒平板。
1.2.7 绿色木霉出发菌株及工程菌株发酵液对植物促生能力的分析供试植物为小麦(济麦22)和黄瓜(津研四号)。挑选饱满一致的种子进行消毒处理,于25 ℃培养箱中遮光催芽至露白,然后16 h光照8 h黑暗培育一定时间后,挑选长势一致的幼苗移至水培装置,进行处理。以1/2 Hoagland营养液为水培溶液作为对照组(CK),以1/2 Hoagland营养液加入木霉出发菌株及工程菌株发酵液的处理组分别为T1组和T2组,每个处理设置4个重复,处理7 d后进行主根长、株高、叶宽、叶长、鲜重、干重等指标的测定。
2 结果与分析 2.1 表达载体pCAMBIA1303-Hygro-hAANAT和pCAMBIA1303-Bleo-hASMT的构建根据对褪黑素合成途径的分析,如图 1A所示,通过引入外源hAANAThAANAT和hASMThASMT基因来验证是否可以实现绿色木霉中褪黑素的合成(图 1A)。以化学合成的方法获得密码子优化后的hAANAThAANAT和hASMThASMT基因序列为模板,设计引物后,扩增克隆并经过验证,成功获得带有酶切连接位点(Spe I和BstE II)的hASMThASMT基因表达盒。DNA片段和载体分别进行双酶切,连接后转入大肠杆菌DH5α。用无内毒素质粒大提试剂盒提取并进行验证测序,成功获得表达载体pCAMBIA1303-Hygro-hAANAThAANAT和pCAMBIA1303-Bleo-hASMThASMT (图 1B)。
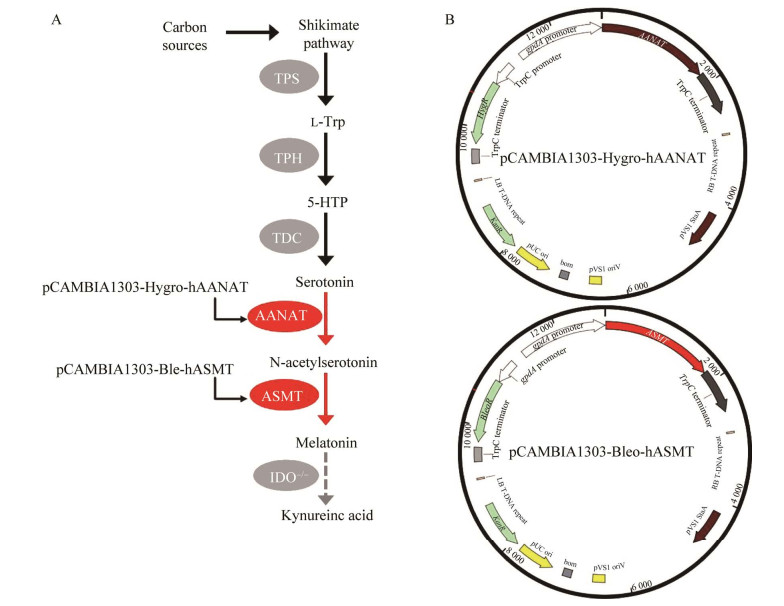
|
| 图 1 绿色木霉褪黑素合成的预测通路(A)及表达质粒构建图谱(B) Figure 1 The possible biosynthesis pathway of melatonin in Trichoderma viride (A) and the maps of constructed vectors for the expressions of hAANAT and hASMT (B). |
|
|
成功获得表达载体pCAMBIA1303-Hygro-hAANAThAANAT和pCAMBIA1303-Bleo-hASMThASMT后,利用PEG-CaCl2介导的方法,将pCAMBIA1303-Hygro-hAANAThAANAT和pCAMBIA1303-Bleo-hASMThASMT真菌表达载体转入到绿色木霉原生质体中,经过潮霉素和博来霉素共筛选,得到能够同时表达hAANAThAANAT和hASMThASMT的绿色木霉工程菌株Tv-1511-hAANAThAANAT/hASMThASMT,成功获得绿色木霉Tv-1511-hAANAThAANAT/hASMThASMT工程菌株8株。采用荧光定量PCR的方法检测Tv-1511-hAANAThAANAT/hASMThASMT工程菌中hAANAThAANAT和hASMThASMT的转录表达水平。结果表明,与野生型菌株相比,绿色木霉工程菌株Tv-1511- hAANAThASNAT/hASMThASMT中可以检测到hAANAThASNAT (图 2A)和hASMThASMT (图 2B)的转录表达。同时传代20次后的绿色木霉工程菌株中hAANAT和hASMThASMT基因表达和发酵液褪黑素含量能保持稳定,表明了转化子遗传和生理的稳定性。
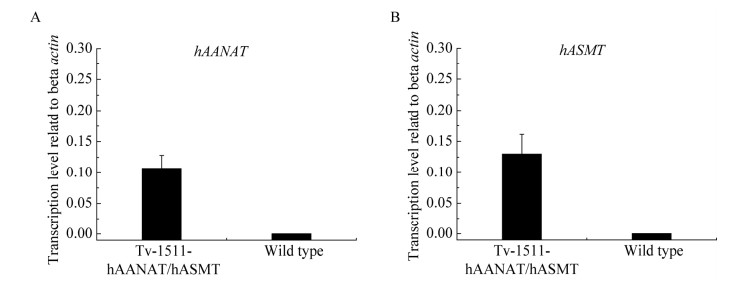
|
| 图 2 HAANAThAANAT (A)和HASMThASMT (B)基因表达的qPCR鉴定结果 Figure 2 Identification of the transcriptional expression of HAANAThAANAT (A) and HASMThASMT (B) genes by qPCR. |
|
|
离心收集绿色木霉野生型菌株和工程菌株Tv-1511-hAANAThASNAT/hASMThASMT的发酵液,利用高效液相色谱仪检测其中的褪黑素含量(图 3A)。结果显示,在野生型菌株(wild type)发酵液中未检测到褪黑素含量,而在Tv-1511-hAANAThAANAT/hASMThASMT工程菌株中,随着培养时间的延长,褪黑素含量逐渐上升,在培养72 h的发酵液中达到最大值,产量达到21.26 mg/L (图 3B)。
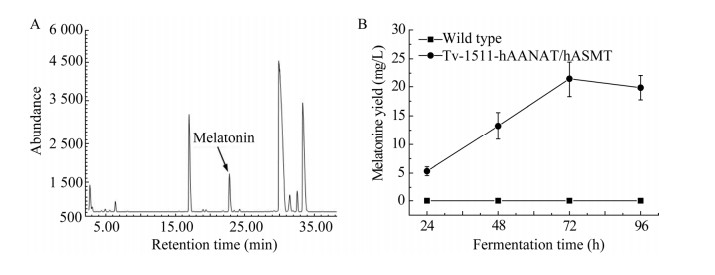
|
| 图 3 高效液相色谱检测绿色木霉发酵液中褪黑素的含量 Figure 3 Determination of melatonin content in the fermentation broth of Trichoderma viride using HPLC. A:野生型菌株发酵液中褪黑素含量的检测. B:工程菌中褪黑素含量的检测 A: Determination of melatonin content in the fermentation broth of wild type strains. B: Determination of melatonin content in the fermentation broth of engineered strains. |
|
|
为研究内源合成褪黑素对绿色木霉生长和产孢的影响,分别进行平板和液体培养实验。结果显示,培养72 h后,工程菌株Tv-1511- hAANAThAANAT/hASMThASMT的生长菌落和生物量均比野生型菌株显著提高(图 4A、4B)。而在培养10 d后,工程菌株Tv-1511-hAANAThAANAT/hASMThASMT的产孢量比野生型菌株显著增加(图 4C、4D)。

|
| 图 4 绿色木霉工程菌株生长和产孢特性的评价 Figure 4 Characteristic analysis of the growth and sporogenesis of the engineered strain of Trichoderma viride. A和B:Tv-1511-hAANAT/hASMT的菌落生长情况. C和D:Tv-1511-hAANAT/hASMT的产厚垣孢子情况 A, C: Growth condition of Tv-1511-hAANAT/hASMT. B, D: SPOROGENESIS of Tv-1511-hAANAT/hASMT. |
|
|
我们也利用工程菌株Tv-1511-hAANAT/hASMT对内源合成褪黑素对木霉抗逆能力的影响进行了研究。耐盐性评价实验中发现,在300 mmol/L NaCl胁迫下,工程菌株Tv-1511- hAANAT/hASMT的菌落生长和生物量均比野生型菌株显著提高(图 5A、5B);在35 ℃的培养环境下,工程菌株Tv-1511-hAANAT/hASMT的菌落生长和生物量均比野生型菌株显著提高了85.37% (图 5C、5D)。
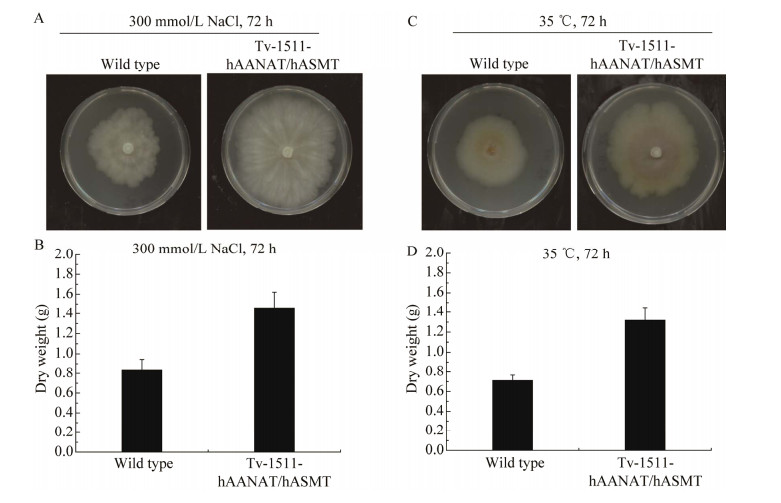
|
| 图 5 绿色木霉工程菌株盐胁迫和高温胁迫抗性的评价 Figure 5 Characteristic analysis of the tolerance of the engineered strain of Trichoderma viride to salt stress and high temperature. A和B:Tv-1511-hAANAT/hASMT的盐胁迫抗性分析. C和D:Tv-1511-hAANAT/hASMT的高温胁迫抗性分析 A, B: Salt tolerance analysis of Tv-1511-hAANAT/hASMT. C, D: High temperature tolerance analysis of Tv-1511-hAANAT/hASMT. |
|
|
木霉是一种被广泛应用的生防菌,有研究表明褪黑素也对灰霉病、黑斑病等具有一定的抗性。为了探讨内源合成褪黑素对绿色木霉病原菌拮抗性的影响,我们进行了工程菌株Tv-1511- hAANAT/hASMT与病原菌的平板对峙实验和发酵液抑菌实验。结果发现,与野生型菌株相比,工程菌株Tv-1511-hAANAT/hASMT对不同病原菌均表现出了更强的抑制效果(图 6),而工程菌株Tv-1511-hAANAT/hASMT的发酵液对不同病原菌均表现出了更强的抑制效果(图 7)。
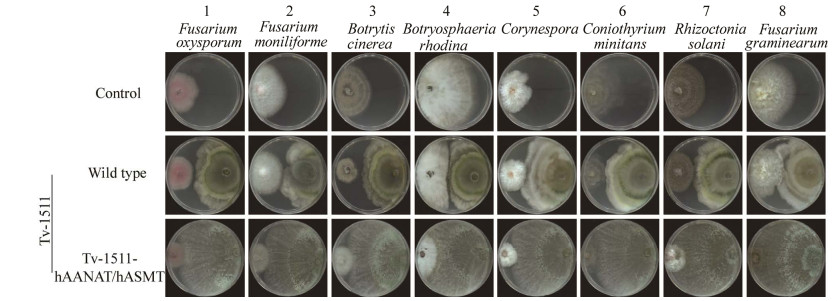
|
| 图 6 绿色木霉工程菌株病原菌拮抗特性的评价 Figure 6 Characteristic analysis of the antagonism of the engineered strain of Trichoderma viride to several pathogens. 1:尖孢镰刀菌;2:串珠镰刀菌;3:灰葡萄孢菌;4:葡萄座腔菌;5:棒孢菌;6:盾壳菌;7:立枯丝核菌;8:禾谷镰刀菌 1: Fusarium oxysporum; 2: Fusarium moniliforme; 3: Botrytis cinerea; 4: Botryosphaeria rhodina; 5: Corynespora; 6: Coniothyrium minitans; 7: Rhizoctonia solani; 8: Fusarium graminearum. |
|
|

|
| 图 7 绿色木霉工程菌发酵液的病原菌拮抗特性评价 Figure 7 Analysis of the antagonism of the fermentation broth of the engineered strain of Trichoderma viride to several pathogens. 1:尖孢镰刀菌;2:串珠镰刀菌;3:灰葡萄孢菌;4:葡萄座腔菌;5:棒孢菌;6:盾壳菌;7:立枯丝核菌;8:禾谷镰孢 1: Fusarium oxysporum; 2: Fusarium moniliforme; 3: Botrytis Cinerea; 4: Botryosphaeria rhodina; 5: Corynespora; 6: Coniothyrium minitans; 7: Rhizoctonia solani; 8: Fusarium graminearum. |
|
|
木霉可以产生一些植物促生性物质比如生长素等来促进植物的生长,而褪黑素可以参与植物生长素的合成调控和促进根生长。我们选取小麦(济麦22)和黄瓜(津研四号)为供试植物,研究了绿色木霉工程菌株Tv-1511-hAANAT/hASMT的植物促生作用。
通过对供试植物主根长、株高、叶宽、叶长、干重、鲜重等指标的测定发现,野生型菌株及工程菌株发酵液都能有效促进小麦和黄瓜的生长,尤其是工程菌株发酵液促生效果更加明显。与野生型菌株发酵液处理组T1相比,工程菌株发酵液处理组T2中,小麦的主根长、株高、叶宽、叶长、干重和鲜重分别增加了31.89%、24.79%、26.64%、32.73%、22.35%和40.74% (表 1),黄瓜的各项指标则分别增加了24.98%、20.41%、17.89%、24.78%、28.57%和34.55% (表 2)。
| Treatment | Root length (cm) | Plant height (cm) | Leaf width (mm) | Leaf length (cm) | Dry weight (g) | Fresh weight (g) |
| CK | 9.51±1.12 | 3.66±0.47 | 3.61±0.37 | 12.11±0.75 | 0.150±0.009 | 1.15±0.11 |
| T1 | 14.11±1.11* | 4.88±0.64* | 5.01±0.33* | 15.21±1.09* | 0.270±0.016* | 1.68±0.32* |
| T2 | 18.61±1.32** | 6.18±0.77** | 6.65±0.51** | 18.61±1.58** | 0.380±0.026** | 2.18±0.31** |
| CK:1/2 Hoagland溶液;T1:1/2 Hoagland+野生菌株发酵液;T2:1/2 Hoagland+工程菌株发酵液. 显著性分析采用Student’s paired t-test方法:*:P < 0.05;**:P < 0.01. 下同 CK: 1/2 Hoagland solution; T1: 1/2 Hoagland+fermentation broth of the wild type strain; T2: 1/2 Hoagland+fermentation broth of the engineered strain. Statistical analysis was performed with Student’s paired t-test: *: P < 0.05; **: P < 0.01. The same below. |
||||||
| Treatment | Root length (cm) | Plant height (cm) | Leaf width (mm) | Leaf length (cm) | Dry weight (g) | Fresh weight (g) |
| CK | 23.65±3.11 | 2.55±0.54 | 5.01±0.59 | 4.88±0.77 | 0.38±0.06 | 3.26±0.24 |
| T1 | 32.18±3.51* | 3.43±0.63* | 6.15±0.65* | 5.65±0.63* | 0.49±0.08* | 5.21±0.61* |
| T2 | 40.22±4.61** | 4.13±0.57** | 7.25±1.05** | 7.05±0.91** | 0.63±0.15** | 7.01±0.49** |
| *: P < 0.05; **: P < 0.01. | ||||||
褪黑素在动物和植物体内都广泛存在,在细菌、真菌和藻类中也有发现,但动物和植物相关褪黑素的研究较多。Okazaki等[20]从莱茵衣藻(Chlamydomonas)中鉴定出了N-acetyltransferase (AANAT)基因的同源序列CrAANAT,并且将其转入了番茄品种(Solanum lycopersicum L.)中,构建了可以表达CrAANAT基因的转基因植物,转基因植株的褪黑素产量显著提升,并且发现褪黑素在番茄的生长发育中起到重要作用,能够促进植物生长并提高抗逆性。而且众多研究还发现,褪黑素在植物的抗逆如低温、干旱和盐碱等方面也发挥着重要的作用[29-32]。
Arnao[33]研究了褪黑素在植物体内的生物合成途径,以色氨酸为底物,在l-色氨酸脱羧酶(l-tryptophan decarboxylase, TrpDC)、色氨酸羟化酶(tryptophan hydroxylase, T5H)、5-羟色胺-N-乙酰转移酶(N-acetyl-5-hydroxytryptamine, SNAcT)和N-乙酰-5-羟色胺甲基转移酶(acetylserotonin methyltransferase, AcSNMT)或羟基吲哚-O-甲基转移酶(hydroxyndole- O-methyltransferase, HIOMT)等酶的作用下合成褪黑素。目前,科学家已成功从植物中克隆出褪黑素合成关键酶基因TrpDC、T5H、AcSNMT和HIOMT并进行了表达分析研究[34]。Murch等[14]运用同位素标记法研究褪黑素合成过程时,在吲哚乙酸(indole-3-acetic acid, IAA)、色胺(tryptamine, TAM)、5-羟色氨酸(5-hydroxytryptophan, 5-HTP)和5-羟色胺(5-hydroxytryptamine, 5-HT)中检测到了同位素。同时,色氨酸和色胺也是吲哚乙酸(IAA)合成过程中的前体物质,TDC基因编码的色氨酸脱羧酶(l-tryptophan decarboxylase, TDC)是IAA合成途径中的重要催化酶之一[35]。由此可见IAA合成与褪黑素合成相关。
褪黑素在微生物中的研究较少,在木霉中的研究还未曾有过报道。Contreras-Cornejo等[36]通过气相色谱-质谱在木霉培养液中检测到吲哚类化合物IAA。木霉具有培养条件简单、发酵时间短、合成效率高、能够实现高密度发酵等优点,是优良的宿主表达系统和良好的异源蛋白生物反应器。本实验室也在木霉基因组中鉴定到了TDC基因,因此,本研究通过在木霉中表达来源于人基因组的AANAT编码基因hAANAT和ASMT编码基因hASMT,成功构建了一株具有褪黑素合成能力的绿色木霉工程菌,并且研究了此工程菌产生的褪黑素对木霉的生长特性和抗逆能力有积极作用。
4 结论本研究以绿色木霉(Trichoderma viride) Tv-1511为原始菌株,异源表达了来源于人基因组的AANAT编码基因hAANAT和ASMT编码基因hASMT,构建了一株具有褪黑素合成能力的绿色木霉工程菌,并且进行了褪黑素关于木霉生长特性、抗逆和促生的研究。结果表明此工程菌具有更好的生长和产孢特性、更强的逆境胁迫耐受能力、更高的病原菌拮抗性,以及更有效的植物促生能力。确定了褪黑素对绿色木霉的生长和抗逆具有积极的作用,对木霉的生产应用也有重要意义。
| [1] |
JANAS KM, POSMYK MM. Melatonin, an underestimated natural substance with great potential for agricultural application[J]. Acta Physiologiae Plantarum, 2013, 35(12): 3285-3292. DOI:10.1007/s11738-013-1372-0 |
| [2] |
REITER RJ. Pineal melatonin: cell biology of its synthesis and of its physiological interactions[J]. Endocrine Reviews, 1991, 12(2): 151-180. DOI:10.1210/edrv-12-2-151 |
| [3] |
BLASK DE, SAUER LA, DAUCHY RT. Melatonin as a chronobiotic/anticancer agent: cellular, biochemical, and molecular mechanisms of action and their implications for circadian-based cancer therapy[J]. Current Topics in Medicinal Chemistry, 2002, 2(2): 113-132. DOI:10.2174/1568026023394407 |
| [4] |
JACKSON WT. Regulation of mitosis. II. interaction of isopropyl N-phenylcarbamate and melatonin[J]. Journal of Cell Science, 1969, 5(3): 745-755. DOI:10.1242/jcs.5.3.745 |
| [5] |
BANERJEE S, MARGULIS L. Mitotic arrest by melatonin[J]. Experimental Cell Research, 1973, 78(2): 314-318. DOI:10.1016/0014-4827(73)90074-8 |
| [6] |
CHEN Q, QI WB, REITER RJ, WEI W, WANG BM. Exogenously applied melatonin stimulates root growth and raises endogenous indoleacetic acid in roots of etiolated seedlings of Brassica juncea[J]. Journal of Plant Physiology, 2009, 166(3): 324-328. DOI:10.1016/j.jplph.2008.06.002 |
| [7] |
ARNAO MB, HERNÁNDEZ-RUIZ J. Melatonin promotes adventitious-and lateral root regeneration in etiolated hypocotyls of Lupinus albus L.[J]. Journal of Pineal Research, 2007, 42(2): 147-152. DOI:10.1111/j.1600-079X.2006.00396.x |
| [8] |
ARNAO MB, HERNÁNDEZ-RUIZ J. Melatonin: a new plant hormone and/or a plant master regulator?[J]. Trends in Plant Science, 2019, 24(1): 38-48. DOI:10.1016/j.tplants.2018.10.010 |
| [9] |
TILDEN AR, BECKER MA, AMMA LL, ARCINIEGA J, MCGAW AK. Melatonin production in an aerobic photosynthetic bacterium: an evolutionarily early association with darkness[J]. Journal of Pineal Research, 1997, 22(2): 102-106. DOI:10.1111/j.1600-079X.1997.tb00310.x |
| [10] |
RODRIGUEZ-NARANJO MI, TORIJA MJ, MAS A, CANTOS-VILLAR E, GARCIA-PARRILLA M. Production of melatonin by Saccharomyces strains under growth and fermentation conditions[J]. Journal of Pineal Research, 2012, 53(3): 219-224. DOI:10.1111/j.1600-079X.2012.00990.x |
| [11] |
TAN DX, MANCHESTER LC, HARDELAND R, LOPEZ-BURILLO S, MAYO JC, SAINZ RM, REITER RJ. Melatonin: a hormone, a tissue factor, an autocoid, a paracoid, and an antioxidant vitamin[J]. Journal of Pineal Research, 2003, 34(1): 75-78. DOI:10.1034/j.1600-079X.2003.02111.x |
| [12] |
BOUTIN JA, AUDINOT V, FERRY G, DELAGRANGE P. Molecular tools to study melatonin pathways and actions[J]. Trends in Pharmacological Sciences, 2005, 26(8): 412-419. DOI:10.1016/j.tips.2005.06.006 |
| [13] |
COON SL, ROSEBOOM PH, BALER R, WELLER JL, NAMBOODIRI MA, KOONIN EV, KLEIN DC. Pineal serotonin N-acetyltransferase: expression cloning and molecular analysis[J]. Science, 1995, 270(5242): 1681-1683. DOI:10.1126/science.270.5242.1681 |
| [14] |
MURCH SJ, KRISHNARAJ S, SAXENA PK. Tryptophan is a precursor for melatonin and serotonin biosynthesis in in vitro regenerated St. John's wort (Hypericum perforatum L. cv. Anthos) plants[J]. Plant Cell Reports, 2000, 19(7): 698-704. DOI:10.1007/s002990000206 |
| [15] |
PARK M, KANG K, PARK S, BACK K. Conversion of 5-hydroxytryptophan into serotonin by tryptophan decarboxylase in plants, Escherichia coli, and yeast[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(9): 2456-2458. DOI:10.1271/bbb.80220 |
| [16] |
KANG S, KANG K, LEE K, BACK K. Characterization of tryptamine 5-hydroxylase and serotonin synthesis in rice plants[J]. Plant Cell Reports, 2007, 26(11): 2009-2015. DOI:10.1007/s00299-007-0405-9 |
| [17] |
KANG S, KANG K, LEE K, BACK K. Characterization of rice tryptophan decarboxylases and their direct involvement in serotonin biosynthesis in transgenic rice[J]. Planta, 2007, 227(1): 263-272. DOI:10.1007/s00425-007-0614-z |
| [18] |
FUJIWARA T, MAISONNEUVE S, ISSHIKI M, MIZUTANI M, CHEN LT, WONG HL, KAWASAKI T, SHIMAMOTO K. Sekiguchi lesion gene encodes a cytochrome P450 monooxygenase that catalyzes conversion of tryptamine to serotonin in rice[J]. Journal of Biological Chemistry, 2010, 285(15): 11308-11313. DOI:10.1074/jbc.M109.091371 |
| [19] |
BYEON Y, LEE HY, LEE K, PARK S, BACK K. Cellular localization and kinetics of the rice melatonin biosynthetic enzymes SNAT and ASMT[J]. Journal of Pineal Research, 2014, 56(1): 107-114. DOI:10.1111/jpi.12103 |
| [20] |
OKAZAKI M, HIGUCHI K, HANAWA Y, SHIRAIWA Y, EZURA H. Cloning and characterization of a Chlamydomonas reinhardtii cDNA arylalkylamine N-acetyltransferase and its use in the genetic engineering of melatonin content in the Micro-Tom tomato[J]. Journal of Pineal Research, 2009, 46(4): 373-382. DOI:10.1111/j.1600-079X.2009.00673.x |
| [21] |
WANG C, SHI XY, XIAO H, WANG LH, WEN Y, WANG XL, ZHAN JC, HUANG WD. Variations in the content of melatonin and its isomer during ethanol fermentation by different Saccharomyces cerevisiae strains[J]. Modern Food Science and Technology, 2015, 31(8): 77-82. (in Chinese) 王成, 施雪莹, 肖华, 王丽花, 文云, 王晓磊, 战吉宬, 黄卫东. 酿酒酵母发酵过程中褪黑素及其同分异构体变化规律的研究[J]. 现代食品科技, 2015, 31(8): 77-82. DOI:10.13982/j.mfst.1673-9078.2015.8.014 |
| [22] |
ZHANG GZ, YANG HT, ZHANG XJ, HU JD, GUO K, HUANG YJ, LI JS. A checklist of known species of Trichoderma[J]. Mycosystema, 2014, 33(6): 1210-1230. (in Chinese) 张广志, 杨合同, 张新建, 扈进冬, 郭凯, 黄玉杰, 李纪顺. 木霉现有种类名录[J]. 菌物学报, 2014, 33(6): 1210-1230. DOI:10.13346/j.mycosystema.140183 |
| [23] |
MENG JJ, WANG B, CHENG W. Study on the secondary metabolites of Trichoderma saturnisporum[J]. Chinese Journal of Marine Drugs, 2017, 36(6): 27-31. (in Chinese) 孟俊俊, 王斌, 程伟. 土孢木霉Trichoderma saturnisporum的次生代谢产物研究[J]. 中国海洋药物, 2017, 36(6): 27-31. |
| [24] |
LI DH, CHEN L, ZHU TJ, KURTÁN T, MÁNDI A, ZHAO ZM, LI J, GU QQ. Chloctanspirones A and B, novel chlorinated polyketides with an unprecedented skeleton, from marine sediment derived fungus Penicillium terrestre[J]. Tetrahedron, 2011, 67(41): 7913-7918. DOI:10.1016/j.tet.2011.08.037 |
| [25] |
ANDRADE R, AYER WA, MEBE PP. The metabolites of Trichoderma longibrachiatum. part 1. Isolation of the metabolites and the structure of trichodimerol[J]. Canadian Journal of Chemistry, 1992, 70(10): 2526-2535. DOI:10.1139/v92-320 |
| [26] |
GUO K, SUI YH, LI Z, HUANG YH, ZHANG H, WANG WW. Colonization of Trichoderma viride Tv-1511 in peppermint (Mentha×piperita L.) roots promotes essential oil production by triggering ROS-mediated MAPK activation[J]. Plant Physiology and Biochemistry, 2020, 151: 705-718. DOI:10.1016/j.plaphy.2020.03.042 |
| [27] |
GUO K, SUI YH, LI Z, HUANG YH, ZHANG H. Trichoderma viride Tv-1511 colonizes Arabidopsis leaves and promotes Arabidopsis growth by modulating the MAP kinase 6-mediated activation of plasma membrane H+-ATPase[J]. Journal of Plant Growth Regulation, 2020, 39: 1261-1276. DOI:10.1007/s00344-019-10063-6 |
| [28] |
GUO K, HUANG YH, LI Z, HAO YR, SUI YH, ZHANG H. Trichoderma viride, microbial agent, biological fertilizer and application: China, ZL201910626525.9[P]. 2020-01-13 (in Chinese). 郭凯, 黄艳华, 李哲, 郝永任, 隋永辉, 张豪. 一种绿色木霉菌、菌剂、生物肥及应用: 中国, ZL201910626525.9[P]. 2020-01-13. |
| [29] |
SUPRIYA L, DURGESHWAR P, MUTHAMILARASAN M, PADMAJA G. Melatonin mediated differential regulation of drought tolerance in sensitive and tolerant varieties of upland cotton (Gossypium hirsutum L.)[J]. Frontier in Plant Science, 2022, 13: 821353. DOI:10.3389/fpls.2022.821353 |
| [30] |
BAJWA VS, SHUKLA MR, SHERIF SM, MURCH SJ, SAXENA PK. Role of melatonin in alleviating cold stress in Arabidopsis thaliana[J]. Journal of Pineal Research, 2014, 56(3): 238-245. DOI:10.1111/jpi.12115 |
| [31] |
LI C, TAN DX, LIANG D, CHANG C, JIA DF, MA FW. Melatonin mediates the regulation of ABA metabolism, free-radical scavenging, and stomatal behaviour in two Malus species under drought stress[J]. Journal of Experimental Botany, 2014, 66(3): 669-680. |
| [32] |
LI C, WANG P, WEI ZW, LIANG D, LIU CH, YIN LH, JIA DF, FU MY, MA FW. The mitigation effects of exogenous melatonin on salinity-induced stress in Malus hupehensis[J]. Journal of Pineal Research, 2012, 53(3): 298-306. DOI:10.1111/j.1600-079X.2012.00999.x |
| [33] |
ARNAO MB. Phytomelatonin: discovery, content, and role in plants[J]. Advances in Botany, 2014, 2014: 815769. |
| [34] |
PARK WJ. Melatonin as an endogenous plant regulatory signal: debates and perspectives[J]. Journal of Plant Biology, 2011, 54(3): 143-149. DOI:10.1007/s12374-011-9159-6 |
| [35] |
PENG MF, ZHANG TT, CHEN R, REN SX, CHEN M, LIAO ZH. Cloning and functional analysis of tryptophan decarboxylase gene in the synthetic pathway of indole alkaloids from Raffia l[A]//Abstracts of the eighth Congress and symposium of The Chinese Society of Genetics[C]. Chongqing: Southwest University School of life Sciences, 2008: 13-124 (in Chinese). 彭梅芳, 张婷婷, 谌容, 任肃霞, 陈敏, 廖志华. 萝芙木萜类吲哚生物碱合成途径中色氨酸脱羧酶基因的克隆与功能分析[A]//中国遗传学会第八次代表大会暨学术讨论会论文摘要汇编[C]. 重庆: 西南大学生命科学学院, 2008: 13-124. |
| [36] |
CONTRERAS-CORNEJO HA, MACÍAS-RODRÍGUEZ L, CORTÉS-PENAGOS C, LÓPEZ-BUCIO J. Trichoderma virens, a plant beneficial fungus, enhances biomass production and promotes lateral root growth through an auxin-dependent mechanism in Arabidopsis[J]. Plant Physiology, 2009, 149(3): 1579-1592. DOI:10.1104/pp.108.130369 |
 2023, Vol. 50
2023, Vol. 50




