扩展功能
文章信息
- 郭峻宁, 邓雪婷, 高蓉蓉, 熊智慧, 何琳燕
- GUO Junning, DENG Xueting, GAO Rongrong, XIONG Zhihui, HE Linyan
- 细菌生物膜在农田土壤污染修复中的应用研究进展
- Application of bacterial biofilm in remediation of polluted farmland soil: a review
- 微生物学通报, 2022, 49(9): 3919-3932
- Microbiology China, 2022, 49(9): 3919-3932
- DOI: 10.13344/j.microbiol.china.220102
-
文章历史
- 收稿日期: 2022-01-25
- 接受日期: 2022-04-13
- 网络首发日期: 2022-04-28
21世纪以来,随着人类生活方式的改变和世界经济的高速发展,环境污染日益加剧,土壤污染形势尤为严峻。近年来,全球土壤重金属和有机污染事件频发,不但严重影响了耕地与农产品质量,造成巨大的经济损失,还直接对人类身体健康产生威胁[1]。就我国而言,2014年发布的《全国土壤污染状况调查公报》显示,我国农田耕地土壤重金属污染物点位超标率达19.4%,其中镉(Cd)、砷(As)、汞(Hg)、铅(Pb)的点位超标率分别为7.0%、2.7%、1.6%和1.5%;滴滴涕和多环芳烃两种农药类有机污染物点位超标率分别为1.9%和1.4%,污染形势十分严峻[2]。此外,我国作为世界上最大的塑料生产地,近年来通过对土壤微塑料污染情况进行检测,发现我国沿海地区海滩土、黄土高原农业土和部分城市菜园土中均存在微塑料污染,这些微塑料可随地表径流和人类活动进行扩散,并与重金属、农药类污染物形成复合污染[3]。因此,修复农田土壤污染迫在眉睫。
细菌生物膜是能使细菌黏附于接触表面分泌多糖和蛋白质等将其自身包绕其中而形成的结构复杂的群落结构。目前约有1.2×1030个细菌和古细菌存在于地球上的不同栖息地,其中约有40%−80%以生物膜或表面黏附的细菌群落形式存在[4]。已有研究表明,细菌生物膜与生物膜群落结构的动态变化可增强细菌的环境适应性,在农田土壤污染修复方面具有一定功效[5]。与传统的化学修复法相比,生物膜修复具有环境友好、成本低、效率高的优点,现已逐渐成为土壤污染修复领域研究的热点之一[6-7]。然而,由于细菌的多样性和复杂性,目前国内外对该领域的研究并不深入,部分生物膜修复机制与修复方法仍未被阐明和发现。因此,了解细菌生物膜的组成及其在土壤污染修复领域的应用和作用机制,对理解菌膜修复机理、开发菌膜生物修复的新策略具有重要意义。
1 细菌生物膜的组成及功能细菌生物膜存在于细菌表面,是细菌自身分泌的胞外聚合物(extracellular polymeric substances,EPS)包裹细菌聚合而成的聚集体[8]。常见的胞外多聚物有多糖、蛋白质、核酸及脂类等,其约占细菌生物膜的90%以上[9]。根据Alpkvist等[10]提出的生物膜三维结构,细菌生物膜的内侧从内向外由基底层(basal layer)、条件层(conditional layer)和连接层(connection layer)组成,外侧则被生物被膜层(biofilm layer)包裹。生物膜结构组成如图 1所示。构成生物膜的细菌聚集体可以是单一菌种,也可是多菌种混合菌群。

|
| 图 1 细菌生物膜结构示意图 Figure 1 The schematic drawing of bacterial biofilm structure. |
|
|
经研究,细菌生物膜胞外多聚物在菌体生长发育、致病性及细菌群落之间的相互作用中发挥着重要作用。如枯草芽孢杆菌(Bacillus subtilis)、铜绿假单胞菌(Pseudomonas aeruginosa)、变形链球菌(Streptococcus mutans)等细菌胞外多糖在生物膜空间结构的形成过程中起到关键作用[11]。同时,由于胞外多糖具有丰富的官能团种类和大分子结构,因此其具有很强的生物吸附特性,现已被应用于土壤污染的修复领域[12]。
细菌生物膜除了具有稳定菌体和黏附功能的多糖类物质外,还具有以基质蛋白为代表的多种蛋白质成分。它们可促进细菌生物膜的形成、发育和成熟,同时与生物膜骨架稳定性、细菌群落的群体感应(quorum sensing,QS)、菌体防御及细菌毒性有着密切联系[13-16]。此外,菌体生物膜表面的eDNA和脂类也在细菌的黏附和生物被膜骨架稳定性方面有着重要意义[13]。
2 细菌生物膜在土壤污染治理中的应用 2.1 细菌生物膜修复重金属污染土壤研究表明,细菌胞外多糖能有效结合重金属,而且从纯细菌培养物中提取的胞外聚合物也被证明具有金属吸附能力[17-18]。因此,利用以EPS为主的菌膜钝化重金属是重金属污染土壤修复的主要策略之一。Xing等[19]发现粘质沙雷氏菌(Serratia marcescens) S14生物膜可在黏土矿物蒙脱石的作用下增加生物膜基质中多糖的比例,使生物膜对土壤Cd的最大吸附量提高了1.5倍,表现出良好的Cd钝化效果。Kaçar等[20]发现芽孢杆菌(Bacillus)对Cd2+的富集可以达到其干重的21.4%,同时可富集高达61%的Pb2+。陈光村[21]发现恶臭假单胞菌(Pseudomonas putida) CZ1生物膜对土壤中的铜、铅、锌、锰、铁、镍等重金属都具有很高的抗性和富集能力,并且生物膜对铜锌的抗性较游离态细胞增加了2−8倍。张亚见等[22]发现枯草芽孢杆菌(Bacillus subtilis) B12在Cd胁迫下能够分泌更多的表面活性素(surfactin)来调控自身及其他菌株生物被膜的形成以吸附更多的Cd,从而缓解土壤Cd胁迫。另外,由于农田重金属可从植物根表侵入植物体,严重威胁植物生长,而定殖于根围的植物根际促生细菌(plant growth promoting rhizobacteria,PGPR)又对植物生长产生促进作用。因此,探寻PGPR菌株生物膜在重金属污染农田修复和植物保护方面具有较高应用价值。Schue等[7]在根瘤菌中发现Cd可以促进奥氏根瘤菌(Rhizobium alamii)生物膜的形成,其可存在于植物根部产生EPS固定Cd,从而对植物产生保护作用。Raklami等[23]发现假单胞菌(Pseudomonas sp.) DSP17可以在苜蓿根部形成较多的生物膜,从而减轻土壤重金属Cu、Pb、Zn的危害。Meliani等[24]发现铜绿假单胞菌、荧光假单胞菌(Pseudomonas fluorescence)等假单胞菌属PGPR菌株的生物膜生长细胞能够耐受Pb、Zn等土壤重金属毒性,展现了良好的应用前景。葛占标等[25]发现贝莱斯芽孢杆菌(B. velezensis) B9和B25能够形成生物膜并定殖于蔬菜根部,提高根际土壤的pH值、脲酶活性和多糖含量,改良土壤性质,降低土壤Cd、Pb有效态含量,在修复污染土壤和保证蔬菜安全生产方面有巨大潜力。
2.2 细菌生物膜修复有机物污染土壤随着农业生产中农药的大量使用与人类活动中塑料垃圾的回收不当,土壤有机污染日趋严重。就农田土壤而言,农作物会通过根部吸收土壤中的有机污染物并转移至地上部,随后通过食物链的传递与富集进入人体,严重威胁人类健康[26-27]。因此,寻找有效的土壤有机污染物治理策略刻不容缓。
在农药污染土壤修复方面,Lerch等[28]发现钩虫贪铜菌(Cupriavidus necator) JMP134生物膜的形成显著增强了细菌对农药污染物2, 4-二羟基苯氧乙酸(2, 4-dichrolophenoxyacetic acid)的吸附与矿化作用,并发现该吸附作用由生物膜中胞外多糖EPS主导。Kwak等[29]发现芽孢杆菌(Bacillus sp.) E5和鞘氨醇单胞菌(Sphingomonas sp.) 224联合培养的生物膜对杀虫剂甲基立枯磷(toclofos-methyl)表现出较强的降解效果,相较于单个鞘氨醇单胞菌35%的降解率,复合生物膜对甲基立枯磷的最大生物降解率高达90%。Duc[30]以芽孢杆菌(Bacillus sp.) DT1为材料,使用稻草作为细菌固定材料,通过构建生物膜反应器实现了对呋喃丹高达97.5%的降解率。Zhang等[31]发现一种可定殖于玉米等植物土壤根部的细菌Hansschlegelia zhihuaiae S113,而玉米根际分泌物(如酒石酸、L-苹果酸等有机酸)可诱导菌株S113胞外多糖合成,促进菌株形成成熟生物膜,菌膜的产生提高了菌株对土壤有机污染物苄嘧磺隆(bensulfuron methyl,BSM)的降解能力,提出了一种BSM降解、根系分泌物和生物膜之间的相互作用修复农田污染土壤的新方法。
对于微塑料污染土壤的修复,菌膜同样发挥着关键作用。例如,Sivan等[32]发现以聚乙烯作为唯一碳源的红色红球菌(Rhodococcus ruber) C208在暴露于聚烯烃环境中时会立即吸附于聚乙烯上,并在20 h内迅速形成生物膜,在培养10 d后,其生物膜和浮游C208细胞的种群密度比约为60:1,表现出生物膜生长模式的高度偏好。表 1列出了部分用于修复污染土壤的微生物及其生物膜。
| 生物膜微生物组分 Microbial components of biofilm |
污染物类型 Types of contaminant |
污染物成分 Contaminant components |
参考文献 References |
| Rhizobium alamii | 重金属Heavy metals (HM) | 镉Cd | [7] |
| Serratia marcescens S14 | 重金属HM | 镉Cd | [19] |
| Pseudomonas fluorescence & Pseudomonas aeruginosa | 重金属HM | 铅、锌Pb, Zn | [24] |
| Bacillus velezensis B9 & Bacillus velezensis B25 | 重金属HM | 镉、铅Cd, Pb | [25] |
| Burkholderia cepacia | 重金属HM | 铅Pb | [33] |
| Escherichia coli & Staphylococcus epidermidis | 重金属HM | 锌Zn | [34] |
| Pseudomonas sp. H13 | 重金属HM | 镉、铅、铜Cd, Pb, Cu | [35] |
| Bacillus amyloliquefaciens P29ΔsinR | 重金属HM | 镉Cd | [36] |
| Bacillus sp. & Trichoderma harzianum | 重金属HM | 铅、镉、锌Pb, Cd, Zn | [37] |
| Cupriavidus necator JMP134 | 农药 Agricultural chemicals (AC) |
2, 4-二羟基苯氧乙酸 2, 4-dihydroxyphenoxyacetic acid |
[28] |
| Bacillus sp. E5 & Sphingomonas sp. 224 | 农药AC | 甲基立枯磷Tolclofos-methyl | [29] |
| Bacillus sp. DT1 | 农药AC | 氨基甲酸酯Carbamate | [30] |
| Hansschlegelia zhihuaiae S113 | 农药AC | 苄嘧磺隆Bensulfuron | [31] |
| Sphingomonas sp.(mixed flora) | 农药AC | 氨基甲酸酯Carbamate | [38] |
| Kosakonia oryzae ⅥTPSCQ3 | 农药AC | 丙溴磷、喹硫磷Profenofos, quinalphos | [39] |
| Pseudomonas sp. & Delftia sp. & Achromobacter sp. | 农药AC | 氯苯胺灵 Isopropyl N-(3-chlorophenyl)carbamate |
[40] |
| Rhodococcus ruber C208 | 微塑料Microplastics (MP) | 聚乙烯Polyethylene (PE) | [32] |
| Stenotrophomonas sp. & Comamonas sp. & Delftia sp. | 微塑料MP | 聚乙烯PE | [41] |
| Pseudomonas aeruginosa DSM 50071 | 微塑料MP | 聚苯乙烯Polystyrene (PS) | [42] |
| Brevibacterium sp. EDX | 微塑料MP | 聚苯乙烯PS | [43] |
就细菌生物膜修复重金属污染土壤而言,菌膜的生物吸附和絮凝作用在该过程中发挥重要作用。生物吸附(biosorption)是指生物质能依赖其自身的化学成分和结构来吸引、络合、吸收、沉淀、置换环境中的重金属污染物,将重金属浓缩于其表面进而从环境中去除的过程[44]。在菌膜的诸多组分中,胞外多糖(exopolysaccharide,EPS)的吸附作用较为显著。
胞外多糖是一类结构疏松且具有生物活性的多糖类生物高聚物,是菌膜的重要组成部分。细菌胞外多糖具有防护、保持水分、促进金属离子的吸收,以及抑制溶菌酶和噬菌体的侵袭等生物学生理功能[45]。Gadd[46]认为EPS可与重金属离子通过交换、络合等形式结合,使重金属离子的化学行为发生改变,从而降低重金属的生物溶解性和毒性。由于其活性基团具有对重金属离子优良的吸附和络合活性,能够有效固定土壤中的重金属离子,金属离子在膜内细菌的共同代谢作用下发生价态变化,进而从环境中消除[47-48]。褐球固氮菌(Azotobacter chroococcum)产生的海藻酸盐(alginate)作为一种菌膜多糖组分,在土壤中表现出对铅、汞金属较强的吸附行为,能维持土壤生态并加速植物生长[49]。胞外多糖分子的羟基、羧基和氨基等功能基团中富含能够络合重金属离子的氧、氮等配位原子,并且多数基团携带负电荷,可与金属离子相互作用[44]。例如,Xing等[35]发现具有抗重金属功能的根际促生细菌假单胞菌(Pseudomonas sp.) H13产生的生物膜中富含与多糖相关的C‒OH和P=O基团,它们在Cd2+、Pb2+、Cu2+等重金属离子的吸附和固定化中发挥关键作用。Wei等[50]的研究表明恶臭假单胞菌产生的EPS中羧基和磷酸基团主要负责与土壤Cd2+结合。此外,胞外多糖的疏水性也是重金属修复的关键。一些非极性官能团在EPS上聚集可以形成疏水区,赋予EPS一定的疏水性。研究发现,EPS的生物聚集反应与其疏水性密切相关,EPS的疏水性在重金属的絮凝及沉淀方面发挥关键作用[51]。图 2为细菌生物膜修复重金属污染土壤示意图。以胞外多糖EPS为主的生物膜组分通过对重金属的固定来降低土壤重金属有效态含量和迁移力。与非生物膜细菌相比,产生物膜细菌更容易定殖于土壤植物根部形成屏障,增强生物膜细菌的土壤竞争能力,减少或阻隔重金属进入根部向植物地上部转运[52]。
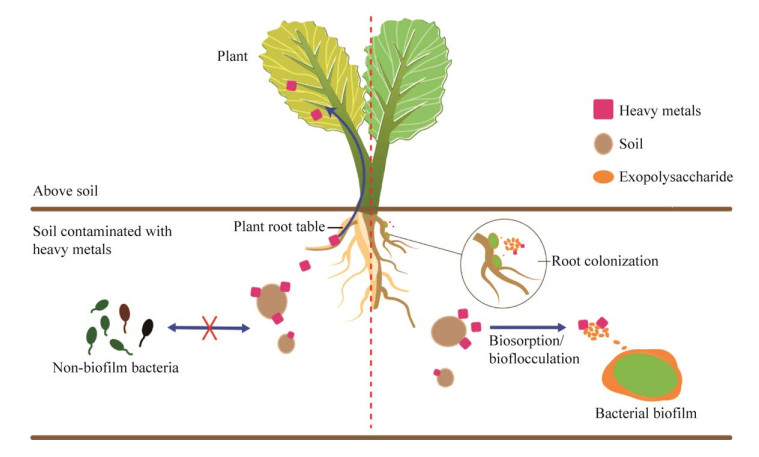
|
| 图 2 细菌生物膜修复重金属污染土壤示意图 Figure 2 Schematic diagram of bacterial biofilm remediation of heavy metals-polluted soil. |
|
|
与菌膜修复重金属污染土壤类似,细菌生物膜胞外多糖EPS也在土壤有机污染物治理方面扮演重要角色。已有大量研究表明,菌膜胞外多糖可以吸附有机污染物,并通过菌膜结构的变化将有机物进行包裹,在膜内细菌的共同作用下实现对污染物的降解和代谢[53]。与重金属污染修复原理不同的是,细菌BF对有机物污染土壤的修复原理更加多样化。除了胞外多糖的吸附和膜内细菌的协同作用之外,功能基因的水平转移也是生物膜修复有机物污染土壤的主要原因。负责有机污染物降解的功能基因利用此方式,在生物膜中同一种属或不同种属细菌间相互传递,极大地增强了有机污染物的代谢能力。图 3为生物膜协助细菌降解有机污染物的示意图。目前细菌生物膜间常见的基因传递方式主要有基因的直接转移、质粒介导的基因传递和转座子转移3种[54]。

|
| 图 3 生物膜协助细菌降解有机污染物示意图 Figure 3 Schematic diagram of bacterial biofilm remediation of organic pollutants. 直接原因:菌膜的生物吸附作用;间接原因:菌膜内细菌之间的基因传递(红色为功能基因,其编码产物可赋予细菌降解有机物的能力或与菌膜互作来改变菌膜特性) Direct cause: Biosorption of biofilm; Indirect cause: Gene transfer between bacteria in biofilm (red represent functional genes, and their encoded products can endow bacteria with the ability to degrade organic matter or Interact with biofilm to change biofilm properties). |
|
|
(1) 基因的直接转移常发生在生物膜形成的初始阶段,胞外DNA通过转移来介导细胞之间或细胞与其他表面的黏附。同时,一些具有调节能力的基因参与了该过程,在生物膜形成中DNA转移最佳条件的选择上发挥作用[55]。例如,Sarand等[56]发现有大量假单胞菌属细菌以生物膜的形式存在于根表,其中荧光假单胞菌中基因xylMA和xylE可在菌膜内直接转移至恶臭假单胞菌中,并赋予后者降解二甲苯和甲基苯甲酸酯的能力,加快了生物膜对石油内有机污染物的降解。
(2) 编码外源化合物降解的基因通常位于质粒上。因此,代谢途径中细菌间分解代谢基因的水平交换有助于构建新的分解代谢途径和生物修复策略。Goris等[57]研究了携带编码3-氯苯胺氧化脱氨基酶基因的质粒pC1的转移,发现在恶臭假单胞菌和活性污泥细菌的接合中,该质粒发生转移,接合子表现出3-氯苯胺的矿化能力。
(3) 转座子是所有移动元件中最复杂的。它们通过整合到宿主细胞基因组中来实现细菌之间的信息传递。Springael等[58]通过对降解3-氯苯甲酸的生物膜反应器中的菌落群落变化进行研究,发现恶臭假单胞菌BN210的染色体上携带自转移CLC元件,该元件主要负责3-氯苯甲酸的降解,而且仅在BN210中存在;但他们发现某时段BN210从反应器中消失,同时出现了几种新的3-氯苯甲酸盐矿化细菌,并且在许多分离物中检测到一个CLC拷贝,这直接证明了降解基因的转移与转座子直接相关。
另外,在微塑料类有机污染物的降解方面,生物膜会直接形成于土壤微塑料表面,然后分泌胞外水解酶将高分子塑料解聚为小分子片段,最后利用微生物代谢将单体和短链低聚物转化成CO2、CH4等无机物质[59]。此外,微塑料表面生物膜不仅可以在微塑料表面形成阻力屏障减缓污染物的释放,还能够为生物降解菌株提供栖息场所,实现对污染物的降解[60-62]。
4 细菌生物膜修复的强化措施 4.1 单细菌菌膜修复的强化方法21世纪以来,随着分子生物学和相关技术的快速发展,生命科学研究进入分子时代。在分子水平解析菌膜特性、获得钝化重金属能力更强的突变株,并应用于环境污染的微生物修复领域成为了当今研究的热点。前文已提到胞外多糖EPS在污染治理中的关键作用,因此以胞外多糖为例,现已发现约12−17 kb长度的基因与细菌生物膜多糖的合成相关,这些基因主要参与了单糖添加、单糖的酰基化修饰、单糖聚合及多糖分泌等过程[63]。近年来,越来越多的与细菌EPS合成相关的基因被鉴定。Yoshida等[64]采用Tn5转座子突变技术,在甲基菌中发现了epsA‒epsU共21个与胞外多糖合成相关的基因,这些基因的编码产物具有多糖转运蛋白、糖基转移酶和聚合酶等多种活性。同时,通过序列同源性比对和生物信息学分析,科学家在芽孢杆菌(epsA‒O)、乳酸菌(epsA‒K)等多种产生物膜细菌中均鉴定到了EPS合成基因[63]。此外,最近的研究还发现了细菌中由bmtA基因编码产生的金属硫蛋白MT在细菌的菌膜形成与提高菌体重金属抵抗力方面发挥重要作用[65]。由于该基因与胞外多糖合成基因与细菌胞外多糖产量密切相关,而胞外多糖产量增多又与重金属的去除效率呈正相关[66]。因此,现阶段需进一步通过分子克隆、外源蛋白表达和组学分析等手段深入探索生物膜组分之间的联系及功能,挖掘更多菌膜在污染治理方面的潜在价值。
利用基因工程手段提高细菌对污染物的吸附和降解能力也是当前研究的热点。已有大量实验表明,转基因微生物可以极大地提高环境中重金属和有机污染物的解毒和降解能力。例如Valls等[67]通过异源表达金属螯合蛋白和肽、改进金属沉淀过程,以及在生存能力强的环境菌株中引入金属转化活性,构建了具有特定金属结合特性的改良菌株。Liu等[68]通过将源于沼泽红假单胞菌(Rhodopseudomonas palustris)的arsM基因(负责编码s-腺苷甲硫氨酸甲基转移酶)在鞘氨醇杆菌和芽孢杆菌中过表达,使二者去除污染土壤中砷的能力提高了近10倍。Villacieros等[69]将土壤活性不佳的伯克霍尔德氏菌(Burkholderia sp.) LB400中的多氯联苯(polychlorinated biphenyls,PCBs)降解基因bph操纵子克隆到土壤活力强且可在多种植物根表定殖成膜的荧光假单胞菌(Pseudomonas fluorescens) F113中,构建了工程菌株F113L: 1180,并使用源自根瘤菌的Nod启动子驱动bph高表达。该工程菌不但在土壤生长速度和PCBs的降解效率上显著强于宿主菌,由于F113L: 1180保留了在植物根表定殖成膜的能力,其在改良土壤环境和促进植物生长方面也具有积极作用。另外,鉴于菌膜胞外多糖在生物修复中的强大功能,利用基因工程手段提高EPS产量,进而提高菌株对环境污染物的修复作用,也具有极强的现实意义。例如,Chai等[70]发现了枯草芽孢杆菌生物膜合成受抗阻遏蛋白SinI、阻遏蛋白SinR和下游调节因子SlrR的控制,其中SinR可与胞外多糖基因簇epsA‒O启动子区结合,从而抑制生物膜的形成。Xiong等[36]构建了解淀粉芽孢杆菌(B. amyloliquefaciens)生物膜增强的突变株P29ΔsinR,突变株产生更多的生物膜和膜多糖,不但使细菌对土壤Pb表现出更强的钝化作用,还在根表面和根际土壤上有更多的细胞定殖,与土壤中生物膜形成相关基因(yqxM、tasA、sipW)的表达增加,从而使生菜中铅积累量显著降低。
此外,利用纳米纤维生物膜集成技术(biofilm integrated nanofiber display,BIND)开发的功能生物膜已被证明具有更强的生物修复特性[71]。该技术使用材料科学与合成生物学结合的方法,采用分子编程策略,通过添加肽结构域,对细菌生物膜结构进行改造和优化,增强菌膜生物修复的有效性。例如,Nguyen等[72]对大肠杆菌生物膜进行工程化修饰,在细菌胞外基质中表达淀粉样CsgA融合蛋白,使其在细胞外自组装成淀粉样纳米纤维网络,提高了菌膜的稳定性和固定、黏附底物的能力,将生物膜改造成一种可设计的生物修复材料。
4.2 生物膜菌群的生物修复特性研究发现,细菌群落在污染治理与生态修复中发挥关键作用,而细菌生物膜则是细菌群落构建与菌群之间相互作用的关键[5]。与细菌间相互作用类似,不同细菌之间可以通过协同共生、利他和拮抗等作用形成生物膜,在不同环境下发挥积极作用。就可用于生态修复的细菌群落而言,聚集为生物膜群落不仅可以增强其生存能力,还对其生物降解功能产生影响。Burke等[73]认为生物膜群落的降解功能具有导向性,即生物膜中的污染物降解基因可以基因或质粒的形式释放和扩散,继而通过基因重组或质粒接合进入新宿主,完成细菌间DNA的水平转移[55, 74]。Verhagen等[40]将除草剂污染的土壤颗粒加入活性污泥中,得到了可降解氨基甲酸酯类除草剂的游离状态和生物膜状态的混合菌,并进一步发现虽然生物膜状态的混合菌降解能力较弱,但其稳定性与毒性更小,有助于降解菌的选择性富集,维持长久的降解能力。Balu等[75]发现由热带念珠菌(Candida tropicalis)、酪酸梭菌(Clostridium butyricum)和鞘氨醇杆菌(Sphingobacterium multivorum)等细菌组成的多组分生物膜对16种常见多环芳烃(polycyclic aromatic hydrocarbons,PAH)污染物的去除率达到97%−100%。Eriksson等[76]发现由柄杆菌属(Caulobacter)、贪噬菌属(Variovorax)、鞘氨醇单胞菌属(Sphingomonas)和极单胞菌属(Polaromonas)细菌形成的混合菌群生物膜在60 d内对40 mg/L的芘和菲的去除率分别达到50%和98%。
5 存在问题和展望总而言之,细菌生物被膜作为细菌适应环境而形成的组织群体,可以利用其特性与重金属、有机物等污染物发生相互作用治理污染农田土壤,可谓是土壤修复上的一剂“良药”。然而该领域目前仍然存在一些问题亟待解决:
(1) 在细菌生物膜钝化重金属方面,前文已提到菌膜胞外多糖在该领域发挥的关键作用。然而,由于胞外多糖种类繁多,有关其合成及调控机制的研究仍有不足,还需探索如何通过遗传操作提高修复菌株胞外多糖产量,进而增强细菌修复能力。此外,胞外多糖功能基团的特性及分工也未完全明确,接下来需对生物膜组成及官能团结构进行探究,进一步阐明生物膜对重金属的阻隔机制。
(2) 在生物膜修复有机污染土壤方面,目前仍然存在菌膜对外界环境敏感、修复周期长等缺点。同时,目前对微塑料污染的相关研究集中于水体微塑料污染修复,而在微塑料与农田土壤等陆上生态系统之间的互作研究较少。有必要将多组学研究技术和生态学、形态学分析方法相结合,全面概述土壤微塑料生物膜的功能与生态地位。此外,目前发现的细菌菌膜对土壤微塑料的降解主要集中在聚乙烯上,细菌种类和数量较少,而且降解效果微乎其微,仍需通过合成生物学挖掘大量高效工程微生物和微生物组来降解微塑料[77]。
(3) 在转基因微生物领域,目前基因工程菌在环境中存活的能力仍然较差。一些环境因素,如温度和低营养物浓度及其他不易控制的因素均会影响生物修复的有效性[78]。尽管科学家尝试利用反义RNA和自杀基因阻止基因工程微生物与本土微生物之间的水平基因转移,改变工程菌和环境微生物的种群竞争关系,但效果甚微,未来仍需寻找新方法加以解决。
(4) 虽然现阶段已有大量对细菌生物膜修复污染土壤的研究与报道,但是目前不论是单细菌被膜还是菌群被膜均仅限于对污染土壤中同类污染物(如无机重金属或有机物等)的修复,有关细菌生物膜对复合污染修复的研究仍较少。由于实际环境中农田土壤常存在多种环境污染物,因此有必要探究多功能细菌生物膜的合成或多菌种联合修复作用和机制。
(5) 随着宏基因组序列分析(metagenomic sequence analysis)和相关生物信息学技术的快速发展,微生物菌群修复将在土壤污染治理中发挥更重要的作用。通过人工优化构建的生物膜群落展现出对环境污染物更强的降解能力,这将在土壤难降解污染物的处理中发挥关键作用。利用宏基因组、宏转录组等组学技术寻找新的功能基因与微生物,并结合BIND技术与系统生物学方法,按照需要构建出降解范围广、修复效率高、修复能力强的菌株、细菌群落或可编程生物膜材料,将在环境修复领域具有光明前景。
| [1] |
Zhao FJ, Ma YB, Zhu YG, Tang Z, McGrath SP. Soil contamination in China: current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759. |
| [2] |
Xiao B, Xue PY, Wei L, Liu CC, Gao PP, Fan LM, Du JY, Liu WJ. Characteristics of Cd, As, and Pb in soil and wheat grains and health risk assessment of grain-Cd/as/Pb on the field scale[J]. Environmental Science, 2020, 41(6): 2869-2877. (in Chinese) 肖冰, 薛培英, 韦亮, 刘成程, 高培培, 樊利敏, 杜佳燕, 刘文菊. 基于田块尺度的农田土壤和小麦籽粒镉砷铅污染特征及健康风险评价[J]. 环境科学, 2020, 41(6): 2869-2877. |
| [3] |
Xue YH, Huang HK, Jin T, Chen S, Xu XB, Li SH, Bao Z, Ju XH, Xi B. Research progress on microplastic and pesticide pollutions and their toxic effects on soil organisms[J]. Journal of Agro-Environment Science, 2021, 40(2): 242-251. (in Chinese) 薛颖昊, 黄宏坤, 靳拓, 陈思, 徐湘博, 李少华, 宝哲, 居学海, 习斌. 土壤微塑料和农药污染及其对土壤动物毒性效应的研究进展[J]. 农业环境科学学报, 2021, 40(2): 242-251. |
| [4] |
Sadiq FA, Burmølle M, Heyndrickx M, Flint S, Lu WW, Chen W, Zhao JX, Zhang H. Community-wide changes reflecting bacterial interspecific interactions in multi species biofilms[J]. Critical Reviews in Microbiology, 2021, 47(3): 338-358. DOI:10.1080/1040841X.2021.1887079 |
| [5] |
Wen DH, Zhang N, Yu C, Li QL. Community structure and contaminant degradation function of biofilm in environmental engineering systems[J]. Microbiology China, 2014, 41(7): 1394-1401. (in Chinese) 温东辉, 张楠, 于聪, 李琪琳. 环境中生物膜的菌群结构与污染物降解特性[J]. 微生物学通报, 2014, 41(7): 1394-1401. |
| [6] |
Suksabye P, Pimthong A, Dhurakit P, Mekvichitsaeng P, Thiravetyan P. Effect of biochars and microorganisms on cadmium accumulation in rice grains grown in Cd-contaminated soil[J]. Environmental Science and Pollution Research International, 2016, 23(2): 962-973. DOI:10.1007/s11356-015-4590-8 |
| [7] |
Schue M, Fekete A, Ortet P, Brutesco C, Heulin T, Schmitt-Kopplin P, Achouak W, Santaella C. Modulation of metabolism and switching to biofilm prevail over exopolysaccharide production in the response of Rhizobium alamii to cadmium[J]. PLoS One, 2011, 6(11): e26771. DOI:10.1371/journal.pone.0026771 |
| [8] |
Koo H, Allan RN, Howlin RP, Stoodley P, Hall-Stoodley L. Targeting microbial biofilms: current and prospective therapeutic strategies[J]. Nature Reviews Microbiology, 2017, 15(12): 740-755. DOI:10.1038/nrmicro.2017.99 |
| [9] |
Sutherland IW. The biofilm matrix-an immobilized but dynamic microbial environment[J]. Trends in Microbiology, 2001, 9(5): 222-227. DOI:10.1016/S0966-842X(01)02012-1 |
| [10] |
Alpkvist E, Picioreanu C, Van Loosdrecht MCM, Heyden A. Three-dimensional biofilm model with individual cells and continuum EPS matrix[J]. Biotechnology and Bioengineering, 2006, 94(5): 961-979. DOI:10.1002/bit.20917 |
| [11] |
Liu JC, Fang JY, Zhu JL. A brief review of biofilm matrix in structured microbial communities[J]. Acta Microbiologica Sinica, 2022, 62(1): 47-56. (in Chinese) 刘静聪, 方金玉, 朱军莉. 细菌生物被膜基质的研究进展[J]. 微生物学报, 2022, 62(1): 47-56. |
| [12] |
Fukushi K, Kato S, Antsuki T, Omura T. Isolation of copper-binding proteins from activated sludge culture[J]. Water Science and Technology: a Journal of the International Association on Water Pollution Research, 2001, 44(2/3): 453-459. |
| [13] |
Bowen WH, Burne RA, Wu H, Koo H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments[J]. Trends in Microbiology, 2018, 26(3): 229-242. DOI:10.1016/j.tim.2017.09.008 |
| [14] |
Hoarau G, Mukherjee PK, Gower-Rousseau C, Hager C, Chandra J, Retuerto MA, Neut C, Vermeire S, Clemente J, Colombel JF, et al. Bacteriome and mycobiome interactions underscore microbial dysbiosis in familial Crohn՚s disease[J]. mBio, 2016, 7(5): e01250-e01216. |
| [15] |
Dade-Robertson M, Keren-Paz A, Zhang M, Kolodkin-Gal I. Architects of nature: growing buildings with bacterial biofilms[J]. Microbial Biotechnology, 2017, 10(5): 1157-1163. DOI:10.1111/1751-7915.12833 |
| [16] |
Karygianni L, Ren Z, Koo H, Thurnheer T. Biofilm matrixome: extracellular components in structured microbial communities[J]. Trends in Microbiology, 2020, 28(8): 668-681. DOI:10.1016/j.tim.2020.03.016 |
| [17] |
Brown MJ, Lester JN. Comparison of bacterial extracellular polymer extraction methods[J]. Applied and Environmental Microbiology, 1980, 40(2): 179-185. DOI:10.1128/aem.40.2.179-185.1980 |
| [18] |
Lion LW, Shuler ML, Hsieh KM, Ghiorse WC, Corpe WA. Trace metal interactions with microbial biofilms in natural and engineered systems[J]. Critical Reviews in Environmental Control, 1988, 17(4): 273-306. DOI:10.1080/10643388809388338 |
| [19] |
Xing YH, Luo XS, Liu S, Wan WJ, Huang QY, Chen WL. Synergistic effect of biofilm growth and cadmium adsorption via compositional changes of extracellular matrix in montmorillonite system[J]. Bioresource Technology, 2020, 315: 123742. DOI:10.1016/j.biortech.2020.123742 |
| [20] |
Kaçar Y, Arpa Ç, Tan SM, Denizli A, Genç Ö, Arıca MY. Biosorption of Hg(Ⅱ) and Cd(Ⅱ) from aqueous solutions: comparison of biosorptive capacity of alginate and immobilized live and heat inactivated Phanerochaete chrysosporium[J]. Process Biochemistry, 2002, 37(6): 601-610. DOI:10.1016/S0032-9592(01)00248-5 |
| [21] |
Chen GC. Molecular mechanisms of heavy metals tolerance and accumulation in unsaturated Pseudomonas putida CZ1 biofilm[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2011 (in Chinese) 陈光村. 恶臭假单胞菌CZ1非饱和生物膜耐受和累积重金属的分子机制[D]. 杭州: 浙江大学博士学位论文, 2011. |
| [22] |
Zhang YJ, He LY, Zeng Q, Sheng XF. Surfactin production by Bacillus subtilis B12 under Cd stress and its effect on biofilm formation and Cd removal[J]. Microbiology China, 2021, 48(6): 1883-1894. (in Chinese) 张亚见, 何琳燕, 曾仟, 盛下放. Cd胁迫下枯草芽孢杆菌B12产表面活性素及其对生物被膜形成和Cd去除的影响[J]. 微生物学通报, 2021, 48(6): 1883-1894. |
| [23] |
Raklami A, Oufdou K, Tahiri AI, Mateos-Naranjo E, Navarro-Torre S, Rodríguez-Llorente ID, Meddich A, Redondo-Gómez S, Pajuelo E. Safe cultivation of Medicago sativa in metal-polluted soils from semi-arid regions assisted by heat- and metallo-resistant PGPR[J]. Microorganisms, 2019, 7(7): 212. DOI:10.3390/microorganisms7070212 |
| [24] |
Meliani A, Bensoltane A. Biofilm-mediated heavy metals bioremediation in PGPR Pseudomonas[J]. Journal of Bioremediation & Biodegradation, 2016, 7(5): 370. |
| [25] |
Ge ZB, Yin TT, Zhou QQ, Zhang J, Sheng XF, He LY. Reduced cadmium and lead uptake by leafy vegetables and soil remediation in the presence of the biofilm-producing Bacillus strains[J]. Journal of Nanjing Agricultural University, 2020, 43(1): 80-88. (in Chinese) 葛占标, 殷涂童, 周倩倩, 张静, 盛下放, 何琳燕. 产生物膜芽胞杆菌阻控叶菜吸收镉、铅及其修复菜地土壤的作用[J]. 南京农业大学学报, 2020, 43(1): 80-88. |
| [26] |
Zhan XH, Ma HL, Zhou LX, Liang JR, Jiang TH, Xu GH. Accumulation of phenanthrene by roots of intact wheat (Triticum acstivnm L.) seedlings: passive or active uptake?[J]. BMC Plant Biology, 2010, 10: 52. DOI:10.1186/1471-2229-10-52 |
| [27] |
Phillips DH. Polycyclic aromatic hydrocarbons in the diet[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 1999, 443(1/2): 139-147. |
| [28] |
Lerch TZ, Chenu C, Dignac MF, Barriuso E, Mariotti A. Biofilm vs. planktonic lifestyle: consequences for pesticide 2, 4-D metabolism by Cupriavidus necator JMP134[J]. Frontiers in Microbiology, 2017, 8: 904. DOI:10.3389/fmicb.2017.00904 |
| [29] |
Kwak Y, Rhee IK, Shin JH. Application of biofilm-forming bacteria on the enhancement of organophosphorus fungicide degradation[J]. Bioremediation Journal, 2013, 17(3): 173-181. DOI:10.1080/10889868.2013.807773 |
| [30] |
Duc HD. Enhancement of carbofuran degradation by immobilized Bacillus sp. strain DT1[J]. Environmental Engineerring Research, 2022, 27(4): 62-69. |
| [31] |
Zhang H, Qian YY, Fan DD, Tian YN, Huang X. Biofilm formed by Hansschlegelia zhihuaiae S113 on root surface mitigates the toxicity of bensulfuron- methyl residues to maize[J]. Environmental Pollution, 2022, 292: 118366. DOI:10.1016/j.envpol.2021.118366 |
| [32] |
Sivan A, Szanto M, Pavlov V. Biofilm development of the polyethylene-degrading bacterium Rhodococcus ruber[J]. Applied Microbiology and Biotechnology, 2006, 72(2): 346-352. DOI:10.1007/s00253-005-0259-4 |
| [33] |
Templeton AS, Trainor TP, Spormann AM, Newville M, Sutton SR, Dohnalkova A, Gorby Y, Brown GE Jr. Sorption versus biomineralization of Pb(Ⅱ) within Burkholderia cepacia biofilms[J]. Environmental Science & Technology, 2003, 37(2): 300-307. |
| [34] |
Quiton KG, Doma B Jr, Futalan CM, Wan MW. Removal of chromium(Ⅵ) and zinc(Ⅱ) from aqueous solution using Kaolin-supported bacterial biofilms of Gram-negative E. coli and Gram-positive Staphylococcus epidermidis[J]. Sustainable Environment Research, 2018, 28(5): 206-213. DOI:10.1016/j.serj.2018.04.002 |
| [35] |
Xing YH, Tan SX, Liu S, Xu SZ, Wan WJ, Huang QY, Chen WL. Effective immobilization of heavy metals via reactive barrier by rhizosphere bacteria and their biofilms[J]. Environmental Research, 2022, 207: 112080. DOI:10.1016/j.envres.2021.112080 |
| [36] |
Xiong ZH, Zheng JW, Sun HR, Hu JW, Sheng XF, He LY. Biofilm-overproducing Bacillus amyloliquefaciens P29ΔsinR decreases Pb availability and uptake in lettuce in Pb-polluted soil[J]. Journal of Environmental Management, 2022, 302: 114016. DOI:10.1016/j.jenvman.2021.114016 |
| [37] |
Henagamage AP, Peries CM, Seneviratne G. Fungal-bacterial biofilm mediated heavy metal rhizo-remediation[J]. World Journal of Microbiology and Biotechnology, 2022, 38(5): 1-13. |
| [38] |
Lin ZQ, Zhang WP, Pang SM, Huang YH, Mishra S, Bhatt P, Chen SH. Current approaches to and future perspectives on methomyl degradation in contaminated soil/water environments[J]. Molecules: Basel, Switzerland, 2020, 25(3): 738. DOI:10.3390/molecules25030738 |
| [39] |
Dash DM, Osborne WJ. Rapid biodegradation and biofilm-mediated bioremoval of organophosphorus pesticides using an indigenous Kosakonia oryzae strain-ⅥTPSCQ3 in a vertical-flow packed bed biofilm bioreactor[J]. Ecotoxicology and Environmental Safety, 2020, 192: 110290. DOI:10.1016/j.ecoenv.2020.110290 |
| [40] |
Verhagen P, De Gelder L, Hoefman S, De Vos P, Boon N. Planktonic versus biofilm catabolic communities: importance of the biofilm for species selection and pesticide degradation[J]. Applied and Environmental Microbiology, 2011, 77(14): 4728-4735. DOI:10.1128/AEM.05188-11 |
| [41] |
Peixoto J, Silva LP, Krüger RH. Brazilian Cerrado soil reveals an untapped microbial potential for unpretreated polyethylene biodegradation[J]. Journal of Hazardous Materials, 2017, 324: 634-644. DOI:10.1016/j.jhazmat.2016.11.037 |
| [42] |
Kim HR, Lee HM, Yu HC, Jeon E, Lee S, Li JJ, Kim DH. Biodegradation of polystyrene by Pseudomonas sp. isolated from the gut of superworms (larvae of Zophobas atratus)[J]. Environmental Science & Technology, 2020, 54(11): 6987-6996. |
| [43] |
Arunrattiyakorn P, Ponprateep S, Kaennonsang N, Charapok Y, Punphuet Y, Krajangsang S, Tangteerawatana P, Limtrakul A. Biodegradation of polystyrene by three bacterial strains isolated from the gut of superworms (Zophobas atratus larvae)[J]. Journal of Applied Microbiology, 2022, 132(4): 2823-2831. DOI:10.1111/jam.15474 |
| [44] |
Fomina M, Gadd GM. Biosorption: current perspectives on concept, definition and application[J]. Bioresource Technology, 2014, 160: 3-14. DOI:10.1016/j.biortech.2013.12.102 |
| [45] |
Wang P, Jiang XL, Jiang YH, Guan HS. Review on research and development on structure-function relationship and characteristics of bacterial exopolysaccharides[J]. Food Science, 2005, 26(11): 257-260. (in Chinese) 王鹏, 江晓路, 江艳华, 管华诗. 细菌胞外多糖构效关系及特性的研究[J]. 食品科学, 2005, 26(11): 257-260. |
| [46] |
Gadd GM. Microbial influence on metal mobility and application for bioremediation[J]. Geoderma, 2004, 122(2/3/4): 109-119. |
| [47] |
Ge YN, Zhang C, Zhang CZ, Huang W. Study on adsorption effect and mechanism of EPS organic matter to soil heavy metals[J]. Modern Chemical Industry, 2021, 41(9): 112-117. (in Chinese) 葛亚男, 张弛, 张聪政, 黄伟. EPS有机质对土壤重金属的吸附效果及机理研究[J]. 现代化工, 2021, 41(9): 112-117. |
| [48] |
Cloete TE, Oosthuizen DJ. The role of extracellular exopolymers in the removal of phosphorus from activated sludge[J]. Water Research, 2001, 35(15): 3595-3598. DOI:10.1016/S0043-1354(01)00093-8 |
| [49] |
Rasulov BA, Yili A, Aisa HA. Biosorption of metal ions by exopolysaccharide produced by Azotobacter chroococcum XU1[J]. Journal of Environmental Protection, 2013, 4(9): 989-993. DOI:10.4236/jep.2013.49114 |
| [50] |
Wei X, Fang LC, Cai P, Huang QY, Chen H, Liang W, Rong XM. Influence of extracellular polymeric substances (EPS) on Cd adsorption by bacteria[J]. Environmental Pollution, 2011, 159(5): 1369-1374. DOI:10.1016/j.envpol.2011.01.006 |
| [51] |
Bal AS, Dhagat NN. Upflow anaerobic sludge blanket reactor: a review[J]. Indian Journal of Environmental Health, 2001, 43(2): 1-82. |
| [52] |
Beauregard PB, Chai YR, Vlamakis H, Losick R, Kolter R. Bacillus subtilis biofilm induction by plant polysaccharides[J]. PNAS, 2013, 110(17): E1621-E1630. |
| [53] |
Liu J, Ling WT, Sheng YH, Gu YJ, Gao YZ. Biofilm formation of functional bacteria on root surfaces and its potential applications on organic contaminant control and soil remediation[J]. Journal of Agro-Environment Science, 2013, 32(11): 2112-2117. (in Chinese) 刘娟, 凌婉婷, 盛月慧, 顾玉骏, 高彦征. 根表功能细菌生物膜及其在土壤有机污染控制与修复中的潜在应用价值[J]. 农业环境科学学报, 2013, 32(11): 2112-2117. DOI:10.11654/jaes.2013.11.002 |
| [54] |
Singh R, Paul D, Jain RK. Biofilms: implications in bioremediation[J]. Trends in Microbiology, 2006, 14(9): 389-397. DOI:10.1016/j.tim.2006.07.001 |
| [55] |
Whitchurch CB, Tolker-Nielsen T, Ragas PC, Mattick JS. Extracellular DNA required for bacterial biofilm formation[J]. Science, 2002, 295(5559): 1487. DOI:10.1126/science.295.5559.1487 |
| [56] |
Sarand I, Timonen S, Nurmiaho-Lassila EL, Koivula T, Haahtela K, Romantschuk M, Sen R. Microbial biofilms and catabolic plasmid harbouring degradative fluorescent pseudomonads in Scots pine mycorrhizospheres developed on petroleum contaminated soil[J]. FEMS Microbiology Ecology, 1998, 27(2): 115-126. DOI:10.1111/j.1574-6941.1998.tb00529.x |
| [57] |
Goris J, Boon N, Lebbe L, Verstraete W, De Vos P. Diversity of activated sludge bacteria receiving the 3-chloroaniline-degradative plasmid pC1gfp[J]. FEMS Microbiology Ecology, 2003, 46(2): 221-230. DOI:10.1016/S0168-6496(03)00231-9 |
| [58] |
Springael D, Peys K, Ryngaert A, Roy SV, Hooyberghs L, Ravatn R, Heyndrickx M, Van Der Meer JR, Vandecasteele C, Mergeay M, et al. Community shifts in a seeded 3-chlorobenzoate degrading membrane biofilm reactor: indications for involvement of in situ horizontal transfer of the clc-element from inoculum to contaminant bacteria[J]. Environmental Microbiology, 2002, 4(2): 70-80. DOI:10.1046/j.1462-2920.2002.00267.x |
| [59] |
Muhonja CN, Makonde H, Magoma G, Imbuga M. Biodegradability of polyethylene by bacteria and fungi from Dandora dumpsite Nairobi-Kenya[J]. PLoS One, 2018, 13(7): e0198446. DOI:10.1371/journal.pone.0198446 |
| [60] |
Zhang MJ, Zhao YR, Qin X, Jia WQ, Chai LW, Huang MK, Huang Y. Microplastics from mulching film is a distinct habitat for bacteria in farmland soil[J]. Science of the Total Environment, 2019, 688: 470-478. DOI:10.1016/j.scitotenv.2019.06.108 |
| [61] |
Ju ZC, Jin DC, Deng Y. The interaction between plastics and microorganisms in soil and their ecological effects[J]. China Environmental Science, 2021, 41(5): 2352-2361. (in Chinese) 鞠志成, 金德才, 邓晔. 土壤中塑料与微生物的相互作用及其生态效应[J]. 中国环境科学, 2021, 41(5): 2352-2361. DOI:10.3969/j.issn.1000-6923.2021.05.043 |
| [62] |
Ya HB, Jiang B, Xing Y, Zhang T, Lv MJ, Wang X. Recent advances on ecological effects of microplastics on soil environment[J]. Science of the Total Environment, 2021, 798: 149338. DOI:10.1016/j.scitotenv.2021.149338 |
| [63] |
Wang ZR, Sheng JP, Shen L. Biosynthesis of bacterial exopolysaccharides and gene cluster[J]. Biotechnology Bulletin, 2010(11): 48-55. (in Chinese) 王正荣, 生吉萍, 申琳. 细菌胞外多糖的生物合成与基因控制[J]. 生物技术通报, 2010(11): 48-55. |
| [64] |
Yoshida T, Ayabe Y, Yasunaga M, Usami Y, Habe H, Nojiri H, Omori T. Genes involved in the synthesis of the exopolysaccharide methanolan by the obligate methylotroph Methylobacillus sp. strain 12S[J]. Microbiology: Reading, England, 2003, 149(Pt 2): 431-444
|
| [65] |
Kumari S, Das S. Expression of metallothionein encoding gene bmtA in biofilm-forming marine bacterium Pseudomonas aeruginosa N6P6 and understanding its involvement in Pb(Ⅱ) resistance and bioremediation[J]. Environmental Science and Pollution Research International, 2019, 26(28): 28763-28774. DOI:10.1007/s11356-019-05916-2 |
| [66] |
Sterritt RM, Brown MJ, Lester JN. Metal removal by adsorption and precipitation in the activated sludge process[J]. Environmental Pollution Series A, Ecological and Biological, 1981, 24(4): 313-323. DOI:10.1016/0143-1471(81)90068-4 |
| [67] |
Valls M, De Lorenzo V. Exploiting the genetic and biochemical capacities of bacteria for the remediation of heavy metal pollution[J]. FEMS Microbiology Reviews, 2002, 26(4): 327-338. |
| [68] |
Liu S, Zhang F, Chen J, Sun GX. Arsenic removal from contaminated soil via biovolatilization by genetically engineered bacteria under laboratory conditions[J]. Journal of Environmental Sciences, 2011, 23(9): 1544-1550. |
| [69] |
Villacieros M, Whelan C, Mackova M, Molgaard J, Sánchez-Contreras M, Lloret J, De Cárcer DA, Oruezábal RI, Bolaños L, Macek T, et al. Polychlorinated biphenyl rhizoremediation by Pseudomonas fluorescens F113 derivatives, using a Sinorhizobium meliloti nod system to drive bph gene expression[J]. Applied and Environmental Microbiology, 2005, 71(5): 2687-2694. |
| [70] |
Chai YR, Kolter R, Losick R. Paralogous antirepressors acting on the master regulator for biofilm formation in Bacillus subtilis[J]. Molecular Microbiology, 2009, 74(4): 876-887. |
| [71] |
Jasu A, Ray RR. Biofilm mediated strategies to mitigate heavy metal pollution: a critical review in metal bioremediation[J]. Biocatalysis and Agricultural Biotechnology, 2021, 37: 102183. |
| [72] |
Nguyen PQ, Botyanszki Z, Tay PKR, Joshi NS. Programmable biofilm-based materials from engineered curli nanofibres[J]. Nature Communications, 2014, 5: 4945. |
| [73] |
Burke C, Steinberg P, Rusch D, Kjelleberg S, Thomas T. Bacterial community assembly based on functional genes rather than species[J]. PNAS, 2011, 108(34): 14288-14293. |
| [74] |
Molin S, Tolker-Nielsen T. Gene transfer occurs with enhanced efficiency in biofilms and induces enhanced stabilisation of the biofilm structure[J]. Current Opinion in Biotechnology, 2003, 14(3): 255-261. |
| [75] |
Balu S, Bhunia S, Gachhui R, Mukherjee J. Assessment of polycyclic aromatic hydrocarbon contamination in the Sundarbans, the world՚s largest tidal mangrove forest and indigenous microbial mixed biofilm-based removal of the contaminants[J]. Environmental Pollution, 2020, 266: 115270. |
| [76] |
Eriksson M, Dalhammar G, Mohn WW. Bacterial growth and biofilm production on pyrene[J]. FEMS Microbiology Ecology, 2002, 40(1): 21-27. |
| [77] |
Huang Y, Jia WX, Li K, Yang YF. Interaction between soil microplastics and microorganisms[J]. Acta Scientiae Circumstantiae, 2022. 黄艺, 贾薇茜, 李康, 杨云锋. 土壤微塑料与微生物的相互作用关系[J]. 环境科学学报, 2022. DOI:10.13671/j.hjkxxb.2021.0303 |
| [78] |
Freitas EV, Nascimento CW, Souza A, Silva FB. Citric acid-assisted phytoextraction of lead: a field experiment[J]. Chemosphere, 2013, 92(2): 213-217. |
 2022, Vol. 49
2022, Vol. 49