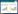扩展功能
文章信息
- 王洪秀, 章炉军, 孙鹏, 胡佳, 陈绪涛, 魏云辉
- WANG Hongxiu, ZHANG Lujun, SUN Peng, HU Jia, CHEN Xutao, WEI Yunhui
- 茶树菇原生质体再生及单核体菌株的特性
- Protoplast regeneration and monokaryotation characteristics of Cyclocybe aegerita
- 微生物学通报, 2022, 49(6): 2076-2087
- Microbiology China, 2022, 49(6): 2076-2087
- DOI: 10.13344/j.microbiol.china.210738
-
文章历史
- 收稿日期: 2021-08-12
- 接受日期: 2021-12-06
- 网络首发日期: 2022-03-10
2. 上海市农业科学院食用菌研究所, 上海 201403
2. Institute of Edible Fungi, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China
茶树菇(Cyclocybe aegerita)属于假脐菇科(Tubariaceae)环伞属(Cyclocybe)[1],分布于我国江西、福建、云南、浙江及四川等地。因其生长宿主的多样性及形态上的细微差别,又被称为杨树菇、柳松茸、柳环菌[2]。茶树菇是高蛋白、低脂肪、低糖分且集营养、保健和食疗于一体的珍稀食用菌。江西省茶树菇产量为全国第一[3],种植规模较大。交配型研究是茶树菇野生菌种驯化和品种选育的基础。茶树菇的交配系统属于四极性异宗结合[4],双核体菌丝中存在两种交配型,具有异宗结合食用菌的基本遗传特征。潘迎捷等[5]通过研究6种异宗结合食用菌的原生质体单核化现象和单核原生质体的遗传规律,发现单核原生质体中保留了亲本中的两种交配型AxBx和AyBy,未出现亲本双核体在减数分裂阶段通过基因重组形成的其他两种新交配型AxBy和AyBx,亲本交配型这一遗传性状在单核原生质体再生菌丝中是稳定的。真菌原生质体技术的研究至今已有60多年的历史,原生质体技术可应用于食用菌交配型鉴定[5]、细胞质遗传[6]及基因型遗传规律的研究[7]等。因此,深入开展食用菌原生质体技术的研究仍具有重要的理论意义和应用价值。
茶树菇遗传育种工作是茶树菇产业持续发展的保障和关键,原生质体的制备及单核体菌株的获得可为茶树菇遗传育种工作的开展提供技术支持。自1972年荷兰研究人员首次采用裂解酶获得裂褶菌(Schizophyllum commune)原生质体[8]后,目前已有超过70种食用菌成功地制备了原生质体[9],原生质体技术已广泛应用于食用菌的研究[10]。在茶树菇原生质体制备和利用方面,邱敦莲等[11]通过原生质体的分离和再生筛选到一株茶树菇单核体菌株;张渊等[12-13]通过原生质体紫外诱变选育了茶树菇新菌株;江力等[14-15]通过原生质体制备研究了茶树菇原生质体的融合、茶树菇与鸡腿菇原生质体的融合及再生。目前尚未见研究茶树菇单核体菌株特性及交配型的完整文献报道。因此,本文采用在铺有玻璃纸的平板上培养菌丝的方法制备茶树菇原生质体[16],从接种块数量、酶解温度和酶解时间三方面对茶树菇原生质体制备过程进行优化,并对茶树菇原生质体的再生特性、单核化特性及其交配型进行研究,以期为开展茶树菇的杂交育种、融合育种、诱变育种、遗传转化和功能基因挖掘等奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试菌株茶树菇C. aegerita菌株‘Aa11’由江西省农业科学院农业应用微生物研究所食用菌育种室提供。
1.1.2 培养基(1) PDA培养基:马铃薯200.0 g,葡萄糖20.0 g,琼脂20.0 g,水1 000 mL。(2) PDMS再生培养基:马铃薯200.00 g,葡萄糖20.00 g,琼脂20.00 g,蔗糖205.38 g,麦芽糖1.00 g,定容至1 000 mL。
1.1.3 主要试剂(1) 0.6 mol/L甘露醇:称取甘露醇10.93 g,用双蒸水溶解定容至100 mL,1×105 Pa灭菌20 min备用。(2) 1.5%溶壁酶:称取溶壁酶0.09 g,用6 mL 0.6 mol/L的甘露醇溶解,0.45 μm滤膜过滤除菌。
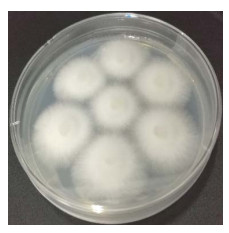
1.2 方法 1.2.1 原生质体的制备采用李良敏等[16]的方法制备茶树菇原生质体,使用的平板菌丝如图 1所示,即在铺有玻璃纸的平板上接种7个茶树菇菌丝块,待菌落的菌丝相互接触时,直接在玻璃纸上对菌丝进行酶解(图 2)。
|
| 图 1 茶树菇原生质体制备所用平板菌丝生长情况 Figure 1 Growth of plate mycelia used for protoplasm system preparation of C. aegerita. |
|
|
|
| 图 2 平板菌丝酶解情况 Figure 2 Enzymatic hydrolysis of plate mycelia. |
|
|
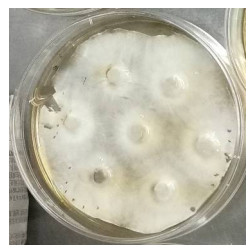
分别在平板上接种3、5、7、10个茶树菇菌丝块,接种1个菌丝块的平板作为对照,待不同菌落的菌丝相互接触时(图 3),记录各平板的培养时间,原生质体制备其他步骤参照1.2.1。
|
| 图 3 茶树菇不同接种块数量的平板菌丝生长情况 Figure 3 Growth of plate mycelia in different inoculum number of C. aegerita. A−E:接种块数量分别是1、3、5、7和10 A−E: The number of inoculated blocks 1, 3, 5, 7 and 10 respectively. |
|
|
制备原生质体使用接种7个茶树菇菌丝块的平板,酶解温度分别设置为30、32、34和36 ℃这4个温度梯度,酶解时间分别设置为30、60、120和180 min这4个时间梯度。
1.2.4 原生质体的再生采用张美彦等[7, 17]的方法进行原生质体的再生培养,并计算原生质体再生率和原生质体单核率。原生质体再生率=分离获得的再生菌株数量/涂布的原生质体数量;原生质体单核率=单核菌株数量/再生菌株数量。
1.2.5 交配型鉴定采用张美彦等[17]和谭琦[18]的方法进行交配型鉴定实验,同时每天观察对峙培养亲本单核菌丝体的菌落形态变化。
1.3 统计分析用Excel 2007进行统计分析,并以SPSS 22.0进行方差分析,使用OriginPro 8进行图表制作。
2 结果与分析 2.1 不同接种块数量下的菌丝培养时间和原生质体得率接种块数量为7时制备的原生质体得率最高。如表 1所示,接种块数量由1增加至3和5时,菌丝培养时间均显著缩短,从280 h减少至136 h和112 h,原生质体的得率未显著增加;接种块数量由5增加至7时,菌丝培养时间未显著缩短,但原生质体得率则显著增加,增加了13倍;当接种块数量增加至10时,原生质体得率又下降,也表现出显著差异。
| 接种块数量 Inoculated mycelial block number |
茶树菇菌株‘Aa11’ C. aegerita ‘Aa11’ |
|
| 培养时间 Incubation time (d) |
每毫升原生质体数量 Protoplast number per mL |
|
| 1 | 280±8a | (2.25±0.05)×106d |
| 3 | 136±8b | (3.06±0.04)×106c |
| 5 | 112±8c | (3.69±0.05)×106b |
| 7 | 96±0cd | (4.79±0.38)×107a |
| 10 | 80±8d | (1.37±0.04)×106e |
| 注:不同小写字母表示在P<0.000 1水平上的显著差异 Note: Different lowercase letters indicate significant difference at the P<0.000 1 level. |
||
如图 4所示,酶解温度为30 ℃时茶树菇原生质体数量为1.86×107个/mL;酶解温度为32 ℃时原生质体数量显著上升,为4.98×107个/mL;酶解温度为34 ℃时原生质体数量达到最大值,为6.75×107个/mL;酶解温度为36 ℃时原生质体数量显著下降,原生质体数量下降至106个/mL水平。从曲线的走向可知,最佳的酶解温度为33−34 ℃。

|
| 图 4 酶解温度对原生质体数量的影响 Figure 4 Effect of enzymatic hydrolysis temperature on the number of protoplasts. 不同小写字母表示在P<0.000 1水平上的显著差异。下同 Different lowercase letters indicate significant difference at the P < 0.000 1 level. The same below. |
|
|
如图 5所示,酶解时间为30 min时,茶树菇原生质体数量为1.33×107个/mL;酶解时间为60 min时,原生质体数量达到最大值,为3.46×107个/mL;酶解时间延长至120、180 min,原生质体数量显著下降,120 min酶解后仍能维持在含有1.62×107个/mL;酶解时间为180 min时,原生质体数量不足107个/mL。从曲线的走向可知,最佳的酶解时间为60−80 min。

|
| 图 5 酶解时间对原生质体数量的影响 Figure 5 Effect of enzymatic hydrolysis time on the number of protoplasts. |
|
|
结合2.1、2.2的结果可知,在制备茶树菇原生质体时,当接种块数量为7、酶解温度在33−34 ℃、酶解时间为60−80 min时,可以获得较多原生质体。
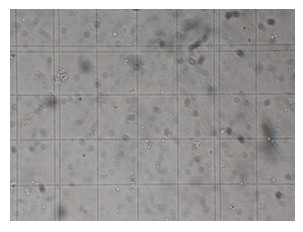
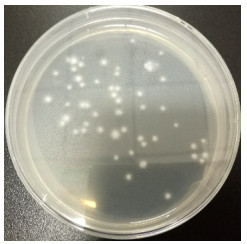
2.4 原生质体再生特性茶树菇单个平板制备的原生质体浓度为6.7×106个/mL,将原生质体悬液梯度稀释后涂布至再生培养基表面,经25 ℃恒温培养,至第7天时肉眼即可见到有再生菌落形成,第10−11天可以看到清楚的白色菌落。图 6和图 7分别为制备的茶树菇原生质体及其再生菌落。继续培养至不再有菌落出现为止,统计再生菌落数,结果表明,菌株Aa11的再生率达0.71%。
|
| 图 6 茶树菇原生质体 Figure 6 Protoplast of C. aegerita (10×). |
|
|
|
| 图 7 茶树菇原生质体再生菌落 Figure 7 Regenerative colony of protoplast of C. aegerita. |
|
|
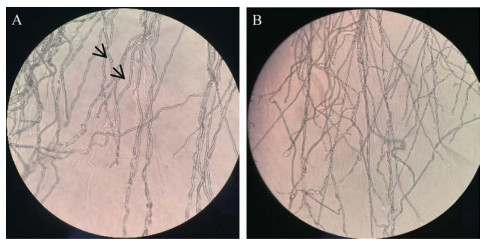
培养皿中的原生质体再生菌落的生长状况有较大的差异,异核体再生菌落大,菌丝纹路清晰,呈发散状,生长较快(图 8A);单核体再生菌落小,呈绒球状,菌丝均质、细密,不向外发散,生长较慢,各单核体菌株的菌落形态无较大差异(图 8B)。显微镜观察结果与蔡衍山等[4]报道的结果一致,即异核菌丝略粗,粗细较均匀,有锁状联合(图 9A);单核菌丝较细,粗细较不均匀,无锁状联合(图 9B)。

|
| 图 8 茶树菇原生质体再生菌落形态 Figure 8 Morphology of regeneration colonies of protoplast of C. aegerita. A:异核菌株;B:单核菌株 A: Dual-core strains; B: Mononuclear strains. |
|
|
|
| 图 9 茶树菇原生质体再生菌株菌丝形态(40×) Figure 9 Mycelial morphology of protoplast regeneration strains of C. aegerita (40×). A:异核菌株(箭头所示为锁状联合);B:单核菌株 A: Dual-core strains (the arrow shows a clamp); B: Mononuclear strains. |
|
|
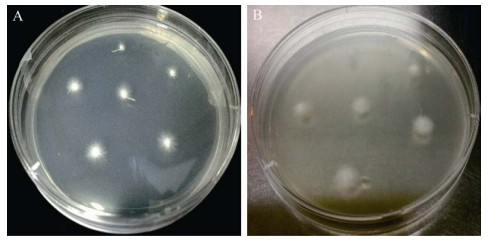
从培养皿中出现再生菌落开始,即通过镜检来判断再生菌落的单双核情况,结果表明,第7天时再生菌落开始出现;第7−10天再生菌落几乎均为异核体菌株;第11天开始陆续出现单核体菌落,持续时间有15 d之久,直到不再有单核体菌落出现。第7天和第12天挑取的再生菌落在平板上的生长形态如图 10所示,符合上述对单双核菌落生长形态的描述。试验共挑取再生菌落数705个,其中再生单核体菌落数290个,计算得到单核化率为41.1%。
|
| 图 10 茶树菇原生质体再生菌落不同挑取时间的平板生长情况 Figure 10 Plate growth of protoplast regeneration colonies of C. aegerita at different picking times. A:第7天的再生菌落;B:第12天的再生菌落 A: Regenerated colonies at the 7th day; B: Regenerated colonies at the 12th day. |
|
|
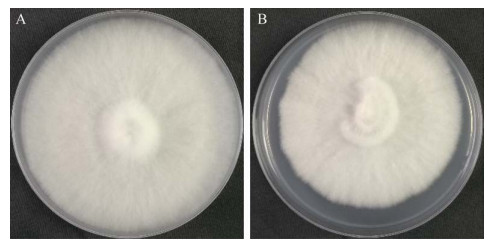
菌株Aa11制备得到290个原生质体单核体,经统计交配型为A1B1的单核体有138株,A2B2的单核体有152株。两种交配型的单核体在菌落形态上无明显差异,都表现为气生菌丝旺盛,颜色浓白,A1B1单核体的生长速度要快于A2B2单核体(图 11)。
|
| 图 11 茶树菇不同交配型的单核体菌落形态 Figure 11 Morphology of mononuclear colonies in different mating types of C. aegerita. A:交配型A1B1的单核体菌落形态;B:交配型A2B2的单核体菌落形态 A: A1B1 mating type; B: A2B2 mating type. |
|
|
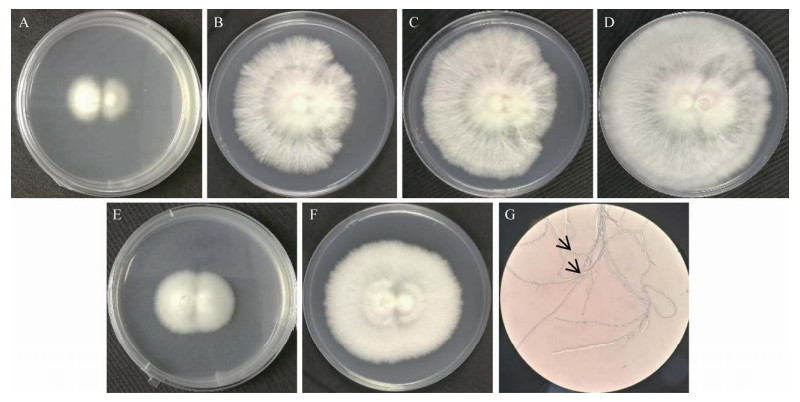
在单核菌丝体对峙培养过程中,随着培养时间的增加,2个亲本菌落不断扩大,对峙培养成功的2个亲本菌落会在接触区域形成一条明显比周围菌丝体稀薄的分界线(图 12A−12D),而对峙培养不成功的2个亲本菌落不会形成一条这样的分界线,并且2个亲本菌落会慢慢融合成一个大的菌落(图 12E和12F)。亲本菌落的生长速度决定了双亲菌落接触区域分界线的弯曲方向和双亲菌落铺满整个培养皿的时间,A1B1交配型亲本菌落的生长速度要大于A2B2交配型亲本;在对峙培养成功的每个培养皿中,双亲菌落接触区域的分界线均向菌落生长速度小的亲本菌落弯曲(图 12B−12D)。由于2个亲本的菌落生长速度都较小,在接触16 d时菌落才铺满整个培养皿,因此,对峙培养成功的2个亲本单核菌丝体采集了接触16 d的菌落(图 12D)。在铺满整个培养皿时,菌落生长速度快的亲本菌落有包围速度小的亲本菌落的趋势(图 12B−12D),对峙培养成功的2个亲本菌落接触区域的菌丝会形成锁状联合(图 12G)。
|
| 图 12 茶树菇两种交配型亲本单核菌丝体对峙培养过程中菌落形态的变化 Figure 12 Changes of colony morphology during hybridization of mononuclear mycelia of two mating parents of C. aegerita. A−D:左侧为A1B1单核体菌株,右侧为A2B2单核体菌株;A:7 d;B:13 d;C:14 d;D:16 d;E−F:左侧为A1B1单核体菌株,右侧为A1B1单核体菌株;E:7 d;F:13 d;G:对峙培养成功异核菌丝(箭头所示为锁状联合) (40×) A−D: The left show A1B1 mononuclear strain, the right show A2B2 mononuclear strain; A: 7 d; B: 13 d; C: 14 d; D: 16 d; E−F: The left show A1B1 mononuclear strain, the right show A1B1 mononuclear strain; E: 7 d; F: 13 d; G: Successful hybridization of dikaryotic hyphae (the arrow shows a clamp) (40×). |
|
|
本研究通过采用在铺有玻璃纸的平板上培养菌丝的方法制备了茶树菇原生质体,即在铺有玻璃纸的PDA平板(直径90 mm)上接种7个茶树菇菌丝块(直径4 mm),培养4 d后将带有菌丝体的玻璃纸转移到另一个无菌培养皿中,直接在菌丝上滴加3 mL的1.5% (质量体积分数)溶壁酶溶液酶解60 min,单个平板制备的原生质体数量为106−107个。该方法与常用的液体培养的菌丝制备原生质体的方法相比具有制备时间短、操作简单和不易污染的优点。
原生质体的再生率是原生质体应用的重要前提,许多条件如菌丝培养阶段的菌龄、培养基成分和培养方式,以及酶解阶段的细胞壁降解酶种类、酶的浓度、酶解时间、酶解温度、酶解液pH、渗透压稳定剂的性质及浓度、预处理方式和再生培养基种类等均影响原生质体得率和再生率[16, 19]。本实验研究了接种块数量、酶解温度和酶解时间对茶树菇原生质体得率的影响,发现在接种块数量为7、酶解温度为33−34 ℃、酶解时间为60−80 min时可获得较多原生质体,这与李良敏等[16]对香菇和金针菇的研究结果和王杰等[20]对草菇的研究结果一致。
根据以往研究报道,食用菌原生质体再生时,单核体的菌株出现晚、菌落小、菌丝细弱、菌丝生长速度小,而异核体的菌株出现早、菌落大、菌丝旺盛、菌丝生长速度大[5, 19, 21]。本研究结果显示,茶树菇也基本符合这一规律,只是单核体菌丝旺盛、颜色浓白,双亲对峙培养后菌落接触部位存在一条明显比周围菌丝体稀疏的分界线,而且此分界线会向菌落扩大速度慢的亲本菌落弯曲,与宋晓霞等[22]对香菇单单杂交过程中的菌落形态变化描述一致。
本研究原生质体分离的单核体中生长速度小的单核体菌株集中在一种交配型中,说明存在一个与交配因子连锁的生长相关基因,这在平菇[23]和杨柳田头菇[24-25]中也得到了证实。大型真菌菌丝生长速度为多基因控制的数量性状(quantitative trait loci,QTL)[26],其涉及酶类、激素分泌和耐温特性等[27-28],交配因子不可能与这么多的基因连锁,而且目前的研究已证明交配因子A和B本身并不连锁且存在于不同的染色体上[25, 29],那么与交配因子连锁的速度生长基因应是调控底物利用相关的酶类和细胞分裂的调控元件,周会明等[30]根据单孢分离重组的结果分析得出,调控元件应该与B因子的其中一个亚基连锁,香菇原生质体去双核化的结果也表明B因子影响核活力[31]。
通过对茶树菇原生质体的再生特性、单核化特性及其交配型的研究,可为开展茶树菇的杂交育种、融合育种、诱变育种、遗传转化和功能基因挖掘等奠定基础,促进茶树菇产业的持续稳定发展。
| [1] |
Liu QM. Studies on multi-gene molecular phylogeny of Cyclocybe aegerita complex and genetic diversity of C. chaxingu[D]. Nanchang: Master's Thesis of Jiangxi Agricultural University, 2020 (in Chinese) 刘祈猛. 茶树菇复合群多基因分子系统学及茶薪菇的遗传多样性研究[D]. 南昌: 江西农业大学硕士学位论文, 2020 |
| [2] |
Liu QM, Liu YL, Chen MH, Zhai ZJ, Zhou JP, Hu DM. Study on the systematics of the genus Agrocybe[J]. Edible Fungi of China, 2020, 39(5): 1-7, 16. (in Chinese) 刘祈猛, 刘郁林, 陈明辉, 翟志军, 周健平, 胡殿明. 田头菇属的系统分类学研究进展[J]. 中国食用菌, 2020, 39(5): 1-7, 16. |
| [3] |
Dai TF, Xu GY, Lu H, Zhang C, Ma FF, Zhang AM. Development status, problems and suggestions of edible fungi industry in Jiangxi Province[J]. Edible Fungi of China, 2020, 39(9): 94-99. (in Chinese) 戴天放, 徐光耀, 卢慧, 张诚, 麻福芳, 张爱民. 江西食用菌产业发展现状、问题与建议[J]. 中国食用菌, 2020, 39(9): 94-99. |
| [4] |
Cai YS, Fu JS, Luo FL, Ke LN, Huang XZ. Studies on the inheritance and breeding technique of Agrocybe chaxingu Huang[J]. Edible Fungi of China, 2007, 26(1): 17-20. (in Chinese) 蔡衍山, 傅俊生, 罗凤来, 柯丽娜, 黄秀治. 茶薪菇遗传模式和育种工艺研究[J]. 中国食用菌, 2007, 26(1): 17-20. DOI:10.3969/j.issn.1003-8310.2007.01.006 |
| [5] |
Pan YJ, Liao HQ, Zhang ST, You ML, Zhao J. A study on monokaryotization by protoplasting of heterokaryotic mushrooms[J]. Acta Agriculturae Shanghai, 1993, 9(2): 1-5. (in Chinese) 潘迎捷, 廖汉泉, 张树庭, 尤美莲, 赵炯. 异宗结合食用菌的原生质体单核化[J]. 上海农业学报, 1993, 9(2): 1-5. |
| [6] |
Fukuda M, Sendo I, Imahori S, Fukumasa-Nakai Y. Transmission of mitochondrial plasmids in protoplast cell fusion between compatible monokaryons of Lentinula edodes[J]. Journal of Wood Science, 2007, 53(3): 264-267. DOI:10.1007/s10086-006-0843-y |
| [7] |
Zhang MY, Tan Q, Chen MJ, Pan YJ. Distribution of a specific SCAR marker among Lentinula edodes protoplast monokaryons for strain 135[J]. Mycosystema, 2008, 27(2): 252-257. (in Chinese) 张美彦, 谭琦, 陈明杰, 潘迎捷. 香菇135菌株特异SCAR标记在其原生质体单核中的分布[J]. 菌物学报, 2008, 27(2): 252-257. |
| [8] |
De Vries OMH, Wessels JGH. Release of protoplasts from Schizophyllum commune by a lytic enzyme preparation from Trichoderma viride[J]. Journal of General Microbiology, 1972, 73(1): 13-22. DOI:10.1099/00221287-73-1-13 |
| [9] |
Ren X, Jia L, Yang FL, Ma FR, Li MC. Research progress on the protoplast fusion technique in edible mushroom breeding[J]. Biotechnology Bulletin, 2008(2): 42-44, 53. (in Chinese) 任轩, 贾乐, 杨凤苓, 马福荣, 李明才. 食用菌原生质体融合育种研究进展[J]. 生物技术通报, 2008(2): 42-44, 53. |
| [10] |
Chang ST, Li GSF, Peberdy JF. Isolation of protoplasts from edible fungi[J]. MIRCEN Journal of Applied Microbiology and Biotechnology, 1985, 1(2): 185-193. DOI:10.1007/BF01742583 |
| [11] |
Qiu DL, Liu BH, Xiao ZQ, Peng WH, Gan BC, Wang B, Yang ZR. Protoplast isolation and colony regeneration in Agrocye chaxingo Huang and the screening of a protoplast-derived monokaryon strain[J]. Journal of Southwest University: Natural Science Edition, 2008, 30(12): 116-120. (in Chinese) 邱敦莲, 刘本洪, 肖在勤, 彭卫红, 甘炳成, 王波, 杨志荣. 茶树菇原生质体的分离和再生以及单核菌株的筛选[J]. 西南大学学报(自然科学版), 2008, 30(12): 116-120. |
| [12] |
Zhang Y, Wang Q, Zhang XM, Zhang HY. The breeding study by UV-inducing protoplast of Agrocybe chaxingu[J]. Journal of Baoding Teachers College, 2003, 16(4): 24-26. (in Chinese) 张渊, 王谦, 张筱梅, 张焕英. 原生质体紫外诱变选育茶薪菇的研究[J]. 保定师范专科学校学报, 2003, 16(4): 24-26. DOI:10.3969/j.issn.1674-2494.2003.04.009 |
| [13] |
Zhang Y, Wang Q, Zhang XM, Zhang HY. A Study on the construction and UV-inducing of Agrocybe chaxinggu protoplast[J]. Edible Fungi of China, 2004, 23(3): 15-17. (in Chinese) 张渊, 王谦, 张筱梅, 张焕英. 茶薪菇原生质体制备及诱变的研究[J]. 中国食用菌, 2004, 23(3): 15-17. DOI:10.3969/j.issn.1003-8310.2004.03.005 |
| [14] |
Jiang L, Liu GQ, Dou W. Study on preparation and fusion of Agrocybe aegerita protoplast[J]. Food Science, 2008, 29(9): 348-351. (in Chinese) 江力, 刘国庆, 窦伟. 茶树菇原生质体制备及融合研究[J]. 食品科学, 2008, 29(9): 348-351. DOI:10.3321/j.issn:1002-6630.2008.09.078 |
| [15] |
Jiang L, Huang JW, Ci LK, Lu YF. Protoplast fusion and regeneration of Agrocybe aegerita and Copyinds comatus[J]. Food Science, 2011, 32(1): 141-144. (in Chinese) 江力, 黄健威, 慈凌坤, 卢云峰. 茶树菇与鸡腿菇原生质体融合及再生[J]. 食品科学, 2011, 32(1): 141-144. |
| [16] |
Li LM, Zhang LJ, Shang XD, Song CY, Yu HL, Zhang MY, Tan Q. A new method for protoplast preparation in edible fungi[J]. Acta Edulis Fungi, 2020, 27(4): 108-114. (in Chinese) 李良敏, 章炉军, 尚晓冬, 宋春艳, 于海龙, 张美彦, 谭琦. 一种食用菌原生质体制备新方法[J]. 食用菌学报, 2020, 27(4): 108-114. |
| [17] |
Zhang MY, Shang XD, Tan Q, Chen MJ, Pan YJ. Distribution and genetic characteristics of specific SCAR markers in Lentinula edodes strain 135[J]. Acta Edulis Fungi, 2008, 15(4): 1-5. (in Chinese) 张美彦, 尚晓冬, 谭琦, 陈明杰, 潘迎捷. 香菇135菌株特异SCAR标记的分布和遗传特性[J]. 食用菌学报, 2008, 15(4): 1-5. DOI:10.3969/j.issn.1005-9873.2008.04.001 |
| [18] |
Tan Q. Study on molecular mechanism and application of symmetric and asymmetric hybridization methods of Lentinus edodes[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2001 (in Chinese) 谭琦. 香菇对称杂交与非对称杂交的机理及应用研究[D]. 南京: 南京农业大学博士学位论文, 2001 |
| [19] |
Yan PS, Li GF, Jiang JH, Huang J. Regeneration and monokaryotation of protoplasts of Stropharia rugoso-annulata[J]. Mycosystema, 2001, 20(1): 107-110. (in Chinese) 闫培生, 李桂舫, 蒋家惠, 黄健. 大球盖菇原生质体再生及单核化特性的研究[J]. 菌物系统, 2001, 20(1): 107-110. DOI:10.3969/j.issn.1672-6472.2001.01.019 |
| [20] |
Wang J, Lin JF, Yun HF, Zhang K, Guo LQ. Studies on preparation, regeneration and transformation of the protoplasts of Volvariella volvacea[J]. Journal of South China Agricultural University, 2007, 28(3): 119-121. (in Chinese) 王杰, 林俊芳, 云慧芬, 张凯, 郭丽琼. 草菇原生质体制备、再生及转化研究[J]. 华南农业大学学报, 2007, 28(3): 119-121. DOI:10.3969/j.issn.1001-411X.2007.03.028 |
| [21] |
Wang XW. Nutrition components analyse, extraction and antioxidant properties of polysaccharide of Stropharia rugoso-annulata[D]. Nanjing: Master's Thesis of Nanjing Normal University, 2007 (in Chinese) 王晓炜. 大球盖菇营养成分分析、多糖提取分离及抗氧化作用研究[D]. 南京: 南京师范大学硕士学位论文, 2007 |
| [22] |
Song XX, Zhang LJ, Zhao Y, Song CY, Li CH, Chen MJ, Tan Q, Huang JC. Nuclear migration and cytoplasmic inheritance during mon-mon crossing of Lentinula edodes[J]. Acta Edulis Fungi, 2021, 28(1): 16-21. (in Chinese) 宋晓霞, 章炉军, 赵妍, 宋春艳, 李传华, 陈明杰, 谭琦, 黄建春. 香菇单单杂交过程中核迁移和细胞质遗传规律[J]. 食用菌学报, 2021, 28(1): 16-21. |
| [23] |
Larraya LM, Pérez G, Iribarren I, Blanco JA, Alfonso M, Pisabarro AG, Ramírez L. Relationship between monokaryotic growth rate and mating type in the edible basidiomycete Pleurotus ostreatus[J]. Applied and Environmental Microbiology, 2001, 67(8): 3385-3390. DOI:10.1128/AEM.67.8.3385-3390.2001 |
| [24] |
Zhou HM, Chai HM, Zhao J, Wei YL, Zhao YC. Correlation analysis between mycelial growth rate and mating type of Agrocybe salicacola based on SPSS statistics[J]. Southwest China Journal of Agricultural Sciences, 2010, 23(6): 1992-1998. (in Chinese) 周会明, 柴红梅, 赵静, 魏云林, 赵永昌. 基于SPSS的杨柳田头菇菌丝生长速度与交配型相关性分析[J]. 西南农业学报, 2010, 23(6): 1992-1998. DOI:10.3969/j.issn.1001-4829.2010.06.047 |
| [25] |
Zhou HM. Studies on the life cycle and classification of Agrocybe salicacola[D]. Kunming: Master's Thesis of Kunming University of Science and Technology, 2011 (in Chinese) 周会明. 杨柳田头菇生活史及分类地位研究[D]. 昆明: 昆明理工大学硕士学位论文, 2011 |
| [26] |
Larraya LM, Alfonso M, Pisabarro AG, Ramírez L. Mapping of genomic regions (quantitative trait loci) controlling production and quality in industrial cultures of the edible basidiomycete Pleurotus ostreatus[J]. Applied and Environmental Microbiology, 2003, 69(6): 3617-3625. DOI:10.1128/AEM.69.6.3617-3625.2003 |
| [27] |
Olson Å. Genetic linkage between growth rate and the intersterility genes S and P in the basidiomycete Heterobasidion annosum s.lat.[J]. Mycological Research, 2006, 110(8): 979-984. DOI:10.1016/j.mycres.2006.05.009 |
| [28] |
Santoyo F, González AE, Terrón MC, Ramírez L, Pisabarro AG. Quantitative linkage mapping of lignin-degrading enzymatic activities in Pleurotus ostreatus[J]. Enzyme and Microbial Technology, 2008, 43(2): 137-143. DOI:10.1016/j.enzmictec.2007.11.007 |
| [29] |
Zhou HM, Zhao YC, Chai HM, Zhang YZ. The extracellular enzymes activity of F1 generations and single-spore isolations in Agrocybe salicacola strain YAAS711[J]. Scientia Agricultura Sinica, 2019, 52(20): 3672-3684. (in Chinese) 周会明, 赵永昌, 柴红梅, 张焱珍. 杨柳田头菇YAAS711菌株F1子代胞外酶活性分析[J]. 中国农业科学, 2019, 52(20): 3672-3684. DOI:10.3864/j.issn.0578-1752.2019.20.017 |
| [30] |
Zhou HM, Zhao YC, Chen WM, Chai HM, Li SH, Zhao J. The relationship between mating factors with mycelial growth rate of Agrocybe salicacola (Bolbitiaceae)[J]. Acta Botanica Yunnanica, 2010, 32(4): 315-322. (in Chinese) 周会明, 赵永昌, 陈卫民, 柴红梅, 李树红, 赵静. 杨柳田头菇交配型因子与菌丝生长速度关系[J]. 云南植物研究, 2010, 32(4): 315-322. |
| [31] |
Cheng SM, Lin FC. Influence of B mating-type factor on recovery of nuclear types from dikaryons in Lentinula edodes[J]. Acta Genetica Sinica, 2005, 32(12): 1301-1304. (in Chinese) 程水明, 林芳灿. B交配型因子对香菇双核体核型分离比的影响[J]. 遗传学报, 2005, 32(12): 1301-1304. |
 2022, Vol. 49
2022, Vol. 49