豆血红蛋白在毕赤酵母中的表达条件优化
陈林杰
,
薛常鲁
,
苏悦
,
肖功年
,
徐志南
,
魏培莲
微生物学通报  2022, Vol. 49 2022, Vol. 49 Issue (6): 2050−2061 Issue (6): 2050−2061
|

豆血红蛋白(leghemoglobin,LegH)是根瘤菌感染大豆后共同产生的植物来源的血红蛋白[1]。虽然豆血红蛋白在氨基酸序列上与动物血红蛋白差异较大,但其三级结构高度相似[2]。豆血红蛋白在烹饪过程中会释放血红素辅因子来催化一些生物分子的反应而产生具有肉香风味的化合物,已有悠久的安全使用历史[3]。在植物蛋白素肉的生产中添加豆血红蛋白可以很大程度上提高植物肉风味,使其与动物肉更为接近[4]。目前LegH的主要来源还是从大豆中提取,但是大豆种植周期长,而且天然LegH在大豆中产量比较低,提取工艺复杂,大规模生产成本过高。因此,利用微生物发酵技术生产LegH受到人们的广泛关注且具有很大的市场前景[5]。
巴斯德毕赤酵母作为目前比较常见的工程菌株之一,与大肠杆菌一样[6],被普遍应用于生产外源蛋白,已经有上千种外源蛋白成功地在毕赤酵母中表达[7-10]。2018年,美国的Impossible Foods公司成功利用毕赤酵母商业化合成大豆血红蛋白并应用于素肉汉堡中[1]。
目前,重组微生物生产的豆血红蛋白作为食品添加剂使用的安全性已被验证[11-12],在美国已经获得了食品药物监督管理局的批准使用,在我国尚无相关法规,国内相关研究也才刚刚起步[13]。虽然目前毕赤酵母发酵手段比较成熟,Invitrogen公司提供的巴斯德毕赤酵母发酵手册中的方法可以作为毕赤酵母发酵前期普适性比较高的发酵方案[14],但是对于不同产物及不同毕赤酵母重组菌株的发酵过程会有一定差异[15],需要针对不同的菌株、不同的发酵产物进行发酵条件的优化[16]。本实验室较早开展了利用酵母系统表达LegH的研究工作,前期已成功构建了能够表达LegH的工程菌株Pichia pastoris GS115-LegH[17]。本研究将对其发酵表达条件进行系统优化,以期为毕赤酵母规模化生产LegH提供基础。
1 材料与方法 1.1 材料 1.1.1 菌株Pichia pastoris GS115-LegH重组菌株,浙江大学实验室构建保存。
1.1.2 主要试剂和仪器及培养基无氨基酵母氮源,Oxoid公司;血红素、生物素、考马斯亮蓝G-250,BBI生命科学有限公司;蛋白胨、酵母粉、葡萄糖、变色酸等试剂均为市售国产分析纯。
荧光成像工作站,环亚生物科技公司;多功能酶标仪,美谷分子仪器有限公司;小型电泳仪,Bio-Rad公司;高速冷冻离心机,贝克曼库尔特股份有限公司;离位灭菌玻璃发酵罐,上海保兴生物设备工程有限公司。
YPD培养基和BMGY培养基:用于毕赤酵母的生长培养[17]。
BMMY培养基:用于毕赤酵母的诱导表达[17]。
PTM1溶液(g/L):硼酸0.02,碘化钾0.09,二水钼酸钠0.20,一水硫酸锰3.00,七水硫酸亚铁65.00,氯化钴0.50,五水硫酸铜6.00,氯化锌20.00,生物素0.20,浓硫酸5 mL/L。
甘油补料培养基:50% (质量体积分数)的甘油,1.2% (体积分数) PTM1。
甲醇补料培养基:100%甲醇,1.2% (体积分数) PTM1,50 μmol/L血红素。
1.2 方法 1.2.1 LegH诱导表达种子培养:将保藏菌种接种到新的YPD平板上,30 ℃恒温培养2−3 d,挑取生长旺盛的单菌落接种于5 mL YPD液体培养基中,30 ℃、250 r/min培养过夜。
生长阶段:取0.5 mL种子液转接于50 mL BMGY培养基中,30 ℃、250 r/min培养16 h至对数生长中期OD600为10.0−15.0;5 000 r/min离心10 min,倒去BMGY培养基,补入等体积BMMY培养基。
诱导表达阶段:向BMMY培养基中添加经过0.22 μm孔径滤膜过滤除菌的血红素至目标浓度,并且每隔24 h在BMMY培养基中补加甲醇至1%进行诱导表达。诱导96 h后,4 ℃、4 000 r/min离心10 min,收集上清液。
1.2.2 LegH表达量测定定性和半定量测定:使用SDS-PAGE电泳分析法[17]。发酵结束,取样进行电泳,经凝胶成像系统扫描后观察电泳条带,并根据条带灰度进行半定量分析。
定量测定:采用Bradford法测定蛋白浓度[17]。
1.2.3 甲醇浓度测定变色酸法测定甲醇浓度[18]。
1.2.4 细胞浓度测定吸取1 mL发酵液至已测定质量的离心管中,5 000 r/min离心10 min,倒去发酵液,用滤纸吸去管壁内残留的液体,倒扣至无液体残留后,测定菌体重量。
1.2.5 LegH表达单因素试验蛋白胨种类、大豆蛋白胨浓度对LegH表达的影响:以BMGY培养基为基础培养基,诱导阶段分别补入含酵母蛋白胨、大豆蛋白胨、酪蛋白胨、牛肉蛋白胨、鱼蛋白胨的BMMY培养基,确定最佳蛋白胨为大豆蛋白胨后,分别向BMMY培养基加入2%、4%、6%、8%大豆蛋白胨,保持其他条件不变,发酵结束后测定LegH表达量。
铁盐种类对LegH表达的影响:以BMGY培养基为基础培养基,在诱导阶段向BMMY培养基中分别加入血红素、氯化铁、硫酸亚铁、柠檬酸铁溶液,终浓度为10 μmol/L,保持其他条件不变,发酵结束后测定LegH表达量。
血红素浓度对LegH表达的影响:在BMMY培养基中加入2.5 μmol/L、5 μmol/L、10 μmol/L的血红素溶液,保持其他条件不变,发酵结束后测定LegH表达量。
甲醇浓度对LegH表达的影响:以BMMY培养基为基础培养基,初始甲醇浓度设置为0.25%、0.50%、1.00%、1.50%和2.00%,每隔24 h补加甲醇至初始浓度,保持其他条件不变,发酵结束后测定LegH表达量。
1.2.6 Plackett-Burman试验确定显著影响因素选用n=12的Plackett-Burman试验设计,考察了9个因素对LegH的影响:X1 (蛋白胨)、X2 (酵母粉)、X3 (碳源)、X4 (发酵液装量)、X5 (生物素)、X6 (甲醇添加量)、X7 (无氨基酵母氮源)、X8 (pH)和X9 (血红素浓度),每个因素取高、低两个水平,响应值为每毫升发酵液中LegH浓度。
1.2.7 Box-Behnken响应面试验设计与分析Plackett-Burman试验确定3个显著影响因子之后,通过最陡爬坡法筛选出最佳试验水平进行响应面设计及分析。
1.2.8 模型验证预测的最佳优化条件为甘油浓度10 g/L、酵母粉浓度10 g/L、血红素浓度5 μmol/L、无氨基酵母氮源(含硫酸铵) 13.4 g/L、生物素浓度4×10−7 g/L、甲醇浓度1%、蛋白胨浓度51.48 g/L、发酵液装量35.84 mL、pH 5.66,在此条件下进行LegH的诱导表达,重复进行3次,取平均值。
1.2.9 5 L发酵罐发酵挑取YPD平板上生长的单菌落接种至YPD试管中,30 ℃、250 r/min培养至OD600为6.0−8.0,取试管中菌液1 mL接种至含有100 mL BMGY的500 mL摇瓶中,30 ℃、250 r/min培养至OD600为10.0−15.0。分批甘油补料阶段使用5 L发酵罐,将种子液200 mL接种在含有2 L优化后BMGY培养基的发酵罐中,温度30 ℃,用氨水调节pH至5.66,发酵罐溶氧维持在30% (气体流速和搅拌转速根据需要进行调节)。发酵至甘油耗尽后,进行甘油补料至合适菌体浓度后饥饿2 h,向发酵液中加入50 μmol/L血红素,然后进行甲醇补料(溶氧高于20%进行补料),每隔一定时间取样测定细胞浓度和LegH产量。
2 结果与讨论 2.1 LegH表达条件单因素优化结果 2.1.1 蛋白胨种类对LegH表达的影响筛选了市面上常见的5种不同来源的蛋白胨(酵母蛋白胨、大豆蛋白胨、酪蛋白胨、牛肉蛋白胨、鱼蛋白胨)进行实验,考察其对毕赤酵母产LegH的影响,结果见图 1。由图 1可知,大豆蛋白胨最有利于LegH的表达,其次是酵母蛋白胨。可能的原因是:大豆蛋白胨来源于大豆,而LegH是根瘤菌感染大豆后产生的一类蛋白,二者有一定的同源性,大豆蛋白胨更能提供LegH合成所需的各类氨基酸。目前多数毕赤酵母表达外源蛋白时,在前期培养阶段主要靠种子培养基中提供的有机氮源,而后期主要以无机氮源为主,原因在于酵母摄取有机氮源时可能会分泌蛋白水解酶,不利于目的蛋白的合成[19]。但从另一个角度讲,蛋白胨作为蛋白质的一种降解产物,可能对防止蛋白酶对蛋白产物的降解也有一定的作用。因此在毕赤酵母的发酵过程中,针对不同的产物,在菌体培养阶段加入一定量的蛋白胨,不仅有利于提高菌体密度,最终也可以提高产物的表达。

|
| 图 1 蛋白胨种类对豆血红蛋白表达的影响 Figure 1 Effects of peptone type on leghemoglobin expression. 1:标准蛋白分子量;2:鱼蛋白胨;3:牛肉蛋白胨;4:酪蛋白胨;5:大豆蛋白胨;6:酵母蛋白胨 1: Marker; 2: Fish peptone; 3: Beef peptone; 4: Casein peptone; 5: Soybean peptone; 6: Yeast peptone. |
|
|
大豆蛋白胨浓度对LegH产量有着明显的影响,结果见图 2。由图 2可见,随着大豆蛋白胨浓度的提高,LegH产量也逐步上升,当浓度达到4%以后对LegH产量的影响不大。而且由电泳条带可见,大豆蛋白胨浓度越高,电泳图中未成团的蛋白条带也随之增多,这对后期使用Bradford法测定蛋白浓度和蛋白的提取都会产生一定的影响。
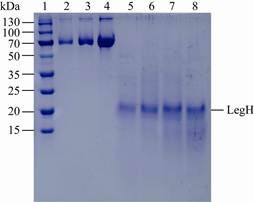
|
| 图 2 大豆蛋白胨浓度对大豆血红蛋白表达的影响 Figure 2 Effects of soybean peptone concentration on leghemoglobin expression. 1:标准蛋白分子量;2:0.1 mg/mL牛血清蛋白;3:0.2 mg/mL牛血清蛋白;4:0.4 mg/mL牛血清蛋白;5:2%大豆蛋白胨;6:4%大豆蛋白胨;7:6%大豆蛋白胨;8:8%大豆蛋白胨 1: Marker; 2: 0.1 mg/mL BSA; 3: 0.2 mg/mL BSA; 4: 0.4 mg/mL BSA; 5: 2% soybean peptone; 6: 4% soybean peptone; 7: 6% soybean peptone; 8: 8% soybean peptone. |
|
|
豆血红蛋白由一个血红素辅基和一条肽链组成,血红素是豆血红蛋白表达必需的重要辅因子,血红素掺入不足被认为是重组生产活性血红蛋白的主要障碍因素[20]。因LegH中含有铁卟啉,其合成过程中对铁元素的需求比较高,添加铁元素可能也有助于内源血红素的合成。实验中选取了血红素和3种常见铁元素载体,在诱导期添加到毕赤酵母发酵过程中,考察其对LegH表达的影响,结果见图 3。图 3表明不同的铁载体都可以提高LegH的产量,其中血红素对毕赤酵母产LegH有明显的提高作用,其次为柠檬酸铁。
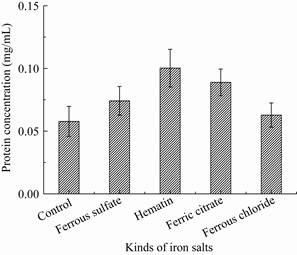
|
| 图 3 铁盐种类对豆血红蛋白表达的影响 Figure 3 Effects of iron salts on leghemoglobin expression. |
|
|
血红素作为LegH的合成前体,在合成过程中至关重要,考察了不同浓度血红素对毕赤酵母产LegH的影响,结果见图 4。由图 4可见,LegH的分泌表达量随着血红素浓度的增加而提高,说明毕赤酵母重组菌合成LegH过程中血红素的潜在短缺,通过在培养基中添加血红素能有效解决这一问题。当血红素添加浓度为5 μmol/L时LegH表达量最高,继续增加血红素浓度,LegH产量有一定程度的降低,说明较高浓度的血红素可能有一定的抑制作用。除了在培养基中添加外源血红素,已有研究者在血红蛋白表达菌株中同时导入血红素合成途径,取得了较好的效果[21-22]。
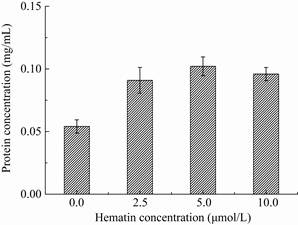
|
| 图 4 血红素浓度对豆血红蛋白表达的影响 Figure 4 Effect of hematin concentration on leghemoglobin expression. |
|
|
Pichia pastoris GS115属于甲醇营养型酵母表达系统,其AOX1为甲醇强启动子,可以利用甲醇作为外源蛋白表达的诱导物及自身生长所需的能源物质,在摇瓶发酵中适宜浓度范围的甲醇可以有效提高目标蛋白的表达产量,一般添加量为0.5%−1.0%。由图 5可以看出,在甲醇添加量为1.5%时毕赤酵母血红蛋白产量最高,当甲醇浓度继续提高时其蛋白产量明显减少,表明甲醇浓度过高则对菌体有一定毒性。有研究表明,甲醇浓度大于3.65%时即可观察到对菌体的抑制作用[23]。在实验中,严格控制甲醇浓度是毕赤酵母发酵的一个重要特征。另外,甲醇诱导的方式、用量和诱导时间均会对外源蛋白的表达水平产生影响。
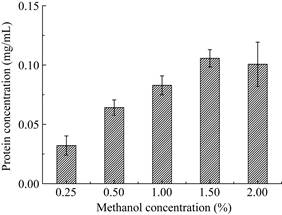
|
| 图 5 甲醇浓度对产豆血红蛋白的影响 Figure 5 Effects of methanol concentration on leghemoglobin expression. |
|
|
借助Minitab 19软件对筛选因素进行设计并对结果进行了统计分析,结果见表 1和表 2。
| No. | Peptone (X1, g/L) | Yeast extract (X2, g/L) |
Carbon source (X3, g/L) | Medium volume (X4, mL) | Biotin (X5, ×10−7 g/L) |
Methanol (X6, %) |
YNB (X7, g/L) |
pH (X8) |
Hematin (X9, μmol/L) |
LegH concentration (mg/mL) |
| 1 | 60 | 30 | 10 | 60 | 8 | 0.5 | 15 | 5.0 | 2.5 | 0.145 0 |
| 2 | 20 | 30 | 30 | 60 | 4 | 2.5 | 30 | 5.0 | 7.5 | 0.059 9 |
| 3 | 60 | 30 | 30 | 30 | 8 | 2.5 | 15 | 8.0 | 2.5 | 0.168 0 |
| 4 | 20 | 10 | 30 | 60 | 8 | 0.5 | 30 | 8.0 | 2.5 | 0.110 0 |
| 5 | 60 | 10 | 30 | 30 | 4 | 0.5 | 30 | 8.0 | 7.5 | 0.152 7 |
| 6 | 20 | 10 | 10 | 60 | 8 | 2.5 | 30 | 8.0 | 7.5 | 0.089 1 |
| 7 | 60 | 30 | 10 | 60 | 4 | 0.5 | 15 | 8.0 | 7.5 | 0.153 6 |
| 8 | 20 | 10 | 10 | 30 | 4 | 0.5 | 15 | 5.0 | 2.5 | 0.088 5 |
| 9 | 60 | 10 | 10 | 30 | 8 | 2.5 | 15 | 5.0 | 7.5 | 0.144 2 |
| 10 | 20 | 30 | 30 | 30 | 8 | 0.5 | 15 | 5.0 | 7.5 | 0.104 2 |
| 11 | 60 | 10 | 30 | 60 | 4 | 2.5 | 30 | 5.0 | 2.5 | 0.115 1 |
| 12 | 20 | 30 | 10 | 30 | 4 | 2.5 | 30 | 8.0 | 2.5 | 0.114 7 |
| Factors | Stdized effects | P value Prob > F |
Ranking |
| X1 | 0.052 03 | 0.008 | 1 |
| X2 | 0.007 63 | 0.237 | 6 |
| X3 | −0.004 19 | 0.456 | 8 |
| X4 | −0.016 63 | 0.068 | 3 |
| X5 | 0.012 67 | 0.109 | 4 |
| X6 | −0.010 50 | 0.149 | 7 |
| X7 | −0.001 35 | 0.795 | 9 |
| X8 | 0.021 89 | 0.041 | 2 |
| X9 | −0.006 28 | 0.303 | 5 |
该模型(model项)的F值为20.45,P值为0.047,并且当“Prob > F ”的值小于0.050时,表明对应的因素为显著影响因子。表示模型的拟合显著性好,具有统计学意义;各因素对产LegH影响方程如下:
产量=0.035 6+0.001 301X1 (g/L)+0.000 381X2 (g/L)−0.000 209X3 (g/L)−0.000 554X4 (mL)+ 0.003 17X5 (mg/L)−0.005 25X6 (%)+0.000 090X7 (g/L)+0.007 30X8−0.001 256X9 (μmol/L)(R2=0.989 3,调整后R2=0.940 9表明拟合性良好)。由此可以确定对LegH产量影响较大的3个因素分别是:蛋白胨(X1)、发酵液装量(X4)和pH (X7)。从该试验结果中Stdized effects的值可以确定接下来3个因素变化方向。对该3个元素变化范围筛选后进行响应面分析。
2.2.2 响应面优化分析根据2.2.1的结果,用Box-Behnken软件设计3因素3水平试验,使用Design-Expert软件进行方差分析和二次回归拟合实验数据,结果见表 3和表 4。
| No. | Peptone (A, g/L) |
Medium volume (B, mL) | pH (C) |
LegH concentration (mg/mL) |
| 1 | 52 | 33 | 5.3 | 0.169 7 |
| 2 | 52 | 33 | 5.9 | 0.166 8 |
| 3 | 48 | 33 | 5.6 | 0.169 8 |
| 4 | 52 | 36 | 5.6 | 0.183 0 |
| 5 | 52 | 36 | 5.6 | 0.180 1 |
| 6 | 56 | 36 | 5.3 | 0.169 7 |
| 7 | 56 | 39 | 5.6 | 0.161 6 |
| 8 | 56 | 36 | 5.9 | 0.163 1 |
| 9 | 52 | 39 | 5.9 | 0.172 1 |
| 10 | 48 | 36 | 5.3 | 0.162 3 |
| 11 | 52 | 36 | 5.6 | 0.180 9 |
| 12 | 52 | 36 | 5.6 | 0.180 8 |
| 13 | 48 | 36 | 5.9 | 0.178 1 |
| 14 | 52 | 39 | 5.3 | 0.161 8 |
| 15 | 56 | 32 | 5.6 | 0.173 7 |
| 16 | 48 | 39 | 5.6 | 0.170 7 |
| 17 | 52 | 36 | 5.6 | 0.180 0 |
| Parameters | Sum of squares | df | Mean square | F value | P value Prob > F | Significance |
| Model | 0.000 862 | 9 | 0.000 957 | 40.94 | 0.000 1 | ** |
| A | 0.000 020 | 1 | 0.000 020 | 8.670 | 0.021 6 | − |
| B | 0.000 023 | 1 | 0.000 023 | 10.12 | 0.015 5 | − |
| C | 0.000 033 | 1 | 0.000 033 | 14.45 | 0.006 7 | − |
| AB | 0.000 042 | 1 | 0.000 042 | 17.97 | 0.003 8 | * |
| AC | 0.000 127 | 1 | 0.000 127 | 54.25 | 0.000 2 | ** |
| BC | 0.000 040 | 1 | 0.000 040 | 18.82 | 0.003 4 | * |
| A2 | 0.000 135 | 1 | 0.000 135 | 57.87 | 0.000 1 | ** |
| B2 | 0.000 169 | 1 | 0.000 169 | 72.38 | 0.000 1 | ** |
| C2 | 0.000 207 | 1 | 0.000 207 | 88.51 | 0.000 1 | ** |
| Residual | 0.000 017 | 7 | 0.000 016 | |||
| Lack of fit | 0.000 011 | 3 | 0.000 010 | 2.44 | 0.204 5 | − |
| Pure error | 0.000 006 | 4 | 0.000 001 | |||
| Cor total | 0.006 200 | 16 | ||||
| Note: **: P < 0.01; *: P < 0.05; −: P > 0.05. | ||||||
以LegH浓度为响应面值,以蛋白胨浓度(A)、发酵液装量(B)、pH (C)为自变量,拟合得到多元二次回归方程:
Protein=0.18−0.001 592A−0.001 72B+0.002 055C− 0.003 241AB−0.005 632AC+0.003 317BC−0.005 67A2− 0.006 341B2−0.007 012C2。
由回归方程系数显著性检验及方差分析可知,模型拟合良好,P=0.000 1 < 0.05,说明该模型设计合理。决定系数R2=0.981 4,说明回归方程的拟合程度较好。
响应面优化分析和回归方程拟合绘制响应面结果如图 6所示,蛋白胨含量(A)、发酵液装量(B)、pH (C)这3个影响因素之间存在极值点。通过对生物量回归方程求导得出3个因子的最优试验点为:蛋白胨51.48 g/L,发酵液装量35.84 mL/250 mL,pH 5.66,LegH的理论预测值为0.183 mg/mL。
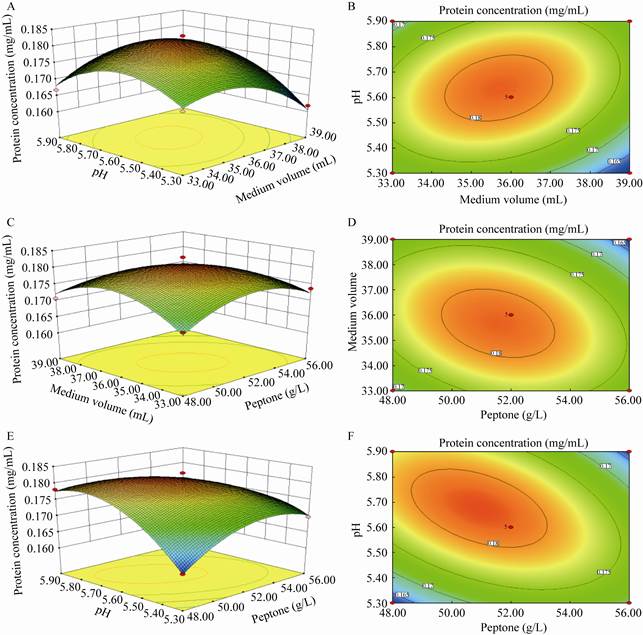
|
| 图 6 各因素对豆血红蛋白产量交互影响的三维曲线图及等高线图 Figure 6 Response surface plot and contour plot of mutual-influence for different factors on the yield of leghemoglobin. A:pH与培养基体积交互影响的响应面图;B:pH与培养基体积交互影响的等高线图;C:培养基体积与蛋白胨交互影响的响应面图;D:培养基体积与蛋白胨交互影响的等高线图;E:pH与蛋白胨交互影响的响应面图;F:pH与蛋白胨交互影响的等高线图 A: Response surface plot of mutual-influence for pH and medium volume; B: Contour plot of mutual-influence for pH and medium volume; C: Response surface plot of mutual-influence for medium volume and peptone; D: Contour plot of mutual-influence for medium volume and peptone; E: Response surface plot of mutual-influence for pH and peptone; F: Contour plot of mutual-influence for pH and peptone. |
|
|
为了证实模型预测结果的可靠性,在模型预测的最优条件,即蛋白胨51.48 g/L、发酵液装量35.84 mL/250 mL、pH 5.66和其他培养基成分和发酵条件不变时进行重复摇瓶实验,设立3组平行,结果如图 7所示。实际通过Bradford法检测到的蛋白浓度的平均值为0.191 mg/mL,与预测值0.183 mg/mL比较接近(为预测值的104.2%),二者的良好拟合性也再次证实了模型的有效性。并且优化后的表达水平为优化前的189%,获得了理想的优化效果。
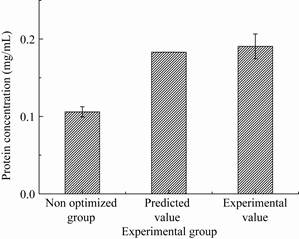
|
| 图 7 响应面结果验证 Figure 7 Response surface result verification. |
|
|
以Invitrogen公司的毕赤酵母高密度发酵方案为基础,结合响应面优化的结果,使用BMGY培养基、蛋白胨51.48 g/L、pH 5.66和其他培养基成分不变的情况下,考察构建菌株在5 L发酵罐上的发酵性能,结果见图 8。
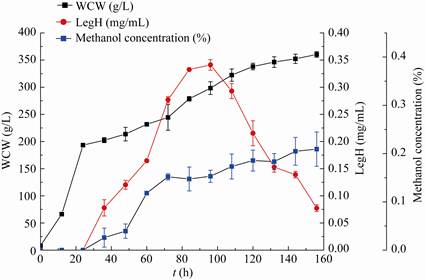
|
| 图 8 5 L发酵罐发酵结果 Figure 8 Fermentation results of 5 L tank. |
|
|
由图 8可见,毕赤酵母在发酵156 h后菌体湿重达到了356 g/L,发酵过程中LegH产量最高达到了0.384 mg/mL,约为摇瓶发酵的2倍。目前本研究仅对发酵罐的发酵工艺进行了初步研究,后续通过培养基成分的改进和补料工艺的控制等,有望进一步提高血红蛋白的表达水平。
3 结论首先对毕赤酵母工程菌株GS115-LegH发酵表达LegH的条件进行了单因素试验,然后通过Plackett-Burman试验设计进行因子筛选试验,确定了对产LegH影响最大的3个因子,即蛋白胨、pH和发酵液装量。通过最陡爬坡法确定3个因子的变化范围,然后根据Box-Behnken的中心组合试验设计原理进行3因素3水平的响应面分析,得到了拟合度较好的回归模型。通过回归模型进行因素间交互作用的分析并预测最佳优化条件为:蛋白胨浓度51.48 g/L,pH 5.66,培养基装液量35.84 mL/250 mL。最后在优化后的条件下进行发酵试验,产量为0.191 mg/mL,为预测值的104%,再次说明回归模型的可靠性。优化后的产量是优化前的1.89倍,获得了理想的优化结果。在此工作基础上通过5 L发酵罐试验,采取补料措施进行高密度发酵,LegH最高产量达到0.384 mg/mL,表明该菌株有一定的扩大生产潜力。
| [1] |
Jin Y, He XY, Andoh-Kumi K, Fraser RZ, Lu M, Goodman RE. Evaluating potential risks of food allergy and toxicity of soy leghemoglobin expressed in Pichia pastoris[J]. Molecular Nutrition & Food Research, 2018, 62(1): 1700297. |
| [2] |
Hargrove MS, Barry JK, Brucker EA, Berry MB, Phillips GN Jr, Olson JS, Arredondo-Peter R, Dean JM, Klucas RV, Sarath G. Characterization of recombinant soybean leghemoglobin A and apolar distal histidine mutants[J]. Journal of Molecular Biology, 1997, 266(5): 1032-1042. DOI:10.1006/jmbi.1996.0833 |
| [3] |
Carpenter CE, Mahoney AW. Contributions of heme and nonheme iron to human nutrition[J]. Critical Reviews in Food Science and Nutrition, 1992, 31(4): 333-367. DOI:10.1080/10408399209527576 |
| [4] |
Li HB, Zhang GQ, Zhou JW. Applications of synthetic biology in food industry[J]. Biotechnology & Business, 2019(4): 5-10. (in Chinese) 李宏彪, 张国强, 周景文. 合成生物学在食品领域的应用[J]. 生物产业技术, 2019(4): 5-10. |
| [5] |
Zhao YL, Wei YH. Progress in the study of leghemoglobin[J]. Acta Botanica Boreali-Occidentalia Sinica, 2000, 20(4): 684-689. (in Chinese) 赵亚兰, 尉亚辉. 豆血红蛋白的研究进展[J]. 西北植物学报, 2000, 20(4): 684-689. DOI:10.3321/j.issn:1000-4025.2000.04.031 |
| [6] |
Cos O, Ramón R, Montesinos JL, Valero F. Operational strategies, monitoring and control of heterologous protein production in the methylotrophic yeast Pichia pastoris under different promoters: a review[J]. Microbial Cell Factories, 2006, 5: 17. DOI:10.1186/1475-2859-5-17 |
| [7] |
Kay T. Overview of bacterial expression systems for heterologous protein production: from molecular and biochemical fundamentals to commercial systems[J]. Applied Microbiology and Biotechnology, 2006, 72(2): 211-222. DOI:10.1007/s00253-006-0465-8 |
| [8] |
Ahmad M, Hirz M, Pichler H, Schwab H. Protein expression in Pichia pastoris: recent achievements and perspectives for heterologous protein production[J]. Applied Microbiology and Biotechnology, 2014, 98(12): 5301-5317. DOI:10.1007/s00253-014-5732-5 |
| [9] |
Gupta R, Gupta N, Rathi P. Bacterial lipases: an overview of production, purification and biochemical properties[J]. Applied Microbiology and Biotechnology, 2004, 64(6): 763-781. DOI:10.1007/s00253-004-1568-8 |
| [10] |
Yu ZT, Liao YB, Ye YR. Expression and purification of human paraoxonase 1 in Pichia pastoris[J]. Modern Food Science and Technology, 2017, 33(7): 85-89, 8. (in Chinese) 于子桐, 廖一波, 叶燕锐. 人对氧磷酶1在巴斯德毕赤酵母中的表达与纯化[J]. 现代食品科技, 2017, 33(7): 85-89, 8. |
| [11] |
Reyes TF, Chen YM, Fraser RZ, Chan T, Li X. Assessment of the potential allergenicity and toxicity of Pichia proteins in a novel leghemoglobin preparation[J]. Regulatory Toxicology and Pharmacology, 2021, 119: 104817. DOI:10.1016/j.yrtph.2020.104817 |
| [12] |
Fraser RZ, Shitut M, Agrawal P, Mendes O, Klapholz S. Safety evaluation of soy leghemoglobin protein preparation derived from Pichia pastoris, intended for use as a flavor catalyst in plant-based meat[J]. International Journal of Toxicology, 2018, 37(3): 241-262. DOI:10.1177/1091581818766318 |
| [13] |
Zhao XR, Zhou JW, Du GC, Chen J. Recent advances in the microbial synthesis of hemoglobin[J]. Trends in Biotechnology, 2021, 39(3): 286-297. DOI:10.1016/j.tibtech.2020.08.004 |
| [14] |
Wu J, Zhang XX, Yu HS, Li W, Jia YP, Guo JY, Zhang LJ, Song XB. Research progress of high density fermentation process of Pichia pastoris[J]. China Biotechnology, 2016, 36(1): 108-114. (in Chinese) 武婕, 张晓雪, 余河水, 李薇, 贾宇平, 郭江玉, 张丽娟, 宋新波. 毕赤酵母工程菌高密度发酵研究与进展[J]. 中国生物工程杂志, 2016, 36(1): 108-114. |
| [15] |
Li PZ, Anumanthan A, Gao XG, Ilangovan K, Suzara VV, Düzgüneş N, Renugopalakrishnan V. Expression of recombinant proteins in Pichia pastoris[J]. Applied Biochemistry and Biotechnology, 2007, 142(2): 105-124. DOI:10.1007/s12010-007-0003-x |
| [16] |
Batra J, Beri D, Mishra S. Response surface methodology based optimization of β-glucosidase production from Pichia pastoris[J]. Applied Biochemistry and Biotechnology, 2014, 172(1): 380-393. DOI:10.1007/s12010-013-0519-1 |
| [17] |
Su Y. Study on efficient expression of heterologous leghemoglobin in microorganisms[D]. Hangzhou: Master's Thesis of Zhejiang University, 2020 (in Chinese) 苏悦. 微生物高效表达异源豆血红蛋白的研究[D]. 杭州: 浙江大学硕士学位论文, 2020 |
| [18] |
Yu B, Dai XF, Zhang S, Chen YG. Determination of methanol during fermentation of Pichia pastoris by chromotropic acid spectrophotography[J]. Journal of Shanghai University (Natural Science Edition), 2006, 12(2): 196-199. (in Chinese) 余波, 戴小峰, 张社, 陈宇光. 变色酸分光光度法测定毕赤酵母发酵液中的甲醇含量[J]. 上海大学学报(自然科学版), 2006, 12(2): 196-199. |
| [19] |
Quan HY, Wang P, Wei ZP, Du CY, Shen ZP, Zhang JL, Qiao LK. Optimization of fermentation conditions and enzymatic characteristics of the cholesterol esterase from Pichia pastoris[J]. Science and Technology of Food Industry, 2021, 42(17): 94-99. (in Chinese) 权浩严, 王鹏, 位正鹏, 杜春影, 沈照鹏, 张京良, 乔乐克. 产胆固醇酯酶毕赤酵母发酵条件优化及酶学性质研究[J]. 食品工业科技, 2021, 42(17): 94-99. |
| [20] |
Krainer FW, Capone S, Jäger M, Vogl T, Gerstmann M, Glieder A, Herwig C, Spadiut O. Optimizing cofactor availability for the production of recombinant heme peroxidase in Pichia pastoris[J]. Microbial Cell Factories, 2015, 14: 4. DOI:10.1186/s12934-014-0187-z |
| [21] |
Zhang BH, Zhao XR, Wang ZW, Wang HZ, Zhou JW, Du GC, Chen J, Li JH. Efficient secretory expression and purification of food-grade porcine myoglobin in Komagataella phaffii[J]. Journal of Agricultural and Food Chemistry, 2021, 69(35): 10235-10245. DOI:10.1021/acs.jafc.1c04124 |
| [22] |
Ishchuk OP, Frost AT, Muñiz-Paredes F, Matsumoto S, Laforge N, Eriksson NL, Martínez JL, Petranovic D. Improved production of human hemoglobin in yeast by engineering hemoglobin degradation[J]. Metabolic Engineering, 2021, 66: 259-267. DOI:10.1016/j.ymben.2021.05.002 |
| [23] |
Yan J, Jia LQ, Ding J, Shi ZP. Enhancing pIFN-α production by Pichia pastoris via periodic methanol induction control[J]. China Biotechnology, 2019, 39(6): 32-40. (in Chinese) 严建, 贾禄强, 丁健, 史仲平. 甲醇周期诱导控制强化毕赤酵母生产猪α干扰素[J]. 中国生物工程杂志, 2019, 39(6): 32-40. |