扩展功能
文章信息
- 于晓依, 李泰悦, 朱雪锐, 文嫄媛, 朱美珍, 蔡维维, 邱丽颖
- YU Xiaoyi, LI Taiyue, ZHU Xuerui, WEN Yuanyuan, ZHU Meizhen, CAI Weiwei, QIU Liying
- 限制活动加剧2型糖尿病小鼠肠道菌群和糖脂代谢紊乱
- Activity restriction exacerbates the disorder of intestinal microflora and glucolipid metabolism in type 2 diabetes mice
- 微生物学通报, 2022, 49(12): 5242-5255
- Microbiology China, 2022, 49(12): 5242-5255
- DOI: 10.13344/j.microbiol.china.220605
-
文章历史
- 收稿日期: 2022-06-27
- 接受日期: 2022-08-10
- 网络首发日期: 2022-10-06
2. 江南大学生命科学与健康工程学院, 江苏 无锡 214122
2. School of Life Sciences and Health Engineering, Jiangnan University, Wuxi 214122, Jiangsu, China
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种代谢综合征,其特征是胰岛素分泌绝对或相对缺乏,靶器官对胰岛素的敏感性降低,进而导致脂肪、蛋白质、水和电解质代谢紊乱[1]。国际糖尿病联盟最新发布的全球糖尿病地图(第10版)显示,全球糖尿病患病人数不断上升,目前有5.37亿糖尿病患者,相当于每10个人中就有1人患有糖尿病,按照此增长趋势,到2045年全球将有7.83亿糖尿病患者;2021年糖尿病导致670万人死亡,即每5秒钟就有1人死亡[2]。
久坐行为是指任何在清醒状态下以坐姿或斜躺姿势进行的能量消耗≤1.5代谢当量的行为[3]。进入21世纪以来,人们的生活方式发生了很大的改变,尤其是电子产品的出现和普及,致使人们久坐的时间越来越长。久坐行为与2型糖尿病、肥胖和高血压均有着密切的关系[4]。大量国内外学者的研究指出,久坐行为在2型糖尿病患者及高危人群中普遍存在[3]。Figueriró等的调查结果显示,2型糖尿病患者和高危人群平均花费清醒状态时间的70%进行久坐行为[5]。久坐行为糖尿病大鼠的体重、食物摄入量及葡萄糖、胰岛素水平高于运动糖尿病大鼠[6]。
人类和动物的肠道中包含500−1 000个物种和1014个细菌,是一个复杂而动态的生态系统,被称为肠道菌群[7]。国内外现有研究证明肠道菌群与2型糖尿病密切相关。Larsen等首次证实糖尿病患者与正常人肠道菌群存在显著差异[8]。2型糖尿病患者肠道中拟杆菌门减少、厚壁菌门增加,有益菌和有害菌比例失调。同时,肠道菌群失调可在全身引起慢性低度炎症反应,从而产生胰岛素抵抗等多种病理状态,加速2型糖尿病的发生与发展。
肠道菌群可以产生多种代谢产物,其中一些是机体生理代谢所必需的,包括短链脂肪酸、胆汁酸、脂多糖、三甲胺氧化物和硫化氢等[7]。胆汁酸与肠道菌群相互作用调节肝脏代谢,介导2型糖尿病的发生发展。法尼醇X受体(farnesoid X receptor,FXR)和G蛋白偶联胆汁酸受体5 (G protein coupled bile acid receptor 5,TGR5)在人和动物的肝脏、肠道和胰腺等组织中大量表达,是重要的胆汁酸合成调节剂[9]。大量研究表明,这些胆汁酸受体参与调节T2DM患者糖异生、外周胰岛素敏感性、糖原合成、胰高血糖素样肽-1和胰岛素的分泌,对于T2DM的发生发展至关重要[10]。
美国糖尿病学会(American Diabetes Association,ADA)最新的诊疗指南指出,所有成年人,尤其是2型糖尿病患者都应该减少每天久坐行为所花费的时间[11]。但是目前久坐行为对2型糖尿病产生不良影响的具体机制还缺乏较为完善的阐述。本项目旨在通过限制小鼠活动模拟久坐行为,探究其对2型糖尿病糖脂代谢紊乱的影响和具体机制,为医护人员进行相应的健康宣教和干预提供一定的理论基础。
1 材料与方法 1.1 实验动物所有动物研究均按照伦理准则进行,并经江南大学动物福利委员会批准。动物实验按照美国国立卫生研究院实验室动物护理和使用指南进行。6−8周龄雄性C57BL/6J小鼠购自南京大学模型动物研究中心。本研究中使用的所有小鼠都被置于控制温度和湿度的环境中,光照/黑暗周期为12 h,可以自由获得饮用水和食物。
小鼠分为正常组(CON)、2型糖尿病模型组(MOD)和2型糖尿病久坐组(SED)。适应性饲养1周后将小鼠分为2组:正常组(n=10)小鼠给予正常饮食;其余小鼠(n=20)给予高脂饮食。饮食干预4周后,将小鼠禁食12 h (过夜),高脂饮食的小鼠一次性注射链脲佐菌素(streptozotocin,STZ) (120 mg/kg;10 mmol/L柠檬酸缓冲液,pH 4.0溶解)构建T2DM小鼠模型,正常组小鼠给予柠檬酸缓冲液[12]。小鼠空腹血糖 > 11.1 mmol/L则造模成功。排除造模失败和死亡的小鼠后,将模型成功的T2DM小鼠随机分为模型组和久坐组,各组小鼠只数为6只。正常组和模型组每个标准笼内饲养6只小鼠,保持正常笼内活动。在久坐组饲养笼中放入隔板,使笼内面积减少至标准笼的1/3,小鼠数量与正常组和模型组相同,限制其体力活动,使小鼠保持较为安静的状态,从而模拟久坐行为,每天维持4 h,为期8周[13]。
1.2 主要试剂和仪器链脲佐菌素,Sigma公司;兔源Anti-FXR抗体和兔源Anti-TGR5抗体,武汉爱博泰克(ABclonal)生物科技有限公司;鼠源Anti-GAPDH抗体,Abcam公司;粪便基因组DNA提取试剂盒、蛋白酶抑制剂和磷酸酶抑制剂,康为世纪生物科技股份有限公司;特异性引物,生工生物工程(上海)股份有限公司;甘油三酯、总胆固醇、谷丙转氨酶、谷草转氨酶、游离脂肪酸、糖原和总胆汁酸试剂盒,南京建成生物工程研究所;BCA蛋白浓度测定试剂盒和特超敏ECL化学发光试剂盒,上海碧云天生物技术有限公司。
全功能微孔板检测仪,BioTek公司;电泳仪和全能型凝胶成像分析系统,Bio-Rad公司;尼康正置显微镜,尼康公司;全自动荧光定量PCR系统,Roche公司;细胞超声破碎仪,Sonics公司。
1.3 小鼠生化指标检测小鼠注射戊巴比妥钠麻醉,从眼眶静脉层取血,室温静置2 h后,于4 ℃、3 000 r/min离心10 min取上清[14]。按照各试剂盒说明书检测并计算小鼠血清生化指标。取适量小鼠肝脏组织加入裂解液。超声破碎(功率200 W,工作时间10 s,间歇5 s,重复3次),在冰上进行,4 ℃、12 000 r/min离心10 min取上清。然后按照说明书检测肝脏中总胆固醇、甘油三酯和糖原的含量。
1.4 小鼠回肠组织学分析小鼠回肠组织固定、脱水、石蜡包埋、切片。采用苏木素-伊红染色试剂盒和AB-PAS染色试剂盒进行染色,然后在光学显微镜下观察。
1.5 实时荧光定量PCR法检测小鼠肠道菌群含量采用粪便基因组DNA提取试剂盒从粪便样本中提取DNA,获得肠道菌群基因组DNA。对提取的DNA进行定量。在Roche lightcycle 480上进行实时荧光定量聚合酶链反应,采用25 μL的反应体系:2×UltraSYBR Mixture 12.5 μL,DNA模板50 ng,正、反向引物(10 μmol/L) 各0.5 μL,ddH2O补足至25 μL。PCR反应条件采用两步法:95 ℃ 10 min;95 ℃ 15 s;60 ℃ 1 min,共40个循环。然后经过95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s及60 ℃ 15 s进行熔解曲线分析。采用Total Bacteria进行相对定量,采用2−△△CT法计算肠道菌群相对基因表达量。所使用的引物见表 1。
| Target bacteria | Primer sequence (5ʹ→3ʹ) |
| Total Bacteria | F: AGAGTTTGATCCTGGCTCAG R: TGCTGCCTCCCGTAGGAGT |
| Firmicutes | F: GGAGYATGTGGTTTAATTCGAAGCA R: AGCTGACGACAACCATGCAC |
| Bacteroidetes | F: CCGGAWTYATTGGGTTTAAAGGG R: GGTAAGGTTCCTCGCGTA |
| Bacteroides | F: AAGGTCCCCCACATTGG R: GAGCCGCAAACTTTCACAA |
| Alistipes | F: TGAATCCTCCGTATTACCGCG R: TTAGAGATGGGCATGCGTTGT |
| Ruminococcus | F: CCTCTGACCGCTCTTTAATCGGAGC TTTCCTTC R: CCAGTTATCGGTCCCACCTTCGGCA GCT |
| Lactobacillus | F: AGCAGTAGGGAATCTTCCA R: CGCCACTGGTGTTCYTCCATATA |
用Trizol试剂提取回肠和肝脏组织总mRNA,1 μg总mRNA合成cDNA。采用Roche lightcycle 480进行实时荧光定量聚合酶链反应。以2−△△CT法计算基因相对表达量,GAPDH作为归一化参考。每个样本重复3次。所使用的引物见表 2。
| Target gene | Primer sequence (5ʹ→3ʹ) |
| GAPDH | F: GACAACTTTGGCATCGTGGA R: ATGCAGGGATGATGTTCTGG |
| FXR | F: CAGAAATGGCAACCAGTCATGTA R: AAATCTCCGCCGAACGAA |
| TGR5 | F: CTGTGTGAGATC-CGCCGACT R: CGCTCATAGGCCAAGACTGAC |
使用含有蛋白酶抑制剂和磷酸酶抑制剂混合的RIPA缓冲液提取总蛋白。采用BCA检测试剂盒检测蛋白浓度。提取的蛋白经聚丙烯酰胺凝胶电泳(PAGE)分析后转移到硝酸纤维素膜上。4 ℃一抗孵育过夜,TBST缓冲液洗3次(20 min/次),二抗孵育1 h。使用增强的化学发光检测试剂对信号进行可视化。免疫反应条带用ImageJ软件处理,并以GAPDH作为归一化参考。
2 结果与分析 2.1 限制活动可导致T2DM小鼠血糖水平升高成功构造STZ诱导的小鼠2型糖尿病模型,主要表现为多饮多尿、体重减轻等明显的临床症状。2型糖尿病模型组小鼠的最终体重显著低于正常组,限制活动组小鼠体重略高于2型糖尿病小鼠,但差异无统计学意义(图 1A、1B)。这一情况可能是因为限制活动模拟久坐行为时,小鼠的身体活动量较低,能量消耗少,从而使其体重略高。STZ诱导后,T2DM小鼠血糖水平显著高于正常组,8周后,限制活动组小鼠的血糖水平较2型糖尿病模型组显著升高(图 1C、1D)。口服葡萄糖耐量实验结果显示,2型糖尿病模型组小鼠在各个时间点的血糖水平均高于空白对照组,而限制活动组小鼠各个时间点的血糖水平高于模型组,而且其空腹血糖水平在口服葡萄糖120 min后无法回到最初水平(图 1E、1F)。胰岛素耐量结果显示,久坐组小鼠胰岛素抵抗较2型糖尿病模型组加剧(图 1G、1H)。
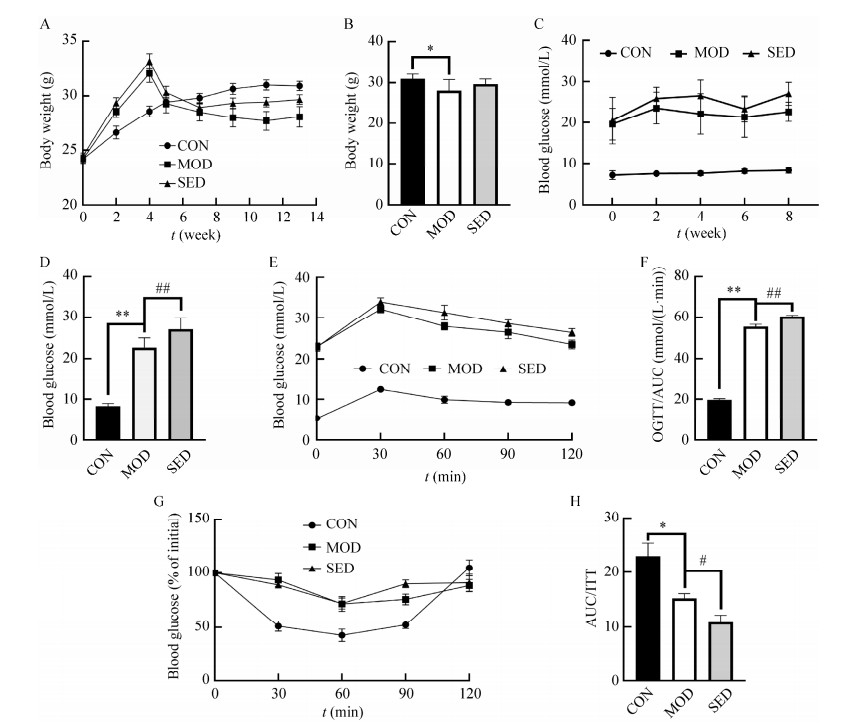
|
| 图 1 限制活动对小鼠体重、血糖等身体基础指标的影响 Figure 1 Effects of restricted activity on body weight, blood glucose and other basic indexes in mice. A:小鼠体重变化;B:小鼠最终体重;C:给药过程中小鼠每周血糖变化;D:小鼠最终血糖;E和F:口服葡萄糖耐量和曲线下面积;G和H:胰岛素抵抗和曲线下面积。n=6;*P < 0.05,**P < 0.01 vs CON group;#P < 0.05,##P < 0.01 vs MOD group A: Weight change of mice; B: Final body weight of mice; C: Weekly blood glucose changes in mice during drug administration; D: Final blood glucose of mice; E, F: Oral glucose tolerance and area under curve; G, H: Insulin resistance and area under the curve. n=6; *P < 0.05, **P < 0.01 vs CON group; #P < 0.05, ##P < 0.01 vs MOD group. |
|
|
相较于正常组,T2DM小鼠血清中游离脂肪酸(图 2A)、总胆固醇(图 2B)、甘油三酯(图 2C)、低密度脂蛋白(图 2D)的含量显著升高,限制小鼠活动8周后其含量比2型糖尿病模型组显著增加。正常组与模型组高密度脂蛋白含量无显著性差异,但是限制活动组明显增加(图 2E)。同时,限制活动组小鼠血清中谷草转氨酶和谷丙转氨酶的含量较2型糖尿病模型组也显著增加(图 2F、2G)。2型糖尿病模型组小鼠的肝脏指数(肝体比)显著高于空白对照组,限制活动组小鼠肝脏指数较模型组显著升高(图 2H)。同时,限制活动显著增加了T2DM小鼠肝脏中总胆固醇和甘油三酯的水平(图 2I、2J)。与空白对照组小鼠相比,T2DM小鼠肝脏糖原水平降低,限制活动组的小鼠糖原含量进一步减少,但差异无统计学意义(图 2K)。说明限制活动可导致T2DM小鼠糖脂代谢紊乱加剧。
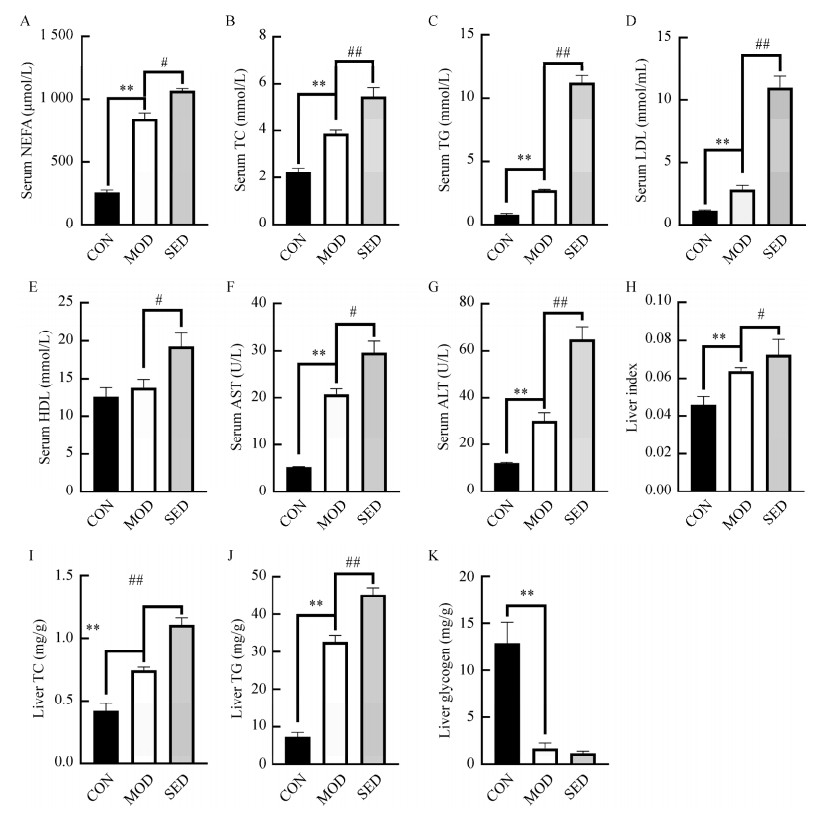
|
| 图 2 限制活动对小鼠糖脂代谢的影响 Figure 2 Effect of restriction activity on glycolipid metabolism in mice. A:血清游离脂肪酸;B:血清总胆固醇;C:血清甘油三酯;D:血清低密度脂蛋白;E:血清高密度脂蛋白;F:血清谷草转氨酶;G:血清谷丙转氨酶;H:肝脏指数;I:肝脏总胆固醇;J:肝脏甘油三酯;K:肝糖原。n=6;*P < 0.05,**P < 0.01 vs CON group;#P < 0.05,##P < 0.01 vs MOD group A: Nonestesterified fatty acid in serum; B: Total cholesterol in serum; C: Triglyceride in serum; D: Low density lipoprotein in serum; E: High density lipoprotein in serum; F: Aspartate aminotransferase in serum; G: Alanine aminotransferase in serum; H: Liver index; I: Total cholesterol in liver; J: Triglyceride in liver; K: Liver glycogen. n=6; *P < 0.05, **P < 0.01 vs CON group; #P < 0.05, ##P < 0.01 vs MOD group. |
|
|
HE染色观察小鼠回肠组织病理学变化(图 3A、3B),可见正常组小鼠回肠镜下结构完整,肠绒毛排列整齐,绒毛表面单层柱状上皮整齐有序,肠隐窝完整,无组织学异常;而2型糖尿病模型组小鼠回肠黏膜损伤,绒毛变短,肠隐窝变短、缩短或缺失,肠上皮增生变厚;限制活动组小鼠回肠病变进一步加剧。正常杯状细胞可分泌黏液,对肠上皮有润滑和保护作用。因回肠杯状细胞含有中性粘蛋白和酸性的唾液粘蛋白,AB-PAS染色可使其呈现蓝紫色。AB-PAS染色结果显示模型组杯状细胞数量较空白对照组显著降低,限制活动使小鼠回肠杯状细胞数量进一步减少(图 3C、3D)。同时,2型糖尿病模型组小鼠回肠炎症因子TNF-α和IL-1β的mRNA表达量明显升高,限制活动使其进一步上调(图 3E、3F)。
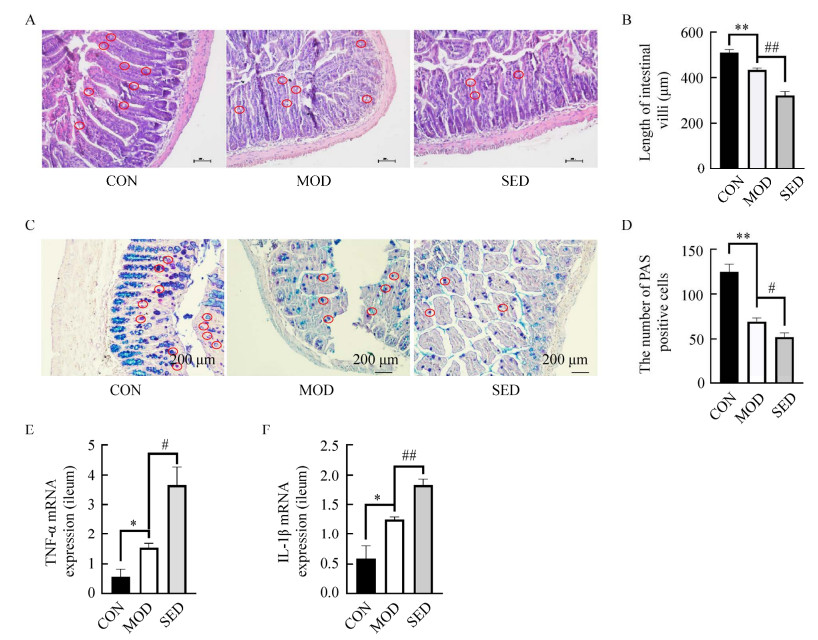
|
| 图 3 小鼠回肠组织病理学 Figure 3 Ileum histopathology in mice. A:HE染色(200×);B:HE染色观察回肠组织绒毛长度;C:AB-PAS染色(200×);D:AB-PAS染色观察杯状细胞数量;E:小鼠回肠TNF-α表达量;F:小鼠回肠IL-1β表达量。n=6;*P < 0.05,**P < 0.01 vs CON group;#P < 0.05,##P < 0.01 vs MOD group A: HE staining (200×); B: Villus length; C: AB-PAS staining (200×); D: Goblet cell number; E: TNF-α mRNA expression in ileum of mice; E: IL-1βmRNA expression in ileum of mice. n=6; *P < 0.05, **P < 0.01 vs CON group; #P < 0.05, ##P < 0.01 vs MOD group. |
|
|
在门水平上,T2DM小鼠拟杆菌门(Bacteroidota)减少(图 4A),厚壁菌门(Firmicutes)增加(图 4B),拟杆菌门与厚壁菌门的比值(B/F)减少,而限制活动组菌群B/F进一步减少(图 4C)。在属水平上,T2DM小鼠拟杆菌属(Bacteroides)和乳杆菌属(Lactobacillus)水平降低(图 4D、4E),另枝菌属(Alistipes)和瘤胃球菌属(Ruminococcus)增加(图 4F、4G),限制活动可使T2DM小鼠这些菌属的紊乱加剧。拟杆菌属是正常人体内的优势菌,参与人体许多重要的代谢活动,包括碳水化合物的代谢和胆汁酸的生物转化等。大部分研究认为,瘤胃球菌属与2型糖尿病、肥胖和非酒精性脂肪肝等代谢性疾病呈正相关。实验证明,T2DM小鼠肠道菌群紊乱,有益菌减少、有害菌增加,而限制活动致使小鼠肠道菌群的失调进一步加剧。
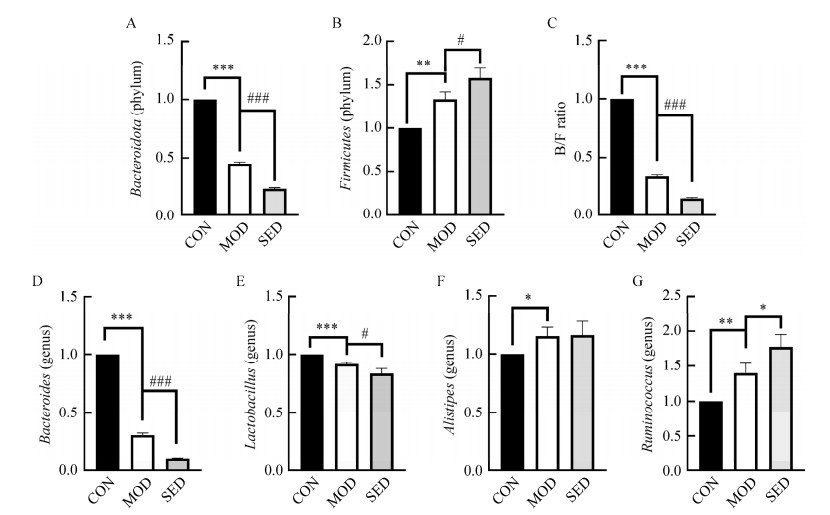
|
| 图 4 RT-qPCR测定小鼠肠道菌群的含量 Figure 4 The contents of intestinal microflora in mice were determined by RT-qPCR. A:拟杆菌门;B:厚壁菌门;C:拟杆菌门与厚壁菌门的比值;D:拟杆菌属;E:乳杆菌属;F:另枝菌属;G:瘤胃球菌属。n=6;*P < 0.05,**P < 0.01 vs CON group;#P < 0.05,##P < 0.01 vs MOD group A: Bacteroidota; B: Firmicutes; C: Ratio of Bacteroidota to Firmicutes; D: Bacteroides; E: Lactobacillus; F: Alistipes; G: Ruminococcus. n=6; *P < 0.05, **P < 0.01 vs CON group; #P < 0.05, ##P < 0.01 vs MOD group. |
|
|
高脂饮食可促进胆汁酸释放,而2型糖尿病患者可观察到胆汁酸水平较高[15]。与空白对照组相比,T2DM小鼠血清和肝脏组织中总胆汁酸含量都显著升高,而限制活动组小鼠血清和肝脏中总胆汁酸含量进一步增加(图 5A)。FXR和TGR5在小鼠回肠和肝脏组织中大量表达。与空白对照组相比,T2DM小鼠回肠和肝脏组织中胆汁酸受体FXR和TGR5的mRNA表达量均显著下调;与模型组相比,限制活动组小鼠FXR和TGR5的表达量进一步降低(图 5B、5C)。Western blotting检测蛋白表达结果进一步验证了小鼠回肠和肝脏中两受体表达量下降的实验结果(图 5D−5F)。
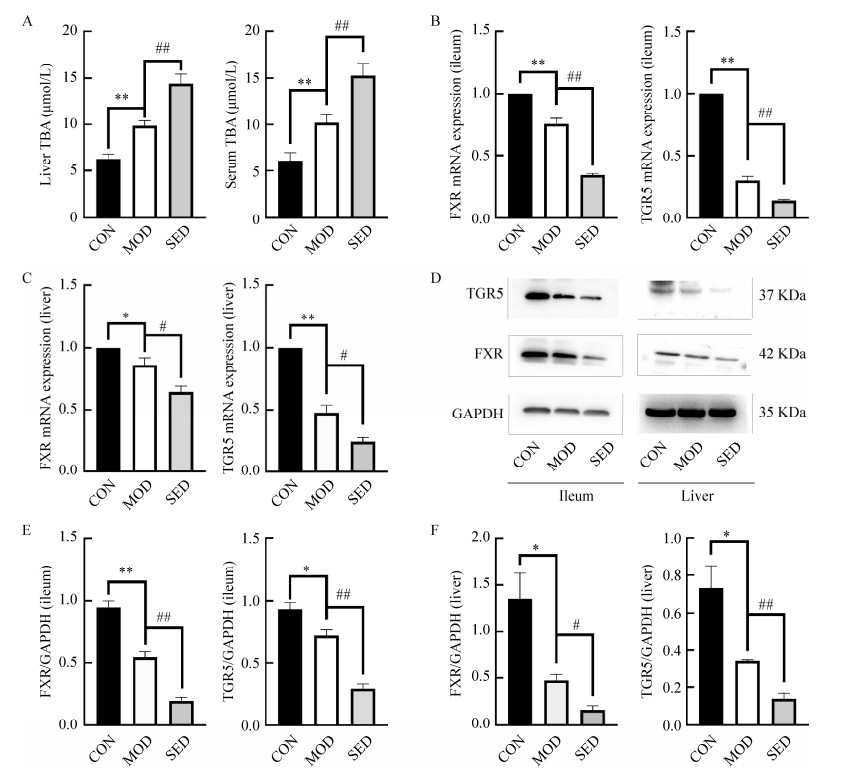
|
| 图 5 限制活动对小鼠胆汁酸含量及回肠和肝脏组织胆汁酸受体表达的影响 Figure 5 Effects of restriction on bile acid content and bile acid receptor expression in ileum and liver of mice. A:肝脏和血清总胆汁酸含量;B:回肠组织胆汁酸受体FXR和TGR5的mRNA表达;C:肝脏组织胆汁酸受体FXR和TGR5的mRNA表达;D:Western blotting测定回肠和肝脏组织FXR和TGR5蛋白;E:回肠FXR和TGR5蛋白表达量;F:肝脏FXR和TGR5蛋白表达量。n=6;*P < 0.05,**P < 0.01 vs CON group;#P < 0.05,##P < 0.01 vs MOD group A: Total bile acid content in liver and serum; B: mRNA expression of bile acid receptor FXR and TGR5 in ileum; C: mRNA expression of bile acid receptor FXR and TGR5 in liver; D: Western blotting determination of FXR and TGR5 proteins in ileum and liver; E: Protein expression levels of FXR and TGR5 in ileum; F: Protein expression levels of FXR and TGR5 in liver. n=6; *P < 0.05, **P < 0.01 vs CON group; #P < 0.05, ##P < 0.01 vs MOD group. |
|
|
为了进一步阐明小鼠肠道菌群及肠道菌群代谢物胆汁酸的变化与糖脂代谢的关系,计算了3个实验组之间的Spearman相关系数(图 6)。结果表明,门水平上,拟杆菌门与小鼠的体重、血糖、糖脂代谢等指标显著负相关,而厚壁菌门与这些指标成正相关;属水平上,拟杆菌属和乳杆菌属与小鼠生理指标呈负相关,而瘤胃球菌属和另枝菌属与小鼠生理指标呈正相关。同时,T2DM小鼠血清和肝脏中胆汁酸的增加与小鼠的代谢紊乱成正比。这提示我们肠道菌群及菌群代谢产物胆汁酸在小鼠的糖脂代谢中发挥了重要作用。
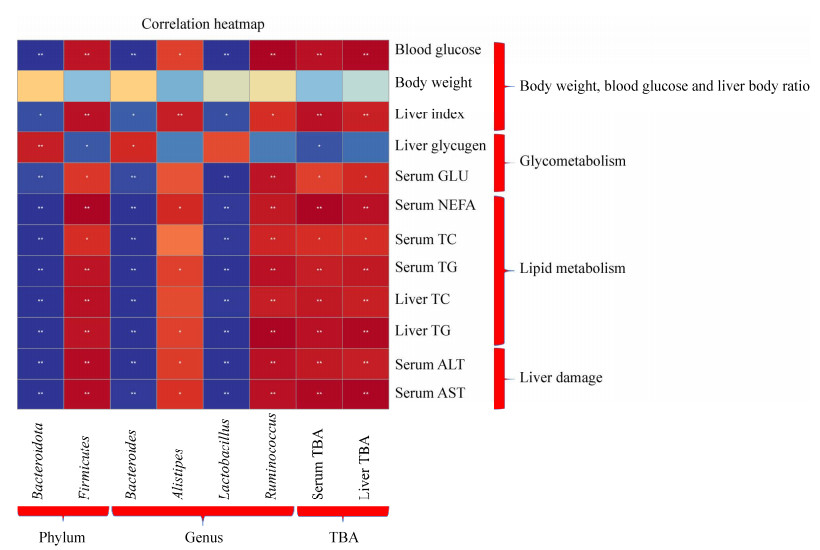
|
| 图 6 门、属水平上肠道菌群以及总胆汁酸含量与小鼠身体情况指标相关性热图 Figure 6 Heat map of correlation between intestinal flora and total bile acid content at phylum and genus level and body condition indexes of mice. 红色代表正相关;蓝色代表负相关;颜色越深,则相关性越强;n=6;*P < 0.05,**P < 0.01 Red is positive; Blue is negative; Darker the color, the stronger the correlation; n=6; *P < 0.05, **P < 0.01. |
|
|
2型糖尿病是一种以慢性血糖升高为主要临床表现的代谢性疾病,如果病人长期血糖控制不佳,容易引发多种并发症,影响生活质量,严重的甚至会导致死亡[16]。在2型糖尿病患者的日常生活中,久坐行为十分普遍。有研究表明,2型糖尿病患者维持久坐状态的时间至少占其清醒时间的50%[17],而2型糖尿病患者的糖脂代谢紊乱水平与久坐行为水平之间存在显著正相关,揭示了较高的久坐行为水平可能是患者血糖控制不佳的潜在预测因素[18]。本研究表明,限制小鼠体力活动使其模拟久坐行为显著升高了T2DM小鼠的血糖水平,导致小鼠糖脂代谢紊乱加剧。
“人类微生物组计划” (human microbiome project,HMP)揭示了肠道微生物可通过影响机体的免疫调节、神经途径和激素分泌等影响身体功能,与2型糖尿病的发生发展密切相关。现代药理学研究表明,多种药物可有效调节2型糖尿病的糖脂代谢紊乱,而其作用机制可能与改善2型糖尿病肠道菌群的组成和结构有关。拟杆菌门和厚壁菌门在健康成年人的肠道菌群中占主导地位[19]。Zhang等研究显示,与正常人群相比,T2DM患者的拟杆菌明显减少[20]。Xie等的研究发现,T2DM小鼠中拟杆菌属和乳杆菌属的含量明显减少[21]。本研究发现,T2DM小鼠回肠组织发生了明显的病理学变化,而且炎症因子TNF-α和IL-1β表达上调。同时,肠道菌群的结构发生显著变化,厚壁菌门和拟杆菌门的比值明显增加,乳杆菌属等有益菌减少,而另枝菌属和胃瘤球菌属等条件性致病菌增加。限制小鼠活动模拟久坐行为后T2DM小鼠回肠病变恶化,肠道菌群的结构和组成进一步紊乱。
胆汁酸由肝脏产生后进入肠道,在肠道微生物的作用下由初级胆汁酸产生次级胆汁酸,肠道菌群结构和组成的改变可影响胆汁酸的代谢[22]。近年来的研究发现,作为激活FXR和TGR5的信号分子,胆汁酸可影响肠道激素的合成与分泌,并参与葡萄糖代谢的调节[23-24],对于肥胖、非酒精性脂肪肝和2型糖尿病等代谢性疾病具有重要的生理影响。Yan等发现,T2DM小鼠肝脏和胆汁中的总胆汁酸含量与正常小鼠相比明显增加,肝脏FXR的表达受到抑制[25]。Makki等的研究表明,6α-羟基胆汁酸可通过调节TGR5信号改善高脂喂养小鼠的葡萄糖代谢[26]。本研究发现,限制活动组的小鼠产生了更高的总胆汁酸水平,而且小鼠回肠和肝脏组织中胆汁酸受体FXR和TGR5的表达降低。同时,小鼠肠道菌群和胆汁酸水平与2型糖尿病的糖脂代谢水平存在显著相关性。提示限制活动可能通过影响胆汁酸代谢下调FXR和TGR5的表达,从而使T2DM小鼠的糖脂代谢紊乱加剧。
本实验通过限制活动模拟久坐行为,能够使T2DM小鼠的血糖水平显著升高,导致T2DM小鼠糖脂代谢紊乱加剧。同时,限制活动导致T2DM小鼠肠道产生明显的病理变化,肠道菌群的结构和组成进一步失调,肠道代谢物胆汁酸的含量和胆汁酸受体FXR和TGR5的表达也受到影响。综上所述,较高的久坐行为水平会导致T2DM小鼠血糖控制不佳,而这可能与肠道菌群及菌群代谢物胆汁酸的进一步失调有关,其中的具体机制有待进一步探究和证实。在对2型糖尿病患者的诊疗过程中,医务人员应对患者强调久坐行为的危害,加强减少久坐行为的健康宣教,并积极给予相关的认知-行为干预。
致谢: 感谢江南大学无锡医学院公共实验平台的大力支持。| [1] |
Ma QT, Li YQ, Li PF, Wang M, Wang JK, Tang ZY, Wang T, Luo LL, Wang CG, Wang T, et al. Research progress in the relationship between type 2 diabetes mellitus and intestinal flora[J]. Biomedicine & Pharmacotherapy, 2019, 117(6): 109138. |
| [2] |
Teo ZL, Tham YC, Yu M, Chee ML, Rim TH, Cheung N, Bikbov MM, Wang YX, Tang YT, Lu Y, et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: systematic review and meta-analysis[J]. Ophthalmology, 2021, 128(11): 1580-1591. DOI:10.1016/j.ophtha.2021.04.027 |
| [3] |
Wang Y, Sun J, Deng N, Zhang XY, He H. Recent developments in sedentary behavior interventions for populations with or at high risk for type 2 diabetes[J]. Chinese General Practice, 2018, 21(34): 4283-4288. (in Chinese) 王娅, 孙娟, 邓楠, 张晓义, 何红. 久坐行为干预在2型糖尿病患者及其高危人群中的研究进展[J]. 中国全科医学, 2018, 21(34): 4283-4288. DOI:10.12114/j.issn.1007-9572.2018.34.0024 |
| [4] |
Guo CM, Zhou QG, Zhang DD, Qin P, Li QM, Tian G, Liu DC, Chen X, Liu LL, Liu FY, et al. Association of total sedentary behaviour and television viewing with risk of overweight/obesity, type 2 diabetes and hypertension: a dose-response meta-analysis[J]. Diabetes, obesity & metabolism, 2020, 22(1): 79-90. |
| [5] |
Figueriró TH, Arins GCB, Santos C, Cembranel F, Medeiros PA, D'Orsi E, Rech CR. Association of objectively measured sedentary behavior and physical activity with cardiometabolic risk markers in older adults[J]. PLoS One, 2019, 14(1): e0210861. DOI:10.1371/journal.pone.0210861 |
| [6] |
Bassi D, Bueno P, Nonaka KO, Selistre-Araujo HS, Leal AM. Exercise alters myostatin protein expression in sedentary and exercised streptozotocin-diabetic rats[J]. Archives of Endocrinology and Metabolism, 2015, 59(2): 148-153. DOI:10.1590/2359-3997000000028 |
| [7] |
Wei X, Liu W, Yuan J, Huang LY. Research progress on the relationship between human intestinal microbiota and host diseases[J]. Chinese Journal of Microecology, 2011, 23(1): 75-80. (in Chinese) 魏晓, 刘威, 袁静, 黄留玉. 人类肠道菌群与疾病关系的元基因组学研究进展[J]. 中国微生态学杂志, 2011, 23(1): 75-80. DOI:10.13381/j.cnki.cjm.2011.01.010 |
| [8] |
Larsen N, Vogensen FK, Van Den Berg FWJ, Nielsen DS, Andreasen AS, Pedersen BK, Al-Soud WA, Sørensen SJ, Hansen LH, Jakobsen M. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. PLoS One, 2010, 5(2): e9085. DOI:10.1371/journal.pone.0009085 |
| [9] |
Wang YL, Pang SG. Progress of the research on diabetes mellitus and bile acid metabolism[J]. China Medicine and Pharmacy, 2021, 11(23): 70-73. (in Chinese) 王育璐, 逄曙光. 糖尿病与胆汁酸代谢的研究进展[J]. 中国医药科学, 2021, 11(23): 70-73. DOI:10.3969/j.issn.2095-0616.2021.23.019 |
| [10] |
Wu YJ, Zhou A, Tang L, Lei YY, Tang B, Zhang LJ. Bile acids: key regulators and novel treatment targets for type 2 diabetes[J]. Journal of Diabetes Research, 2020, 2020: 6138438. |
| [11] |
Colberg SR, Sigal RJ, Yardley JE, Riddell MC, Dunstan DW, Dempsey PC, Horton ES, Castorino K, Tate DF. Physical activity/exercise and diabetes: a position statement of the American diabetes association[J]. Diabetes Care, 2016, 39(11): 2065-2079. DOI:10.2337/dc16-1728 |
| [12] |
Lei YY, Gong LL, Tan FG, Liu YX, Li SS, Shen HW, Zhu M, Cai WW, Xu F, Hou B, et al. Vaccarin ameliorates insulin resistance and steatosis by activating the AMPK signaling pathway[J]. European Journal of Pharmacology, 2019, 851: 13-24. DOI:10.1016/j.ejphar.2019.02.029 |
| [13] |
Batacan RB Jr, Duncan MJ, Dalbo VJ, Buitrago GL, Fenning AS. Effect of different intensities of physical activity on cardiometabolic markers and vascular and cardiac function in adult rats fed with a high-fat high-carbohydrate diet[J]. Journal of Sport and Health Science, 2018, 7(1): 109-119. DOI:10.1016/j.jshs.2016.08.001 |
| [14] |
Feng J, Niu PQ, Chen K, Wu LW, Liu T, Xu SZ, Li JJ, Li SN, Wang WW, Lu XY, et al. Salidroside mediates apoptosis and autophagy inhibition in concanavalin A-induced liver injury[J]. Experimental and Therapeutic Medicine, 2018, 15(6): 4599-4614. |
| [15] |
Zhou H, Luo SZ, Qian YQ, Lu LG. High bile acid-induced by high-fat diet impairs intestinal mucosa by down-regulating stem cell function[J]. Chinese Journal of Gastroenterology, 2016, 21(10): 610-614. (in Chinese) 周慧, 罗声政, 钱月琴, 陆伦根. 高脂饮食诱导高胆汁酸通过下调干细胞功能损伤肠黏膜[J]. 胃肠病学, 2016, 21(10): 610-614. DOI:10.3969/j.issn.1008-7125.2016.10.007 |
| [16] |
Chen J, Qian ZX, Zhu MY, Lin X, Ge YM. Hypoglycemic mechanism of Gegen Qinliantang: an exploration based on GPR119/cAMP/GLP-1 pathway[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(3): 25-30. (in Chinese) 陈俊, 钱紫星, 朱梦杨, 林晓, 葛亚梅. 基于GPR119/cAMP/GLP-1通路探讨葛根芩连汤的降糖机制[J]. 中国实验方剂学杂志, 2022, 28(3): 25-30. |
| [17] |
Pei L, Wang MF, Wang Y, Zhang Q. Status and influencing factors of physical activity in patients with diabetes mellitus[J]. Chinese Journal of Behavioral Medical Science, 2015(12): 1109-1112. (in Chinese) 裴丽, 王美凤, 王燕, 张清. 糖尿病患者体力活动状况及影响因素分析[J]. 中华行为医学与脑科学杂志, 2015(12): 1109-1112. DOI:10.3760/cma.j.issn.1674-6554.2015.12.014 |
| [18] |
Wang Y, He H, Zhang XY, Chen XY. Correlation between sedentary behavior and glucose and lipid metabolism in patients with type 2 diabetes mellitus[J]. Journal of Nantong University: Medical Sciences, 2021, 41(4): 352-357. (in Chinese) 王娅, 何红, 张晓义, 陈晓艳. 久坐行为与2型糖尿病患者糖脂代谢水平的相关性研究[J]. 南通大学学报(医学版), 2021, 41(4): 352-357. |
| [19] |
Ma HD, Wang YH, Chang C, Gershwin ME, Lian ZX. The intestinal microbiota and microenvironment in liver[J]. Autoimmunity Reviews, 2015, 14(3): 183-191. DOI:10.1016/j.autrev.2014.10.013 |
| [20] |
Zhang XY, Shen DQ, Fang ZW, Jie ZY, Qiu XM, Zhang CF, Chen YL, Ji LN. Human gut microbiota changes reveal the progression of glucose intolerance[J]. PLoS One, 2013, 8(8): e71108. DOI:10.1371/journal.pone.0071108 |
| [21] |
Xie XH, Liao JB, Ai YL, Gao JM, Zhao J, Qu F, Xu C, Zhang ZY, Wen WB, Cui HT, et al. Pi-Dan-Jian-Qing decoction ameliorates type 2 diabetes mellitus through regulating the gut microbiota and serum metabolism[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11: 748872. DOI:10.3389/fcimb.2021.748872 |
| [22] |
Zeng ZH, Liu RR, Tang L, Li WF. Interaction between gut microbiota and bile acid metabolism[J]. Chinese Journal of Microecology, 2021, 33(7): 849-856. (in Chinese) 曾忠花, 刘容容, 汤俐, 李卫芬. 肠道菌群与胆汁酸代谢的互相作用[J]. 中国微生态学杂志, 2021, 33(7): 849-856. |
| [23] |
Jia MJ, Feng B. Research progress on relationship between bile acid metabolism and type 2 diabetes mellitus[J]. Journal of Tongji University: Medical Science, 2019, 40(5): 644-649. (in Chinese) 贾敏杰, 冯波. 胆汁酸代谢与2型糖尿病的研究进展[J]. 同济大学学报(医学版), 2019, 40(5): 644-649. |
| [24] |
Zhang J, Deng ZY, Wu X. Regulation of bile acids on metabolic diseases[J]. Chinese Journal of Biochemistry and Molecular Biology, 2019, 35(4): 399-403. (in Chinese) 张娟, 邓泽元, 吴信. 胆汁酸对代谢性疾病的调控[J]. 中国生物化学与分子生物学报, 2019, 35(4): 399-403. |
| [25] |
Yan XM, Zhang YL, Peng Y, Li XB. The water extract of Radix scutellariae, its total flavonoids and baicalin inhibited CYP7A1 expression, improved bile acid, and glycolipid metabolism in T2DM mice[J]. Journal of Ethnopharmacology, 2022, 293: 115238. |
| [26] |
Makki K, Brolin H, Petersen N, Henricsson M, Christensen DP, Khan MT, Wahlström A, Bergh PO, Tremaroli V, Schoonjans K, et al. 6α-hydroxylated bile acids mediate TGR5 signalling to improve glucose metabolism upon dietary fiber supplementation in mice[J]. Gut, 2022. DOI:10.1136/gutjnl-2021-326541 |
 2022, Vol. 49
2022, Vol. 49




