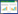扩展功能
文章信息
- 蒋嘉峰, 肖澜, 谢浩, 沈雷, 陈自忍
- JIANG Jiafeng, XIAO Lan, XIE Hao, SHEN Lei, CHEN Ziren
- 重组细菌多药外排泵AcrAB-TolC的转运功能和动态组装
- Transport function and dynamic assembly of a recombinant bacterial multidrug efflux pump, AcrAB-TolC
- 微生物学通报, 2022, 49(11): 4617-4628
- Microbiology China, 2022, 49(11): 4617-4628
- DOI: 10.13344/j.microbiol.china.220133
-
文章历史
- 收稿日期: 2022-02-10
- 接受日期: 2022-04-19
- 网络首发日期: 2022-07-19
抗菌药物是人类抵抗细菌感染的有力武器。然而,细菌可以通过多种方式获得对抗菌药物的抵抗能力而成为“耐药菌”,严重危害人类健康。2019年,全球约495万死亡案例与细菌耐药感染有关,其中127万人直接死于细菌耐药感染[1]。2020年,中国细菌耐药监测网的统计数据显示,临床上从患者体内分离出的菌株有71.9%为革兰氏阴性菌,对常用抗生素都存在较高的耐药水平[2]。
细菌对于抗菌药物的耐药机制主要包括:(1) 降解或修饰抗菌药物使其失活;(2) 抑制抗菌药物的跨膜转运和吸收,或提高对抗菌药物的外排能力,降低抗菌药物的胞内浓度;(3) 改变抗菌药物的作用靶点或受其影响的生理、代谢途径;(4) 形成细菌生物被膜阻碍和限制抗菌药物对细菌的作用[3-5]。其中,细菌生物被膜是包裹着细菌群落的黏附聚合物,能够阻止抗生素等物质的扩散和进入细菌[6-8]。细菌生物被膜的形成受细菌的群体感应(quorum sensing,QS)效应调控,通过达到阈值浓度的QS信号分子诱导特异基因的表达,促进生物被膜的形成[9]。细菌多药外排泵多为膜蛋白复合体,不仅参与抗菌药物的转运[10],也可能参与对革兰氏阴性菌的QS信号分子如酰基高丝氨酸内酯的转运[11],在细菌的耐药性中有着极其复杂的功能。
耐药结节细胞分化家族(resistance-nodulation-cell division family,RND)是仅存在于革兰氏阴性菌中的多药外排泵家族,在临床所分离的耐药菌株中,常常存在上调表达的现象[12-14]。AcrAB-TolC多药外排泵家族是RND家族的主要代表,由内膜转运蛋白AcrB、周质融合蛋白AcrA及外膜通道蛋白TolC组成,参与革兰氏阴性菌的药物外排、生物被膜形成的调控等多种生命活动,在细菌耐药性的形成中具有重要的作用[15-16]。AcrAB-TolC复合体呈现为不对称的哑铃棒结构,其三组分的化学计量比为3:6:3[17-18]。在组装过程中,AcrA形成二聚体,与AcrB三聚体结合形成AcrA-AcrB复合物,再与TolC三聚体结合,组装成具有完整结构和功能的外排泵复合体[19-21]。AcrAB-TolC在行使转运功能时,底物从AcrB胞质侧开放处进入复合体,在AcrB跨膜区域网络中残基质子化导致的构象变化作用下进入中央腔室,经过由TolC和AcrA之间的收缩作用而打开的通道向胞外排放[22-23]。
目前,对于外排泵复合体包括RND家族在内的研究,在功能性组装及转运底物的活性方面仍然需要进一步深入[24],以便于针对耐药菌提出新的抗菌策略和开发新的抗菌药物。因此,本研究将针对AcrAB-TolC的转运功能和功能组装进行研究,研究内容包括复合体及亚基的表达和纯化、转运功能测试及体外动态组装观察,以期为多药外排泵相关的抗菌药物研发提供新的角度和思路。
1 材料与方法 1.1 菌株、引物及培养基研究所用大肠杆菌(Escherichia coli)菌株K-12、DH5α、BL21(DE3)、质粒pET-28a(+)均为本实验室保存。PCR引物(表 1)由生工生物工程(上海)股份有限公司完成。LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,氯化钠10.0,pH 7.0,1×105 Pa灭菌20 min。使用前添加经0.22 μm滤膜过滤除菌的卡那霉素至终浓度为30 μg/mL。
| 引物名称 Primer name |
引物序列 Primer sequence (5ʹ→3ʹ) |
| AcrA_F Nco I | GATATACCATGGATGAACAAAAAC |
| AcrA_R-Xho I | GTGGTGCTCGAGTTAAGACTTGGAC |
| AcrB_F-BamH I | CGCGGATCCATGCCTAATTTCTTTATCG |
| AcrB_R-Xho I | CCGCTCGAGATGATGATCGACAGTATGG |
| TolC_F-Nco I | CATGCCATGGGCATGAAGAAATTGCTCC |
| TolC_R-Xho I | CCGCTCGAGGTTACGGAAAGGGTTATGAC |
十二烷基-β-D-麦芽糖苷(N-dodecyl-β-D-maltoside,DDM),麦克林试剂公司;细菌基因组DNA快速抽提试剂盒、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)和Ni-NTA 6FF琼脂糖纯化树脂,生工生物工程(上海)股份有限公司;KOD-plus,TOYOBO公司;Alexa fluor 488 NHS Ester,翌圣生物科技(上海)股份有限公司;Alexa FluorTM 532 C5 Maleimide和Fluorescent Dye Removal Columns,南京赛泓瑞生物科技有限公司。
台式超速离心机,Beckman公司;荧光分光光度计,上海棱光技术有限公司;等温滴定量热仪,Malvern公司;全内反射荧光显微镜,Nikon公司。
1.3 分子生物学实验利用细菌基因组DNA快速抽提试剂盒提取E. coli K-12总基因组DNA,使用高保真酶(KOD-plus)分别对acrA、acrB、tolC基因进行PCR扩增。PCR反应体系(50 μL):Genome DNA (50−100 ng/μL) 5 μL,dNTPs (10 mmol/L) 5 μL,10×KOD plus buffer 5 μL,MgSO4 (25 mmol/L) 2 μL,KOD-plus (1 U/μL) 1 μL,Primer_F (10 μmol/L) 1.5 μL,Primer_R (10 μmol/L) 1.5 μL,ddH2O 29 μL。触减(touch down) PCR反应条件:94 ℃ 2 min;94 ℃ 30 s,65 ℃ 30 s,68 ℃ 90 s/210 s,10个循环,退火温度–1 ℃/循环;94 ℃ 30 s,55 ℃ 30 s,68 ℃ 90 s/210 s,10个循环;68 ℃ 10 min。随后经酶切、消化、连接后构建重组质粒载体pET-28a[AcrA]、pET-28a[AcrB]和pET-28a[TolC],转入E. coli DH5α感受态用以保存,转入E. coli BL21(DE3)用以表达,并送生工生物工程(上海)股份有限公司进行测序。
1.4 蛋白的表达与纯化含重组质粒的表达宿主菌种在含卡那霉素(30 μg/mL)的LB培养基平板划线,37 ℃培养12−16 h,挑选克隆接种至3−5 mL LB液体培养基(含卡那霉素30 μg/mL)中,37 ℃、220 r/min培养12−16 h,然后按1:100的体积比接种于LB液体培养基(含卡那霉素30 μg/mL)中,37 ℃、220 r/min培养至OD600值为0.4−1.0时添加IPTG (终浓度1.0 mmol/L),于16 ℃或37 ℃继续培养16 h,诱导外排泵亚基蛋白的表达。诱导后的细菌于4 ℃、6 000×g离心10 min,收集细菌沉淀于−20 ℃保存。
取1 g细菌沉淀重悬于10 mL缓冲液A [20 mmol/L Tris, 300 mmol/L NaCl, 1 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF), pH 8.0],用细胞破碎机破碎,4 ℃、10 000×g离心20 min。含AcrA的破碎后离心上清液直接与Ni-NTA树脂在4 ℃下混合结合4 h,经缓冲液B (20 mmol/L Tris,300 mmol/L NaCl,50 mmol/L imidazole,pH 8.0)洗涤,于洗脱液C (20 mmol/L Tris,300 mmol/L NaCl,500 mmol/L imidazole,pH 8.0)中洗脱。含AcrB或TolC的破碎后离心上清液于4 ℃、100 000×g离心25 min,沉淀重悬于缓冲液A后添加10% (质量体积分数) DDM至终浓度为1%,4 ℃过夜溶解细胞膜后,4 ℃、100 000×g离心1 h;取上清稀释10倍后与Ni-NTA树脂在4 ℃下混合结合4 h,经含有0.025% DDM的缓冲液B洗涤多次,于含有0.025% DDM的洗脱液(20 mmol/L Tris,300 mmol/L NaCl,500 mmol/L imidazole,0.025% DDM,pH 8.0)中洗脱。获得的蛋白经超滤交换于含有0.025% DDM的pH 7.4磷酸缓冲盐溶液(phosphate buffer saline, PBS)用于后续实验。
1.5 溴化乙锭(ethidium bromide,EB)的活细胞转运实验4 ℃、6 000×g离心10 min收集AcrA、AcrB、TolC亚基过表达的宿主菌,用KPI缓冲液(100 mmol/L KH2PO4,5 mmol/L MgSO4,pH 7.0)洗涤3次,重悬后调整至OD600值为1.0。取900 μL菌液与600 μL的25 μmol/L EB混合,测定混合液的荧光光谱,制作细菌对EB的摄取曲线。摄取结束后,取菌液于8 000×g室温离心1 min,弃上清,重悬于1.5 mL KPI,以相同条件测定荧光光谱,制作细菌对EB的外排曲线。对照组Ⅰ为不含质粒的E. coli BL21(DE3);对照组Ⅱ为含有过表达非通道膜蛋白INP-AidH的细菌。EB的摄取率或外排率=(Xt–X0)/X0×100%,t为EB的摄取或外排时间。相同检测条件下,在测定前添加酰基高丝氨酸内酯分子C6-HSL至终浓度为0.1 mmol/L,以检测C6-HSL对外排泵亚基转运EB活性的影响。
1.6 等温滴定实验等温滴定测量在37 ℃进行。待滴定液体积为280 μL,完全除去气泡。滴定液体积为38 μL,在750 r/min旋转中滴定19次,滴定时间4 s,间隔反应150 s。分别进行了AcrA-AcrB、AcrA-TolC和AcrB-TolC的相互作用检测以及高浓度C6-HSL和AcrB、TolC的相互作用检测。
1.7 AcrAB-TolC外排泵的动态装配及观察首先对AcrB蛋白进行荧光标记。AcrB蛋白预先超滤透析于10 mmol/L PBS中,浓度控制为2−20 mg/mL,再向每毫升蛋白溶液中加入0.1 mL的1 mol/L碳酸氢钠缓冲液调至pH 8.3−9.0。向蛋白样品中添加50−100 μL/mL Alexa fluor 488 NHS Ester (10 mg/mL)的染料,室温下避光混匀搅拌孵育2 h,然后对AcrA、TolC进行荧光标记。AcrA和TolC预先超滤透析于10 mmol/L PBS中,浓度控制为50−100 μmol/L,按荧光标记物: 蛋白的摩尔比为(10−20): 1将二者混合,室温避光混匀搅拌孵育2 h。未结合荧光标记物采用Fluorescent Dye Removal Columns试剂盒去除。
AcrAB-TolC外排泵的体外动态装配采用全内反射荧光显微镜(total internal reflection fluorescence microscope,TIRFM)测定。将荧光标记好的AcrB、AcrA、TolC依次滴定于预制二月桂酰基卵磷脂(1, 2-dilauryl-sn-glycero-3-phosphocholine,DLPC)膜上,孵育1 h后进行拍摄,取每个时间段分析AcrAB-TolC外排泵的动态装配过程。屏幕的观测范围是50 μm×50 μm。
2 结果与分析 2.1 AcrAB-TolC复合体亚基功能性表达与纯化利用含有重组质粒载体pET-28a[AcrA]、pET-28a[AcrB]和pET-28a[TolC]的大肠杆菌BL21(DE3)为表达宿主,利用IPTG分别进行了诱导表达,SDS-PAGE电泳检测结果与预期一致,即在43 kDa (AcrA)、113 kDa (AcrB)、55 kDa (TolC)处观察到有蛋白质表达,表明各亚基的诱导表达获得了成功(图 1A−1C),并且0.1−1 mmol/L浓度范围内的IPTG对于AcrAB-TolC各亚基的表达量并无显著影响。此外,利用Ni-NTA亲和层析技术对AcrA、AcrB、TolC的纯化也获得了成功(图 1D),并且纯度大于98%。
|
| 图 1 AcrA、AcrB、TolC的诱导表达(A、B、C)、纯化(D)以及对EB的摄取(E)和外排(F) Figure 1 Induced expression of AcrA, AcrB, TolC (A, B, C), purification (D) and EB uptake (E), efflux (F). M:分子量标记。A–C:0、0.1、0.2、0.5、1.0分别对应IPTG浓度为0、0.1、0.2、0.5、1.0 mmol/L,箭头指向各亚基对应的位置;D:AcrA、AcrB、TolC分别对应纯化的复合体亚基;E:重组外排泵亚基的表达对于EB摄取的影响;F:重组外排泵亚基的表达对于EB外排的影响 A, B, C, M: Molecular weight marker, 0, 0.1, 0.2, 0.5, 1: Total proteins of cells induced by IPTG at concentrations of 0, 0.1, 0.2, 0.5, 1 mmol/L; D: Showed purified subunits of AcrAB-TolC complex; E, F: Showed EB uptake and efflux by cells with expressed subunit of AcrAB-TolC complex. |
|
|
利用表达有AcrAB-TolC复合体各亚基的大肠杆菌BL21(DE3)宿主菌,进一步对AcrAB-TolC各亚基对于外排泵转运底物荧光染料EB的转运活性进行了研究。由于大肠杆菌基因组含有AcrAB-TolC复合体基因,因此,以不含表达质粒的BL21(DE3)作为对照组Ⅰ,以含有表达非通道蛋白INP-AidH质粒的BL21(DE3)为对照组Ⅱ。结果(图 1E、1F)显示,BL21(DE3)表达了AcrAB-TolC复合体的重组亚基对EB的摄取率和外排率明显高于对照组,但在AcrA、AcrB和TolC各亚基之间,AcrB对EB的摄取率和外排率高于AcrA和TolC,不过差异并不显著。这表明基因组编码的内源AcrAB-TolC各亚基也参与了经诱导表达后各亚基的组装以及对EB的转运,因此,无论哪种亚基的表达都能通过参与AcrAB-TolC的组装提高其数量从而促进宿主对EB的摄取率和外排率。然而,AcrB是内膜转运蛋白,AcrB的表达对于AcrAB-TolC复合体的组装和数量提高的贡献更明显。对照组Ⅱ比对照组Ⅰ的摄取率和外排率略有增加,但也不显著,这可能与INP-AidH的表达影响了外膜通透性或者外排泵组装有关。
通过以上研究获得了具有活性的AcrAB-TolC各亚基,据此推测,额外表达的AcrAB-TolC各亚基可以参与内源AcrAB-TolC复合体的组装,并参与对EB的转运。
2.2 AcrAB-TolC复合体各亚基与C6-HSL的相互作用有研究报道,RND家族在一定条件下参与了革兰氏阴性菌QS信号分子酰基高丝氨酸内酯的转运[25-26]。我们测试了酰基高丝氨酸内酯C6-HSL对表达有AcrAB-TolC复合体重组亚基的细菌转运EB活性的影响。EB的摄取和外排数据显示,对于未表达AcrAB-TolC复合体亚基的细菌而言,C6-HSL对EB的摄取和外排无显著影响(图 2A、2B)。对于表达有重组AcrA亚基的细菌而言,C6-HSL对于EB的摄取和外排也无显著影响(图 2C、2D)。对于表达有重组AcrB亚基、重组TolC亚基的细菌而言,C6-HSL对EB的转运活性有抑制作用,表现为对EB的摄取率和外排率均略有降低。由于AcrA为周质蛋白,仅在AcrAB-TolC复合体组装中发挥功能,未直接与转运底物发生相互作用,所以C6-HSL对于AcrAB-TolC复合体介导的EB转运活性基本无影响;而AcrB和TolC分别为内膜和外膜通道蛋白,直接介入了AcrAB-TolC复合体对EB的转运,其表达量和EB的转运活性有关。当C6-HSL作为底物与EB竞争额外表达的AcrB和TolC亚基时,会减少额外参与EB转运的AcrAB-TolC复合体的AcrB和TolC亚基的组装,从而降低对EB的转运活性(图 2E−2H)。需要指出的是,由于重组AcrB亚基或重组TolC亚基的表达量未达到显著影响EB转运活性的水平,不能完全排除内源AcrB亚基或TolC亚基的影响,所以C6-HSL对EB转运活性的抑制效果不显著。

|
| 图 2 C6-HSL对表达有AcrAB-TolC复合体亚基细菌EB转运活性的影响 Figure 2 Effects of C6-HSL on EB transport activity of bacteria expressing AcrAB-TolC complex subunits. A和B:C6-HSL对于未额外表达AcrAB-TolC复合体亚基细菌的EB摄取和外排影响;C和D:C6-HSL对于表达有AcrA亚基细菌的EB摄取和外排影响;E和F:C6-HSL对于表达有AcrB亚基细菌的EB摄取和外排影响;G和H:C6-HSL对于表达有TolC亚基细菌的EB摄取和外排影响 A, B: Showed the effect of C6-HSL on EB uptake and efflux of bacteria without additional expression of AcrAB-TolC complex subunits; C, D: Showed the effect of C6-HSL on EB uptake and efflux of bacteria expressing AcrA subunit; E, F: Showed the effect of C6-HSL on EB uptake and efflux of bacteria expressing AcrB subunit; G, H: Showed the effect of C6-HSL on EB uptake and efflux of bacteria expressing TolC subunit. |
|
|
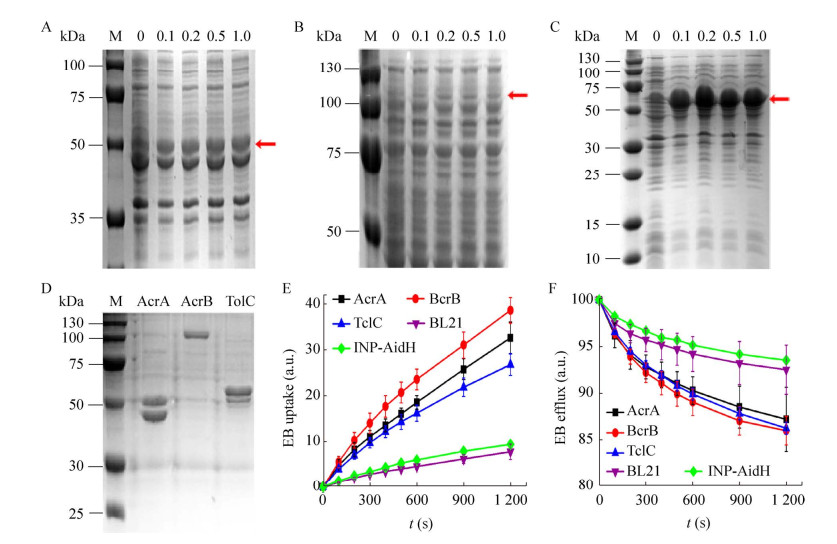
为了进一步证实C6-HSL与AcrAB-TolC复合体各亚基的相互作用,进一步利用等温滴定技术测试了纯化的AcrB、TolC与C6-HSL的相互作用。(图 3A−3D)结果表明,C6-HSL与AcrB和TolC均表现出了较为明显的相互作用(作用位点N > 1),而且与AcrB的结合更明显(N=5.12)。综合以上结果和C6-HSL抑制EB转运活性的实验结果,表明C6-HSL确实与AcrAB-TolC复合体的内膜转运蛋白AcrB和外膜通道蛋白TolC有相互作用,而周质蛋白AcrA是通过参与复合体组装过程影响AcrAB-TolC复合体的转运活性。
|
| 图 3 C6-HSL与AcrB、TolC相互作用的等温滴定检测 Figure 3 Isothermal titration detection of interaction between C6-HSL with AcrB and TolC. A和B:C6-HSL和AcrB相互作用的等温滴定曲线和热量变化,C和D:C6-HSL和TolC相互作用的等温滴定曲线和热量变化 A, B: Showsed the isothermal titration curve and heat change of the interaction between C6-HSL and AcrB. C, D: Showed the isothermal titration curve and heat change of the interaction between C6-HSL and TolC. |
|
|
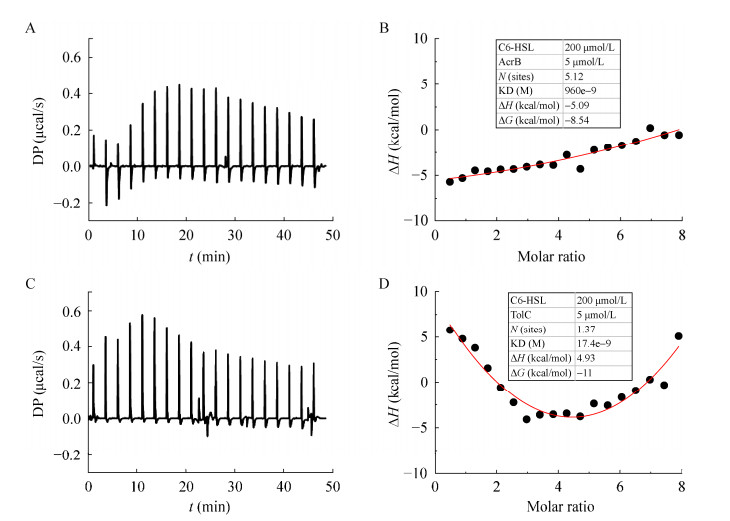
根据文献[27]报道及前述实验结果,AcrAB-TolC复合体亚基间可能存在相互作用及动态组装过程。利用等温滴定技术测试了纯化的AcrA、AcrB、TolC亚基间的相互作用,发现AcrA和AcrB之间(图 4A、4B)及AcrA和TolC之间(图 4E、4F)存在较为明显的相互作用,但是AcrB和TolC之间(图 4C、4D)无明显的相互作用。这个结果表明,周质蛋白AcrA在AcrAB-TolC复合体的组装过程中起到了联系两个亚基AcrB和TolC的作用。AcrA-AcrB间的解离常数(KD)远高于AcrA-TolC间的解离常数,表明AcrA-AcrB比AcrA-TolC具有更加稳定的相互作用。可能因为AcrB形成了三聚体,可以与多个AcrA亚基发生相互作用。当AcrA和AcrB形成较稳定的多聚体后,再与TolC相互作用形成具有完整功能的AcrAB-TolC复合体。
|
| 图 4 AcrAB-TolC各亚基相互作用的等温滴定检测 Figure 4 Isothermal titration detection of interaction between AcrAB-TolC each subunit. A和B:AcrA和AcrB相互作用的等温滴定曲线和热变化;C和D:AcrB和TolC相互作用的等温滴定曲线和热变化;E和F显示AcrA和TolC相互作用的等温滴定曲线和热变化 A, B: Showed the isothermal titration curve and heat change of the interaction between AcrA and AcrB. C, D: Showed the isothermal titration curve and heat change of the interaction between AcrB and TolC. E, F: Showed the isothermal titration curve and heat change of the interaction between AcrA and TolC. |
|
|
进一步利用单分子荧光技术对AcrA、AcrB、TolC在膜上的组装过程进行了观察。首先分别对AcrA、AcrB、TolC这3种蛋白进行了荧光标记,然后在DLPC膜上依次滴加AcrB、AcrA、TolC并进行孵育,采用全内反射荧光显微镜观测和拍摄。基于显微镜下所观察到的荧光点数量、亮度、尺寸、运动的变化情况,可以分析荧光标记的AcrAB-TolC复合体亚基的组装进程。实验结果显示,在AcrAB-TolC组装起始后1 h内,蛋白质组装体所体现的荧光点数量和亮度无明显变化(图 5A−5D)。但是从1 h后荧光强度增加,说明3种蛋白在DLPC膜上进一步组装成比蛋白单体大的聚集体形态。

|
| 图 5 AcrAB-TolC外排泵在DLPC膜上的动态装配过程 Figure 5 The dynamic assembly process of AcrAB-TolC efflux pump on the DLPC membrane. A–D:分别显示的组装起始及15、50、65 min时荧光点强度和数量变化 A, B, C, D: Respectively showed the changes of fluorescence point intensity and number at the beginning of assembly, 15, 50 and 65 min. |
|
|
AcrAB-TolC外排泵复合体通过转运药物分子或转运QS信号分子导致生物被膜的形成,从而直接或间接地参与细菌的耐药作用,在耐药菌的药物研发中具有重要意义。目前,对于AcrAB-TolC外排泵复合体的结构和功能已经有了较多研究,但各亚基及在转运底物中的作用还有待深入了解,尤其对AcrAB-TolC各亚基的组装及QS信号分子的转运尚无直接证据。本研究中,我们对AcrAB-TolC外排泵复合体各亚基重组蛋白分别进行了表达并测试了对EB的转运活性,研究结果表明,各亚基参与了AcrAB-TolC外排泵复合体的组装并影响转运活性。通过测试酰基高丝氨酸内酯C6-HSL对于表达有AcrAB-TolC复合体重组亚基的细菌转运EB活性的影响,以及C6-HSL和纯化的AcrAB-TolC复合体各亚基的相互作用,结果显示,C6-HSL与AcrB和TolC具有较明显的相互作用,并能抑制EB的转运活性。这些结果支持C6-HSL是AcrAB-TolC复合体的底物之一,并且AcrAB-TolC复合体各亚基是通过组装形成复合体后参与底物转运的结果。最后,我们利用等温滴定实验观察到AcrA-AcrB间、AcrA-TolC间的相互作用,发现AcrA介导的AcrB和TolC组装成了具有功能的AcrAB-TolC复合体,并提出利用单分子荧光技术观察AcrAB-TolC外排泵在脂膜上的动态装配过程,对后续研究AcrAB-TolC外排泵动态装配的动力学数据提供了实验依据。随着国内外对细菌耐药性研究的深入,未来的研究将重点关注多药排外泵的动态装配过程及调控的分子机制,可为相关的药物研发提供理论和技术支持。
| [1] |
Murray C J L, Ikuta K S, Sharara F, et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis[J]. The Lancet, 2022, 399(10325): 629-655. DOI:10.1016/S0140-6736(21)02724-0 |
| [2] |
Hu FP, Guo Y, Zhu DM, Wang F, Jiang XF, Xu YC, Zhang XJ, Zhang ZX, Ji P, Xie Y, et al. CHINET surveillance of bacterial resistance: results of 2020[J]. Chinese Journal of Infection and Chemotherapy, 2021, 21(4): 377-387. (in Chinese) 胡付品, 郭燕, 朱德妹, 汪复, 蒋晓飞, 徐英春, 张小江, 张朝霞, 季萍, 谢轶等. 2020年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2021, 21(4): 377-387. |
| [3] |
Cui HY, Zhang XJ, Zhao CT, Zhou H, Li W, Lin L. Research progress of bacterial biofilm[J]. Jiangsu Agricultural Sciences, 2015, 43(8): 11-14. (in Chinese) 崔海英, 张雪婧, 赵呈婷, 周慧, 李伟, 林琳. 细菌生物膜的研究进展[J]. 江苏农业科学, 2015, 43(8): 11-14. |
| [4] |
Van Duijkeren E, Schink AK, Roberts MC, Wang Y, Schwarz S. Mechanisms of bacterial resistance to antimicrobial agents[J]. Microbiology Spectrum, 2018, 6(1): 2018 Jan; 6(1)
|
| [5] |
Davin-Regli A, Pages JM, Ferrand A. Clinical status of efflux resistance mechanisms in Gram-negative bacteria[J]. Antibiotics: Basel, Switzerland, 2021, 10(9): 1117. |
| [6] |
Donlan RM. Biofilms: microbial life on surfaces[J]. Emerging Infectious Diseases, 2002, 8(9): 881-890. DOI:10.3201/eid0809.020063 |
| [7] |
Høiby N. A personal history of research on microbial biofilms and biofilm infections[J]. Pathogens and Disease, 2014, 70(3): 205-211. DOI:10.1111/2049-632X.12165 |
| [8] |
García A B, Percival S L. Zoonotic infections: the role of biofilms[A]. Biofilms and Veterinary Medicine[M]. Springer, Berlin, Heidelberg, 2011: 69-110
|
| [9] |
Mukherjee S, Moustafa D, Smith CD, Goldberg JB, Bassler BL. The RhlR quorum-sensing receptor controls Pseudomonas aeruginosa pathogenesis and biofilm development independently of its canonical homoserine lactone autoinducer[J]. Plos Pathogens, 2017, 13(7): e1006504. DOI:10.1371/journal.ppat.1006504 |
| [10] |
Nishino K, Yamasaki S, Nakashima R, Zwama M, Hayashi-Nishino M. Function and inhibitory mechanisms of multidrug efflux pumps[J]. Frontiers in Microbiology, 2021, 12: 737288. DOI:10.3389/fmicb.2021.737288 |
| [11] |
Wu SB, Liu JH, Liu CJ, Yang AD, Qiao JJ. Quorum sensing for population-level control of bacteria and potential therapeutic applications[J]. Cellular and Molecular Life Sciences: CMLS, 2020, 77(7): 1319-1343. DOI:10.1007/s00018-019-03326-8 |
| [12] |
Weston N, Sharma P, Ricci V, Piddock LJV. Regulation of the AcrAB-TolC efflux pump in Enterobacteriaceae[J]. Research in Microbiology, 2018, 169(7/8): 425-431. |
| [13] |
Blair JMA, Smith HE, Ricci V, Lawler AJ, Thompson LJ, Piddock LJV. Expression of homologous RND efflux pump genes is dependent upon AcrB expression: implications for efflux and virulence inhibitor design[J]. The Journal of Antimicrobial Chemotherapy, 2015, 70(2): 424-431. DOI:10.1093/jac/dku380 |
| [14] |
Piddock LJV. Clinically relevant chromosomally encoded multidrug resistance efflux pumps in bacteria[J]. Clinical Microbiology Reviews, 2006, 19(2): 382-402. DOI:10.1128/CMR.19.2.382-402.2006 |
| [15] |
Klenotic PA, Moseng MA, Morgan CE, Yu EW. Structural and functional diversity of resistance-nodulation-cell division transporters[J]. Chemical Reviews, 2021, 121(9): 5378-5416. DOI:10.1021/acs.chemrev.0c00621 |
| [16] |
Hua WC, Deng ZC, Zhang Y, Zhu DP, Chen ZB. Research progress of AcrAB-TolC efflux pump in multidrug resistant enterobacteria[J]. China Modern Doctor, 2021, 59(4): 184-188. (in Chinese) 华炜聪, 邓在春, 张筠, 朱丹萍, 陈众博. AcrAB-TolC外排泵在多重耐药肠杆菌中的作用研究进展[J]. 中国现代医生, 2021, 59(4): 184-188. |
| [17] |
Hayashi K, Nakashima R, Sakurai K, Kitagawa K, Yamasaki S, Nishino K, Yamaguchi A. AcrB-AcrA fusion proteins that act as multidrug efflux transporters[J]. Journal of Bacteriology, 2015, 198(2): 332-342. |
| [18] |
Tikhonova EB, Yamada Y, Zgurskaya HI. Sequential mechanism of assembly of multidrug efflux pump AcrAB-TolC[J]. Chemistry & Biology, 2011, 18(4): 454-463. |
| [19] |
Monroe N, Sennhauser G, Seeger MA, Briand C, Grütter MG. Designed ankyrin repeat protein binders for the crystallization of AcrB: plasticity of the dominant interface[J]. Journal of Structural Biology, 2011, 174(2): 269-281. DOI:10.1016/j.jsb.2011.01.014 |
| [20] |
Lu W, Zhong M, Chai Q, Wang ZS, Yu LL, Wei YN. Functional relevance of AcrB trimerization in pump assembly and substrate binding[J]. PLoS One, 2014, 9(2): e89143. DOI:10.1371/journal.pone.0089143 |
| [21] |
Wang ZS, Lu W, Rajapaksha P, Wilkop T, Cai YG, Wei YN. Comparison of in vitro and in vivo oligomeric states of a wild type and mutant trimeric inner membrane multidrug transporter[J]. Biochemistry and Biophysics Reports, 2018, 16: 122-129. |
| [22] |
Shi XD, Chen MY, Yu ZL, Bell JM, Wang H, Forrester I, Villarreal H, Jakana J, Du DJ, Luisi BF, et al. In situ structure and assembly of the multidrug efflux pump AcrAB-TolC[J]. Nature Communications, 2019, 10: 2635. DOI:10.1038/s41467-019-10512-6 |
| [23] |
Wang Z, Fan GZ, Hryc CF, Blaza JN, Serysheva II, Schmid MF, Chiu W, Luisi BF, Du DJ. An allosteric transport mechanism for the AcrAB-TolC multidrug efflux pump[J]. Elife, 2017, 6: e24905. |
| [24] |
Yang S, Lopez CR, Zechiedrich EL. Quorum sensing and multidrug transporters in Escherichia coli[J]. PNAS, 2006, 103(7): 2386-2391. |
| [25] |
Papenfort K, Bassler BL. Quorum sensing signaresponse systems in Gram-negative bacteria[J]. Nature Reviews Microbiology, 2016, 14(9): 576-588. |
| [26] |
Alav I, Kobylka J, Kuth MS, Pos KM, Picard M, Blair JMA, Bavro VN. Structure, assembly, and function of tripartite efflux and type 1 secretion systems in Gram-negative bacteria[J]. Chemical Reviews, 2021, 121(9): 5479-5596. |
| [27] |
Touzé T, Eswaran J, Bokma E, Koronakis E, Hughes C, Koronakis V. Interactions underlying assembly of the Escherichia coli AcrAB-TolC multidrug efflux system[J]. Molecular Microbiology, 2004, 53(2): 697-706. |
 2022, Vol. 49
2022, Vol. 49