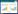扩展功能
文章信息
- 张强, 张艳茹, 霍云凤, 韩阳超, 王朋, 陆宁海
- ZHANG Qiang, ZHANG Yanru, HUO Yunfeng, HAN Yangchao, WANG Peng, LU Ninghai
- 禾谷镰刀菌拮抗菌21-6的鉴定及其抑菌活性测定
- Identification and activity of Streptomyces sp. 21-6 against Fusarium graminearum
- 微生物学通报, 2022, 49(10): 4144-4157
- Microbiology China, 2022, 49(10): 4144-4157
- DOI: 10.13344/j.microbiol.china.220123
-
文章历史
- 收稿日期: 2022-02-01
- 接受日期: 2022-03-13
- 网络首发日期: 2022-04-07
2. 新乡工程学院生物工程学院, 河南 新乡 453700
2. School of Biotechnology, Xinxiang Institute of Engineering, Xinxiang 453700, Henan, China
由禾谷镰刀菌(Fusarium graminearum)为主要病原菌侵染引起的小麦赤霉病严重威胁小麦的安全生产[1],受多种因素的影响,小麦赤霉病在我国的流行频率明显增加[2-3]。此外,禾谷镰刀菌还能够导致小麦茎基腐病的发生并造成严重损失[4]。在造成产量损失之外,禾谷镰刀菌还可以产生多种真菌毒素,给人畜健康带来安全隐患[5]。目前生产上主要依赖化学药剂进行防控,但随着化学药剂的长期使用,不仅导致禾谷镰刀菌抗药性菌株大量出现,而且增加了其毒素污染问题[2]。
与化学防治相比,生物防治的应用对于有效防控禾谷镰刀菌并保障食品安全具有重要意义[6-7]。链霉菌作为生防菌的一个重要类群,对很多病原菌都具有明显的拮抗效果[8]。如公牛链霉菌(Streptomyces tauricus) JPD-1发酵滤液能够抑制苹果树腐烂病菌的生长和病斑扩展[9]。杀结节链霉菌(S. tubercidicus) ST7-2可以有效降低水稻稻瘟病的发生[10]。链霉菌可以利用多种代谢产物实现生防作用,如产二素链霉菌(S. ambofaciens) IMS002可以产生borrelidin等多种化合物,从而对尖孢镰刀菌起到抑制作用[11]。除了能够防治植物病害,链霉菌在促进植物生长方面也有一定的作用,如栗褐链霉菌(S. badius)具有固氮和解有机磷作用,并且还能产生1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid,ACC) 脱氨酶和吲哚乙酸(indoleacetic acid,IAA)[12]。
目前,利用链霉菌对禾谷镰刀菌进行生物防治也有相关研究。例如微白黄链霉菌(S. albidoflavus)[13]、八丈岛链霉菌(S. hachijoensis)[14]、纺锤链霉菌(S. netropsis)[15]、草地链霉菌(S. pratensis)[16]和彻氏链霉菌(S. rochei)[17]等都能够对禾谷镰刀菌起到较好的生防效果。本研究从蔬菜大棚土壤中分离筛选到一株对禾谷镰刀菌具有明显拮抗作用的链霉菌21-6,通过形态学和生理生化特征及16S rRNA基因序列分析进行鉴定,并对其无菌发酵液的抑菌活性、稳定性等方面进行研究,以期为抑菌机理研究和菌剂开发提供理论基础。
1 材料与方法 1.1 材料 1.1.1 菌株禾谷镰刀菌(Fusarium graminearum)、瓜类炭疽病菌(Colletorichum lagenerium)、大斑凸脐蠕孢(Exserohilum turcicum)、尖孢镰刀菌(F. oxysporum)、层出镰刀菌(F. proliferatum)和假禾谷镰刀菌(F. pseudograminearum)均为作者分离获得,并保存于河南科技学院资源与环境学院植物病理学实验室。链霉菌(Streptomycetaceae stelliscabiei) 21-6由作者分离于河南省新乡市牧野区蔬菜大棚土壤。
1.1.2 培养基马铃薯葡萄糖琼脂(PDA)培养基(g/L)[14]:马铃薯200.0,葡萄糖20.0,琼脂15.0 (不加琼脂为PDB培养基)。高氏一号培养基(g/L)[14]:可溶性淀粉20.0,K2HPO4 0.5,NaCl 0.5,MgSO4·7H2O 0.5,KNO3 1.0,FeSO4·7H2O 0.01,琼脂15.0 (不加琼脂为高氏一号液体培养基)。YG培养基(g/L)[14]:葡萄糖10.0,酵母提取物10.0,琼脂15.0,pH 7.0。KMB培养基(g/L)[14]:蛋白胨20.0,甘油10.0,K2HPO4 1.5,MgSO4·7H2O 1.5,pH 7.2。发酵培养基(g/L)[18]:葡萄糖25.0,蛋白胨25.0,酵母提取物5.0,MgSO4·7H2O 2.0,K2HPO4·3H2O 2.0,KH2PO4 2.0,CaCO3 5.0,pH 7.2。羧甲基纤维素钠(CMC)培养基(g/L)[19]:羟甲基纤维素钠15.0,酵母提取物1.0,MgSO4·7H2O 0.5,NH4NO3 1.0,KH2PO4 1.0。酵母浸出粉胨葡萄糖(YEPD)培养基(g/L)[19]:酵母提取物3.0,葡萄糖20.0,蛋白胨10.0。
1.1.3 主要试剂和仪器葡萄糖、酵母提取物、蛋白胨和琼脂等,北京奥博星生物技术有限公司;PCR引物,生工生物工程(上海)股份有限公司;细菌基因组DNA提取试剂盒、Taq PCR Mix和DNA Marker,天根生化科技(北京)有限公司。恒温培养箱,郑州生元仪器有限公司;恒温振荡培养箱,常州华普有限公司;PCR仪,杭州朗基科学仪器有限公司;电泳仪,北京君意东方电泳设备有限公司。
1.2 方法 1.2.1 拮抗链霉菌的分离与筛选2021年1月在河南省新乡市牧野区蔬菜大棚采集土壤,于河南科技学院资源与环境学院植物病理学实验室进行菌株分离及后续试验。在1 g土壤样品中加入9 mL无菌水,28 ℃、180 r/min振荡培养30 min,静置10 min后,分别稀释成10–2、10–3和10–4的悬浮液,吸取100 μL不同浓度稀释液涂布于高氏一号平板,平板中含有50 mg/mL重铬酸钾以抑制非放线菌类的细菌和真菌,28 ℃培养7 d,挑取不同单菌落划线纯化。
采用皿内对峙法,挑取待测链霉菌菌体接种在PDA平板四点(距平板中心25 mm处),25 ℃培养2 d,于平板中央接入5 mm大小的禾谷镰刀菌菌饼,继续培养3 d后计算抑菌率。抑菌率=(对照菌落直径−处理菌落直径)/(对照菌落直径−5)×100%。
1.2.2 菌株21-6的鉴定(1) 形态特征观察
将菌株21-6划线接种于高氏一号培养基,28 ℃培养7−14 d,对菌落形态进行观察。采用插片法观察该菌株在高氏一号培养基上的菌丝及孢子丝等特征。
(2) 生理生化特征分析
参照《放线菌快速鉴定与系统分类》[20]测定菌株21-6对多种碳源的利用能力,并进行淀粉水解等试验。
(3) 分子生物学鉴定
使用细菌基因组DNA提取试剂盒对菌株21-6的基因组DNA进行提取,以基因组DNA为模板,利用通用引物27F (5′-AGAGTTTGATC CTGGCTCAG-3′)和1492R (5′-GGTTACCTTGT TACGACTT-3′)对16S rRNA基因进行PCR扩增[12]。PCR反应体系:2×Taq PCR Mix 12.5 μL,27F (10 μmol/L) 1.0 μL,1492R (10 μmol/L) 1.0 μL,DNA模板1.0 μL,ddH2O 9.5 μL。PCR反应条件:95 ℃ 3 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。PCR扩增产物送生工生物工程(上海)股份有限公司进行纯化测序。根据测序结果,在GenBank数据库下载相关菌株的16S rRNA基因序列,利用MEGA 7.0软件采用邻接法构建系统发育树。
1.2.3 菌株21-6发酵条件优化(1) 初始培养基筛选
挑取2个1 cm大小的21-6菌饼,分别置于50 mL的PDB、YG、高氏一号、KMB及发酵培养基中,28 ℃、180 r/min条件下培养5 d。将发酵液于12 000 r/min离心20 min,上清液用无菌0.22 μm微孔滤膜过滤,获得无菌发酵液。将不同来源无菌发酵液与融化并冷却至60 ℃左右的PDA培养基混合,体积分数为10%,凝固后于平板中心接入5 mm大小禾谷镰刀菌菌饼,以不加无菌发酵液的PDA培养基为对照。每个处理重复3次。25 ℃培养3 d后计算抑菌率。抑菌率=(对照菌落直径−处理菌落直径)/(对照菌落直径−5)×100%。
(2) 发酵时间筛选
将菌株21-6置于PDB培养基中培养,分别在2、3、4、5、6和7 d收集发酵液,12 000 r/min离心20 min后进行过滤,获得不同时间段的无菌发酵液,参考初始培养基筛选中的方法分析不同无菌发酵液对禾谷镰刀菌的抑制作用。
(3) 初始pH筛选
分别用1 mol/L HCl和1 mol/L NaOH将PDB培养基的pH值调整为3.0、5.0、7.0、9.0和11.0,将菌株21-6置于不同pH的PDB培养基中培养5 d,获得无菌发酵液后,参考初始培养基筛选中的方法分析不同无菌发酵液对禾谷镰刀菌的抑制作用。
1.2.4 菌株21-6无菌发酵液对禾谷镰刀菌菌丝生长和孢子萌发的影响(1) 菌丝生长
挑取适量新鲜禾谷镰刀菌菌丝体,接种于含有体积分数为10%的菌株21-6无菌发酵液的YEPD培养基,以不加无菌发酵液为对照。25 ℃、150 r/min条件下培养48 h,利用光学显微镜对菌丝形态进行观察。
(2) 孢子萌发
挑取禾谷镰刀菌菌丝体于CMC培养基中,25 ℃、150 r/min条件下培养5 d。培养液用2层滤布进行过滤,3 500 r/min离心10 min收集孢子,用YEPD培养基重悬,并调整孢子浓度为1×106个/mL。在孢子悬浮液中,分别按照10%、20%和50%的体积分数加入菌株21-6的无菌发酵液,以不加无菌发酵液为对照。25 ℃、150 r/min条件下培养12 h,利用光学显微镜对孢子的萌发情况进行观察与统计。萌发率=孢子萌发数/孢子总数×100%;抑制率=(对照萌发率−处理萌发率)/对照萌发率×100%。
1.2.5 菌株21-6无菌发酵液的稳定性研究(1) 热稳定性
将菌株21-6无菌发酵液分别在40、60、80和100 ℃处理30 min,冷却至室温后,按照10% (体积分数)与PDA培养基混合倒板,皿内接入5 mm大小禾谷镰刀菌菌饼。以未用温度处理的无菌发酵液为对照,以不加无菌发酵液的PDA培养基为空白对照。每个处理重复3次。25 ℃培养3 d后,测定不同温度处理下的菌株21-6无菌发酵液的相对抑菌率。相对抑菌率=(空白对照菌落直径−处理菌落直径)/(空白对照菌落直径−未处理菌落直径)×100%。
(2) 酸碱稳定性
将菌株21-6无菌发酵液用1 mol/L HCl和1 mol/L NaOH分别调整pH值为3.0、5.0、7.0、9.0和11.0,室温静置2 h后,调pH值为7.0。以未用酸碱处理的无菌发酵液为对照,以不加无菌发酵液的PDA培养基为空白对照。按照热稳定性方法计算相对抑菌率。
(3) 蛋白酶稳定性
在菌株21-6无菌发酵液中分别加入5 μg/mL终浓度的胃蛋白酶、胰蛋白酶及蛋白酶K,37 ℃处理2 h。以未处理的无菌发酵液为对照,以不加无菌发酵液的PDA培养基为空白对照。按照热稳定性方法计算相对抑菌率。
1.2.6 菌株21-6防病效果分析在培养皿中放入两层滤纸并用无菌水湿润,将10粒无菌水清洗并浸泡2 h后的小麦种子均匀置于滤纸上,25 ℃光照培养箱中保湿培养2 d。用脱脂棉分别蘸取菌株21-6发酵液原液、发酵液10倍稀释液和发酵液50倍稀释液覆盖于小麦种子上,继续保湿培养1 d后将小麦胚芽鞘尖端切除,用脱脂棉蘸取禾谷镰刀菌孢子悬浮液(1×106个/mL)覆盖在芽鞘切口处。每个处理重复3次,以只接种禾谷镰刀菌的小麦胚芽鞘为对照。25 ℃光暗交替(12 h: 12 h)条件下保湿培养7 d后,对胚芽鞘的发病情况进行观察。
1.2.7 菌株21-6聚酮合酶pks及非核糖体多肽合成酶nrps基因的PCR检测以菌株21-6基因组DNA为模板,分别利用引物A3F (5′-GCSTACSYSATSTACACSTCS GG-3′)和A7R (5′-SASGTCVCCSGTSCGGTAS-3′)对nrps基因进行扩增[21],利用K1 (5′-TSAAGTC SAACATCGGBCA-3′)和M6R (5′-CGCAGGTTS CSGTACCAGTA-3′)对pks-Ⅰ基因进行扩增[21],利用A (5′-TSGCSTGCTTGGAYGCSATC-3′)和B (5′-TGGAANCCGCCGAABCCGCT-3′)对pks-Ⅱ基因进行扩增[22]。PCR反应体系:2×Taq PCR Mix 12.5 μL,A3F/K1/A (10 μmol/L) 1.0 μL,A7R/M6R/B (10 μmol/L) 1.0 μL,DNA模板1.0 μL,ddH2O 9.5 μL。PCR反应条件:95 ℃ 3 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 5 min。PCR扩增产物用1%的琼脂糖凝胶电泳进行检测。
1.2.8 菌株21-6抑菌谱测定采用皿内对峙的方式,挑取少量菌株21-6菌体接种在PDA平板四点(距平板中心25 mm处),25 ℃培养2 d,于平板中央分别接入5 mm大小的瓜类炭疽病菌、大斑凸脐蠕孢、尖孢镰刀菌、层出镰刀菌和假禾谷镰刀菌菌饼,25 ℃培养5 d,沿链霉菌菌落与平板中心方向测量链霉菌菌落边缘至真菌菌落边缘的距离,即抑菌带宽度。
2 结果与分析 2.1 菌株21-6对禾谷镰刀菌的抑制作用从土壤样品中共分离筛选获得5株对禾谷镰刀菌具有拮抗效果的链霉菌,其中菌株21-6的拮抗能力最强,能够明显抑制禾谷镰刀菌菌落的生长,并且导致菌落中的色素积累增多。经计算,菌株21-6对禾谷镰刀菌的抑菌率达75.2%±2.1%,表现出较强的抑制能力(图 1)。
|
| 图 1 菌株21-6对禾谷镰刀菌的拮抗作用 Figure 1 Strain 21-6 against Fusarium graminearum on PDA plate. A:禾谷镰刀菌对照;B:菌株21-6与禾谷镰刀菌的平板对峙 A: The control of F. graminearum; B: Inhibition of strain 21-6 against F. graminearum. |
|
|
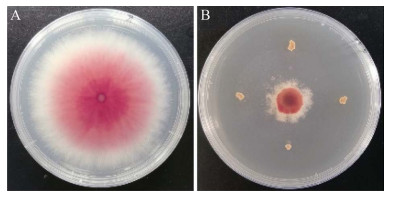
菌株21-6在高氏一号培养基上生长良好,气生菌丝为白色,基内菌丝黄褐色,不产生可溶性色素。菌丝无隔膜,分枝状,孢子丝螺旋排列(图 2)。生理生化结果表明,菌株21-6能够利用葡萄糖、果糖、麦芽糖、蔗糖、甘露醇和阿拉伯糖;能够水解淀粉和利用纤维素;不能使明胶液化、牛奶凝固;不产生黑色素和硫化氢。
|
| 图 2 菌株21-6的形态特征 Figure 2 Morphological characteristics of strain 21-6. A:菌落形态;B:菌丝及孢子丝 A: Colony; B: Mycelium and spore-producing chains. |
|
|
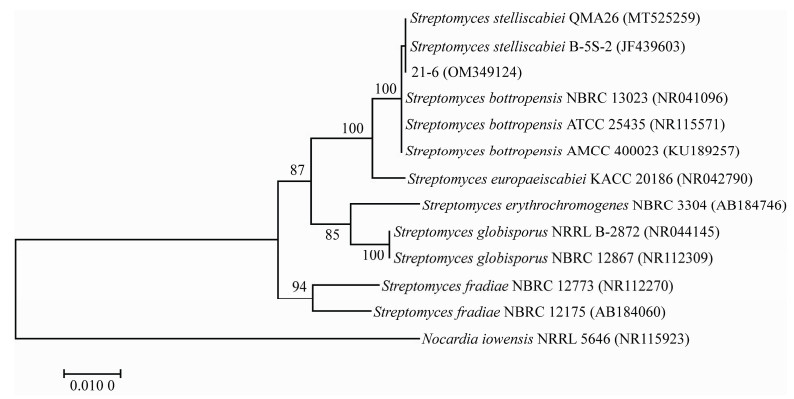
以菌株21-6基因组DNA为模板,利用通用引物对其16S rRNA基因序列进行扩增和测序,获得长度为1 399 bp的序列,并提交至GenBank数据库,登录号为OM349124。在NCBI数据库中经BLAST比对后,发现菌株21-6的16S rRNA基因序列与S. stelliscabiei和波卓链霉菌(S. bottropensis)等多个菌株的16S rRNA基因序列相似度在99%以上。进一步选择部分链霉菌菌株的16S rRNA基因序列,利用MEGA 7.0软件中的邻接法构建系统发育树。结果表明,菌株21-6与S. stelliscabiei QMA26及B-5S-2聚类在一起,处于一个分支(图 3)。结合形态和生理生化特征,将菌株21-6鉴定为S. stelliscabiei。
|
| 图 3 基于16S rRNA基因序列构建的菌株21-6及相关菌株的系统发育树 Figure 3 Phylogenetic tree of strain 21-6 and related strains based on 16S rRNA gene sequences. 分支处数值表示bootstrap值;括号内数值为GenBank登录号;标尺代表进化距离 Numbers at branch nodes present bootstrap value; Numbers in parentheses are GenBank accession numbers; Bar represents sequence divergence. |
|
|
利用PDB等5种不同培养基对菌株21-6分别进行培养并获得无菌发酵液。结果显示,PDB培养基获得的无菌发酵液抑制作用最强,抑菌率可以达到80%以上;其次为YG培养基,无菌发酵液的抑菌率为40%左右;而高氏一号、KMB及发酵培养基所获无菌发酵液抑菌活性很低,分别为3.0%±1.5%、3.5%±0.9%和11.6%±0.9% (图 4)。由此说明,菌株21-6抑菌物质的产生受到培养基类型的影响,其中PDB培养基可以更好地诱导该菌株产生抑菌物质。
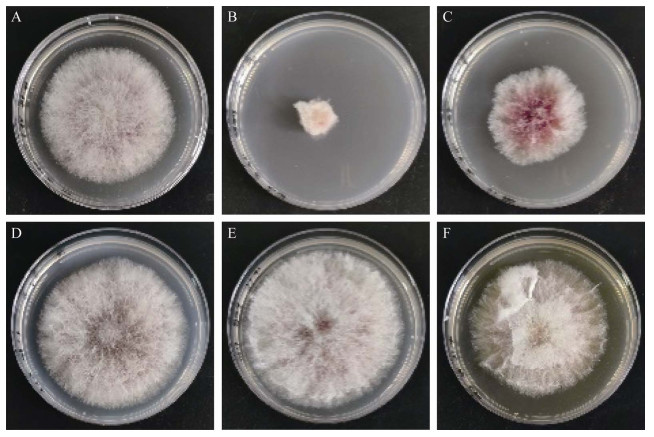
|
| 图 4 不同培养基获得的菌株21-6无菌发酵液对禾谷镰刀菌的影响 Figure 4 Effects of strain 21-6 cell-free fermentation broth in different medium against F. graminearum. A:对照;B:PDB培养基;C:YG培养基;D:高氏一号液体培养基;E:KMB培养基;F:发酵培养基 A: CK; B: PDB medium; C: YG medium; D: Gao's No. 1 medium; E: KMB medium; F: Fermentation medium. |
|
|
菌株21-6在PDB培养基中培养2 d时,无菌发酵液抑菌率最低,只有3%左右。随着培养时间延长,抑菌率快速上升,5 d时可以达到80%以上;之后抑菌率又有所下降,到7 d时下降为60%左右(图 5A)。在不同初始pH的条件下培养,菌株21-6无菌发酵液的抑菌活性受酸碱度影响明显,只有在pH值为7.0条件下,抑菌率才能保持在80%左右,而酸性和碱性条件下抑菌率不超过2% (图 5B)。由此说明,菌株21-6适合的发酵时间为5 d,pH条件为中性。
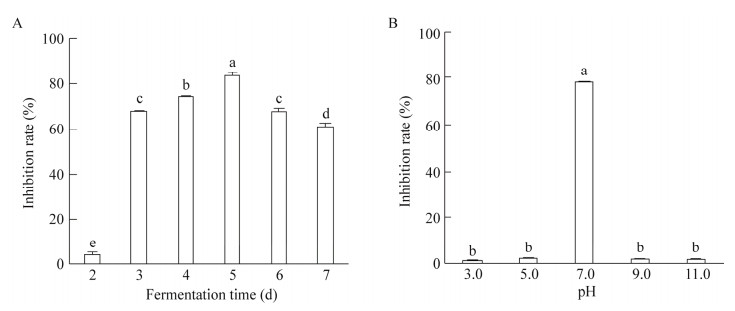
|
| 图 5 不同发酵条件下菌株21-6无菌发酵液的抑菌率 Figure 5 Inhibition rate of strain 21-6 cell-free fermentation broth under different conditions. A:发酵时间;B:酸碱度。柱上不同小写字母表示差异显著 A: Fermentation time; B: Acidity and alkakinity. Different lowercase letters on the bars indicate significant difference. |
|
|
在10%体积分数的菌株21-6无菌发酵液存在的条件下,禾谷镰刀菌菌丝生长受到抑制的同时,部分菌丝原生质外渗、菌丝变空(图 6)。此外,不同体积分数的菌株21-6无菌发酵液都可以影响禾谷镰刀菌的孢子萌发过程,体积分数为10%时,孢子的萌发率降低到20%,抑制率近80%;当体积分数提高到50%时,孢子的萌发率下降到1%左右(表 1)。

|
| 图 6 菌株21-6无菌发酵液对禾谷镰刀菌菌丝生长的影响 Figure 6 Effects of strain 21-6 cell-free fermentation broth on mycelial growth of F. graminearum. A:对照;B:菌株21-6处理 A: CK; B: Treated by strain 21-6. |
|
|
| 项目Item | 体积分数Volume ratio (%) | ||
| 10 | 20 | 50 | |
| 萌发率 Germination rate (%) |
20.0±2.0a | 10.7±1.2b | 1.3±1.2c |
| 抑制率 Inhibition rate (%) |
79.6±2.5c | 89.1±1.0b | 98.6±1.2a |
| 注:表中不同小写字母表示在P < 0.05水平差异显著 Note: Different lowercase letters in the same column indicate significant difference at P < 0.05. |
|||
菌株21-6无菌发酵液经40−80 ℃处理30 min后,相对抑菌率都在90%以上;100 ℃处理后相对抑菌率仍然保持在88%左右(图 7A),说明无菌发酵液中的抑菌活性物质具有较好的热稳定性。如图 7B所示,当pH值为7.0时无菌发酵液的相对抑菌率最高,为97%左右;在酸性条件下,即pH值分别为3.0和5.0时相对抑菌率仍保持在90%以上;随着pH值的升高,相对抑菌率显著降低,pH值为11.0时相对抑菌率仅为15%左右,由此说明抑菌活性物质耐酸却不耐碱。分别用胃蛋白酶、胰蛋白酶及蛋白酶K对无菌发酵液进行处理,相对抑菌率未出现明显变化(图 7C),表明抑菌活性物质对供试蛋白酶不敏感。
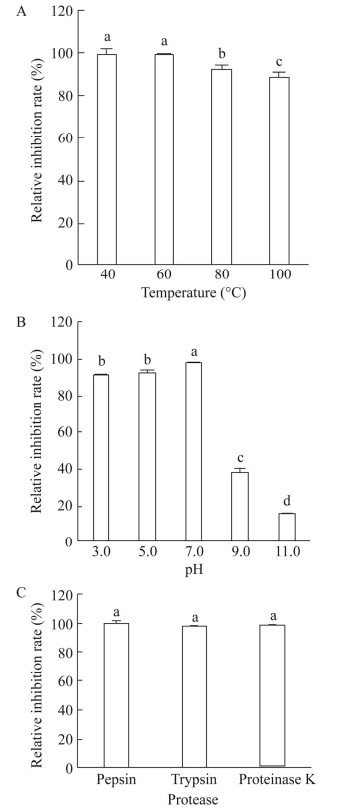
|
| 图 7 不同条件下菌株21-6无菌发酵液的稳定性 Figure 7 Antifungal stability of strain 21-6 cell-free fermentation broth under different conditions. A:温度;B:酸碱度;C:蛋白酶. 柱上不同小写字母表示在P < 0.05水平差异显著 A: Temperature; B: Acidity and alkakinity; C: Protease types. Different lowercase letters on the bars indicate significant difference at P < 0.05 level. |
|
|
致病力结果显示,只接种禾谷镰刀菌的对照组小麦胚芽鞘出现褐色病斑,而用菌株21-6不同浓度发酵液处理后再接种病原菌的小麦胚芽鞘仅在切口处变成褐色,病斑无明显扩展(图 8)。说明菌株21-6对禾谷镰刀菌侵染小麦胚芽鞘具有一定的抑制作用。

|
| 图 8 菌株21-6对禾谷镰刀菌侵染小麦胚芽鞘的抑制效果 Figure 8 Control effects of strain 21-6 against wheat coleoptiles of F. graminearum. A:对照;B:发酵液原液;C:发酵液10倍稀释液;D:发酵液50倍稀释液 A: CK; B: Fermentation broth; C: Fermentation broth 10-fold; D: Fermentation broth 50-fold. |
|
|
PCR扩增结果显示,菌株21-6中能够检测到pks-Ⅰ和pks-Ⅱ基因,说明该菌株具有以上2种合成酶相关基因,并产生相关的抗菌物质(图 9)。
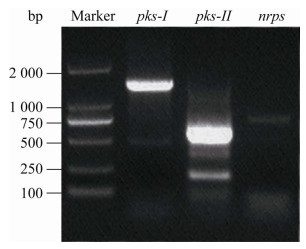
|
| 图 9 菌株21-6的pks-Ⅰ、pks-Ⅱ及nrps基因的PCR扩增 Figure 9 PCR amplification results of pks-Ⅰ, pks-Ⅱ and nrps sequences of strain 21-6. |
|
|
为验证菌株21-6对禾谷镰刀菌以外的其他植物病原真菌的抑制作用,皿内对峙结果表明,菌株21-6对大斑凸脐蠕孢和瓜类炭疽病菌的抑制作用最强,抑菌带宽在11 mm左右;其次为层出镰刀菌和假禾谷镰刀菌,抑菌带宽为8 mm左右;而对尖孢镰刀菌的抑制能力最低,抑菌带宽在2 mm以下(表 2)。
| 植物病原菌 Plant pathogenes |
抑菌带宽度 Inhibition zone (mm) |
| 瓜类炭疽病菌 Colletorichum lagenerium |
10.8±1.5a |
| 大斑凸脐蠕孢 Exserohilum turcicum |
11.3±1.3a |
| 尖孢镰刀菌 Fusarium oxysporum |
1.5±0.6d |
| 层出镰刀菌 F. proliferatum |
8.3±2.5b |
| 假禾谷镰刀菌 F. pseudograminearum |
7.5±1.3c |
| 注:数据后不同小写字母表示在P < 0.05水平差异显著 Note: Different lowercase letters in the same column indicate significant difference at P < 0.05. |
|
链霉菌是一类重要的植物病害生物防治微生物,筛选能够有效拮抗禾谷镰刀菌的链霉菌,对禾谷镰刀菌所致病害的生物防治具有重要意义。本研究分离筛选到一株对禾谷镰刀菌具有较好抑制效果的链霉菌21-6,经形态学、生理生化特征及16S rRNA基因序列分析后,将该菌株鉴定为S. stelliscabiei。有研究指出,S. stelliscabiei为马铃薯疮痂病病原之一[23],而本研究发现菌株21-6对禾谷镰刀菌具有一定的生防能力。与此类似,波卓链霉菌CH8-6对禾谷镰刀菌等病原真菌具有抑制能力[24],而波卓链霉菌同样也是马铃薯疮痂病的另一种病原[25]。
生防菌发酵条件的优化对降低生产成本、发挥生产力具有重要意义。瞿佳等[26]在确定暗蓝色链霉菌(S. caeruleatus) WMF106最佳发酵培养基的基础上,又对起始pH、接种量、装液量、发酵时间、发酵温度和转速等因素进行了分析,并获得了最佳发酵条件。另外,研究者们[27-28]也分别对桑树链霉菌(S. samsunensi) 17-7及海洋链霉菌HS-B31的物质组分及发酵条件进行研究。本研究发现菌株21-6在PDB培养基中培养后无菌发酵液的抑菌能力较好,并且适合的培养时间为5 d,pH值为7.0。因此,下一步还将对菌株21-6发酵培养基组分及其他发酵条件进行探索。
生防菌能否应用于生产与其稳定性密切相关,李晓春等[29]对淡紫褐链霉菌(S. enissocaesilis) SA37稳定性研究发现,其发酵液在70 ℃以上的酸性和碱性条件下抑菌活性明显降低。吕昂等[30]研究发现,链霉菌3-10发酵液对80 ℃以上高温的碱性条件敏感。然而本研究发现,菌株21-6无菌发酵液经100 ℃处理后相对抑菌率可在88%左右,在pH为中性和酸性条件下的相对抑菌率都在90%以上,并且对胃蛋白酶等3种酶的处理不敏感。由此说明,菌株21-6无菌发酵液稳定性较好,具有应用于生产的潜力。
抑菌机理研究表明,链霉菌能够干扰病原真菌细胞膜麦角甾醇合成并增强细胞膜脂质过氧化程度,从而改变病原真菌细胞膜通透性,导致细胞内含物外渗并出现死亡[31-32]。本研究中菌株21-6的无菌发酵液能够导致禾谷镰刀菌部分菌丝原生质外渗、变空,并抑制孢子的萌发过程。在活性物质研究方面,链霉菌主要通过聚酮合酶和非核糖体多肽合成酶途径合成活性物质[33]。如:白刺链霉菌(S. albospinus) NLG-3具有nrps和pks关键基因[34];刘洋等[35]从抗生链霉菌(S. antibioticus) NRRL 8167的发酵提取物中分离到一个聚酮类化合物naphthgeranine A。本研究在菌株21-6中也检测到pks-Ⅰ和pks-Ⅱ基因,推测其有合成相关活性物质的潜力。因此,菌株21-6的抑菌机理及活性物质种类还有待后续研究。
| [1] |
Cheng SH, Zhang Y, Bie TD, Gao DR, Zhang BQ. Damage of wheat Fusarium head blight (FHB) epidemics and genetic improvement of wheat for scab resistance in China[J]. Jiangsu Journal of Agricultural Sciences, 2012, 28(5): 938-942. (in Chinese) 程顺和, 张勇, 别同德, 高德荣, 张伯桥. 中国小麦赤霉病的危害及抗性遗传改良[J]. 江苏农业学报, 2012, 28(5): 938-942. |
| [2] |
Chen Y, Wang JQ, Yang RM, Ma ZH. Current situation and management strategies of Fusarium head blight in China[J]. Plant Protection, 2017, 43(5): 11-17. (in Chinese) 陈云, 王建强, 杨荣明, 马忠华. 小麦赤霉病发生危害形势及防控对策[J]. 植物保护, 2017, 43(5): 11-17. DOI:10.3969/j.issn.0529-1542.2017.05.002 |
| [3] |
Huang C, Jiang YY, Wu JW, Qiu K, Yang JJ. Occurrence characteristics and reason analysis of wheat head blight in 2018 in China[J]. Plant Protection, 2019, 45(2): 160-163. (in Chinese) 黄冲, 姜玉英, 吴佳文, 邱坤, 杨俊杰. 2018年我国小麦赤霉病重发特点及原因分析[J]. 植物保护, 2019, 45(2): 160-163. |
| [4] |
Zhang XX, Sun HY, Li W, Deng YY, Zhang AX, Yu HS, Chen HG. Composition and pathogenicity of Fusarium crown rot pathogens of wheat in major winter wheat production areas of China[J]. Journal of Triticeae Crops, 2014, 34(2): 272-278. (in Chinese) 张向向, 孙海燕, 李伟, 邓渊钰, 张爱香, 于汉寿, 陈怀谷. 我国冬小麦主产省小麦茎基腐镰孢菌的组成及其致病力[J]. 麦类作物学报, 2014, 34(2): 272-278. |
| [5] |
Audenaert K, Vanheule A, Höfte M, Haesaert G. Deoxynivalenol: a major player in the multifaceted response of Fusarium to its environment[J]. Toxins, 2013, 6(1): 1-19. DOI:10.3390/toxins6010001 |
| [6] |
Chen Y, Wang J, Yang N, Wen Z, Sun X, Chai Y, Ma Z. Wheat microbiome bacteria can reduce virulence of a plant pathogenic fungus by altering histone acetylation[J]. Nature Communications, 2018, 9: 3429. DOI:10.1038/s41467-018-05683-7 |
| [7] |
Chen WH, Yin XC, Wu DL, Xu JH, Zhao FC, Yang ZY, Shi JR. Research progress on biological control of Fusarium head blight[J]. Jiangsu Agricultural Sciences, 2020, 48(4): 12-18. (in Chinese) 陈文华, 殷宪超, 武德亮, 徐剑宏, 赵凤春, 杨正友, 史建荣. 小麦赤霉病生物防治研究进展[J]. 江苏农业科学, 2020, 48(4): 12-18. |
| [8] |
Solecka J, Zajko J, Postek M, Rajnisz A. Biologically active secondary metabolites from actinomycetes[J]. Central European Journal of Biology, 2012, 7(3): 373-390. |
| [9] |
Xue YY, Li FK, Li P, Zhao N, Xu BL. Screening and identification of antagonistic actinomycetes JPD-1 against the pathogen Valsa mali[J]. Journal of Plant Protection, 2020, 47(1): 134-142. (in Chinese) 薛应钰, 李发康, 李培, 赵娜, 徐秉良. 苹果树腐烂病菌拮抗放线菌JPD-1的筛选及鉴定[J]. 植物保护学报, 2020, 47(1): 134-142. |
| [10] |
Ruan HC, Shi NN, Du YX, Chen FR. Screening and control effect of rare antagonistic actinomycetes against rice blast[J]. Chinese Journal of Biological Control, 2021, 37(3): 538-546. (in Chinese) 阮宏椿, 石妞妞, 杜宜新, 陈福如. 水稻稻瘟病拮抗稀有放线菌的筛选及防治效果[J]. 中国生物防治学报, 2021, 37(3): 538-546. |
| [11] |
Qian Y, Pan YY, Li EW, Jia HH, Wei YM, Liu G. Classification of Streptomyces sp. IMS002 and identification of its antifungal metabolite[J]. Acta Microbiologica Sinica, 2020, 60(1): 60-68. (in Chinese) 钱瑶, 潘园园, 李二伟, 贾慧慧, 魏艳敏, 刘钢. 链霉菌IMS002的分类鉴定及其抗真菌活性物质解析[J]. 微生物学报, 2020, 60(1): 60-68. |
| [12] |
Peng Y, Li SX, Yu Z, Tang ML, Wu HX, Chen YY, Wang YN, Ma GZ, Bao ZH. Identification and growth promoting effect of a marine actinomycete[J]. Microbiology China, 2020, 47(11): 3515-3526. (in Chinese) 彭云, 李舒馨, 俞泽, 汤曼利, 吴海霞, 陈莹莹, 王亚楠, 马桂珍, 暴增海. 一株海洋放线菌的鉴定及其促生作用机理[J]. 微生物学通报, 2020, 47(11): 3515-3526. |
| [13] |
Palazzini J, Roncallo P, Cantoro R, Chiotta M, Yerkovich N, Palacios S, Echenique V, Torres A, Ramírez M, Karlovsky P, et al. Biocontrol of Fusarium graminearum sensu stricto, reduction of deoxynivalenol accumulation and phytohormone induction by two selected antagonists[J]. Toxins, 2018, 10(2): 88. |
| [14] |
He JD. Study on the identification and antifungal of biocontrol Streptomyces against Fusarium graminearum[D]. Wuhan: Master's Thesis of Huazhong Agricultural University, 2015 (in Chinese) 何敬德. 禾谷镰刀菌生防链霉菌的鉴定与抑菌作用研究[D]. 武汉: 华中农业大学硕士学位论文, 2015 |
| [15] |
Kou CK. Isolation of antagonistic bacteria against Fusarium graminearum, identification of antagonistic substances and biocontrol application[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2017 (in Chinese) 寇程坤. 赤霉病菌拮抗菌分离、拮抗物质鉴定及生防应用[D]. 南京: 南京农业大学硕士学位论文, 2017 |
| [16] |
Zhang J, Chen J, Hu LF, Jia RM, Ma Q, Tang JJ, Wang Y. Antagonistic action of Streptomyces pratensis S10 on Fusarium graminearum and its complete genome sequence[J]. Environmental Microbiology, 2021, 23(4): 1925-1940. |
| [17] |
Li YL, Wang YH, Zhou Z, Qu LJ. Identification and optimization of fermentation conditions and antibacterial activity of endophytic Streptomyces rochei A-m1 from the branch of Malus sieversii[J]. Scientia Silvae Sinicae, 2020, 56(7): 70-81. (in Chinese) 李永丽, 王亚红, 周洲, 曲良建. 新疆野苹果内生娄彻氏链霉菌A-m1的鉴定和发酵条件优化及抑菌广谱作用[J]. 林业科学, 2020, 56(7): 70-81. |
| [18] |
Tang YP. Isolation and identification of antifungal actinomycetes from soil and study on the bioactivity for anti-Magnaporthe grisea[D]. Wuhan: Master's Thesis of South-Central University for Nationalities, 2010 (in Chinese) 唐颜苹. 抗真菌放线菌的分离和鉴定及抗稻瘟病病菌生物活性的研究[D]. 武汉: 中南民族大学硕士学位论文, 2010 |
| [19] |
Zhang YR, Huo YF, Shi HL, Zhang Q. Identification and antifungal activity of antagonistic bacteria ZQT-9 against Fusarium graminearum[J]. Jiangsu Agricultural Sciences, 2021, 49(18): 111-115. (in Chinese) 张艳茹, 霍云凤, 石红利, 张强. 禾谷镰刀菌拮抗菌ZQT-9的鉴定与抑菌活性[J]. 江苏农业科学, 2021, 49(18): 111-115. |
| [20] |
Ruan JS, Huang Y. Rapid Identification and Systematics of Actinobacteria[M]. Beijing: Science Press, 2011.
|
| [21] |
Ayuso-Sacido A, Genilloud O. New PCR primers for the screening of NRPS and PKS-I systems in actinomycetes: detection and distribution of these biosynthetic gene sequences in major taxonomic groups[J]. Microbial Ecology, 2005, 49(1): 10-24. |
| [22] |
Guan TW, Teng Y, Ren D, Liu SQ, Jiang HM, Zhao HP, Dong D, Zhang XP. Diversity and PKS Ⅱ genes on the cultured actinobacterial in Lop Nur[J]. Biotechnology, 2014, 24(5): 67-71. (in Chinese) 关统伟, 滕芸, 任丹, 刘松青, 江华明, 赵辉平, 董丹, 张小平. 罗布泊盐湖可培养放线菌多样性及PKS Ⅱ功能基因筛选[J]. 生物技术, 2014, 24(5): 67-71. |
| [23] |
Jiang HH, Meng QX, Hanson LE, Hao JJ. First report of Streptomyces stelliscabiei causing potato common scab in Michigan[J]. Plant Disease, 2012, 96(6): 904. |
| [24] |
Ning CH, Li WB, Zhang C, Liu RJ. Isolation and identification of antagonizing and growth-promoting actinobacteria colonized in plant roots and rhizosphere[J]. Microbiology China, 2019, 59(10): 2024-2037. (in Chinese) 宁楚涵, 李文彬, 张晨, 刘润进. 定殖植物根内和根围放线菌的分离鉴定及其体外抑菌促生效应[J]. 微生物学报, 2019, 59(10): 2024-2037. |
| [25] |
Zhang QY. Isolation, identification and diversity of pathogens of potato common scab in some areas of Gansu province[D]. Jinan: Master's Thesis of Shandong Agricultural University, 2019 (in Chinese) 张庆勇. 甘肃省部分地区马铃薯疮痂病病原菌的分离鉴定及其多样性研究[D]. 济南: 山东农业大学硕士学位论文, 2019 |
| [26] |
Qu J, Sun XY, Chen R, Men X, Zhao LX, Ning SY. Optimization of fermentation conditions and stability evaluation of antimicrobial active substance for antagonistic actinomycete WMF106 against walnut blight[J]. Microbiology China, 2022, 49(1): 88-100. (in Chinese) 瞿佳, 孙晓宇, 陈锐, 门欣, 赵玲侠, 宁硕瀛. 核桃黑斑病拮抗放线菌WMF106发酵条件优化和抑菌物质稳定性[J]. 微生物学通报, 2022, 49(1): 88-100. |
| [27] |
Liu YX, Shi YP, Dai LM, Li LL, Cai ZY. Screening, identification and fermentation optimization of an antimicrobial actinomycete strain 17-7 to Phellinus noxius[J]. Microbiology China, 2020, 47(1): 118-129. (in Chinese) 刘一贤, 施玉萍, 戴利铭, 李岚岚, 蔡志英. 橡胶褐根病拮抗放线菌17-7的筛选、鉴定及发酵条件优化[J]. 微生物学通报, 2020, 47(1): 118-129. |
| [28] |
Xue YD, Cong LN, Li RF. Optimization of fermentation conditions and separation of active substances in marine Streptomyces HS-B31[J]. Journal of Dalian Polytechnic University, 2020, 39(4): 245-249. (in Chinese) 薛一达, 丛丽娜, 李若凡. 海洋链霉菌HS-B31发酵条件优化及活性物质分离纯化[J]. 大连工业大学学报, 2020, 39(4): 245-249. |
| [29] |
Li XC, Wang ZH, Yu ZG, Xi XD. Isolation of antagonistic rare actinomycetes against Botrytis cinerea and analysis of antifungal substances[J]. Journal of Henan Agricultural Sciences, 2019, 48(2): 83-90. (in Chinese) 李晓春, 王泽昊, 于志国, 席雪冬. 番茄灰霉病菌拮抗稀有放线菌的分离及其抑菌物质分析[J]. 河南农业科学, 2019, 48(2): 83-90. |
| [30] |
Lü A, Wu MD, Zhang J, Yang L, Li GQ. Stability of cultural filtrate and crude extract produced by Streptomyces sp. 3-10[J]. Chinese Journal of Biological Control, 2022, 38(1): 250-257. (in Chinese) 吕昂, 吴明德, 张静, 杨龙, 李国庆. 链霉菌3-10发酵液及提取物的稳定性研究[J]. 中国生物防治学报, 2022, 38(1): 250-257. |
| [31] |
Zhang SW, Liu Q, Yang Y, Zhu YB, Zhang Y, Li KT. A study on antagonistic mechanism of Streptomyces corchorusii strain AUH-1 against Rhizoctonia solani[J]. Acta Agriculturae Universitatis Jiangxiensis, 2019, 41(6): 1048-1053. (in Chinese) 章帅文, 刘群, 杨勇, 朱元斌, 张勇, 李昆太. 黄麻链霉菌AUH-1拮抗水稻纹枯病菌的作用机制研究[J]. 江西农业大学学报, 2019, 41(6): 1048-1053. |
| [32] |
Deng YJ. Antifungial mechanism and preliminary separation of antimicrobial substances of actinomycetes JY-22[D]. Chongqing: Master's Thesis of Southwest University, 2017 (in Chinese) 邓永杰. 放线菌JY-22抑菌机理及抑菌物质初步分离[D]. 重庆: 西南大学硕士学位论文, 2017 |
| [33] |
Wang H, Liu N, Huang Y. Phylogenomic analysis of modular polyketide synthases in actinomycetes and its application in product screening[J]. Acta Microbiologica Sinica, 2010, 50(10): 1293-1304. (in Chinese) 王浩, 刘宁, 黄英. 放线菌模块型聚酮合酶的系统发育组学分析及其在聚酮类化合物筛选中的应用[J]. 微生物学报, 2010, 50(10): 1293-1304. |
| [34] |
Zhang SY, Chen YF, Luo YP, Wang LY. Antibacterial activity and identification of epiphytic actinomycete NLG-3 from Galaxea facicularis[J]. Journal of Northwest A & F University: Natural Science Edition, 2019, 47(10): 97-105. (in Chinese) 张斯颖, 陈宇丰, 骆焱平, 王兰英. 丛生盔形珊瑚共附生放线菌NLG-3的抑菌活性及鉴定[J]. 西北农林科技大学学报(自然科学版), 2019, 47(10): 97-105. |
| [35] |
Liu Y, Wang XZ, Huang TT, Zhou ZH, Lin SJ. Analysis and identification of the naphthgeranine A biosynthetic gene cluster from Streptomyces antibioticus NRRL 8167[J]. Microbiology China, 2019, 46(10): 2645-2656. (in Chinese) 刘洋, 王晓政, 黄婷婷, 周子画, 林双君. 链霉菌Streptomyces antibioticus NRRL 8167中Naphthgeranine A生物合成基因簇的分析鉴定[J]. 微生物学通报, 2019, 46(10): 2645-2656. |
 2022, Vol. 49
2022, Vol. 49