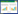扩展功能
文章信息
- 王雪荣, 孙悦
- WANG Xuerong, SUN Yue
- 商业酵母在不同品种葡萄酒工业化生产中的定殖差异
- Comparing the implantation and persistence of inoculated active dry yeast in different industrial wine fermentations
- 微生物学通报, 2022, 49(1): 189-201
- Microbiology China, 2022, 49(1): 189-201
- DOI: 10.13344/j.microbiol.china.210457
-
文章历史
- 收稿日期: 2021-05-21
- 接受日期: 2021-07-08
- 网络首发日期: 2021-08-27
近20年来,我国葡萄酒产业迅速发展,宁夏贺兰山东麓葡萄酒产区以“明星产区”和“新兴国产区”打入了国际葡萄酒平台。2003年,宁夏贺兰山东麓葡萄酒产区通过“葡萄酒国家地理标志产品”保护区认证,成为业界公认的世界上最适合种植酿酒葡萄和生产高端葡萄酒的产区之一[1]。该产区位于贺兰山东麓洪积倾斜平原与黄河冲击平原交汇地带,在自然选择的作用下形成了丰富多样的酵母菌群落[2-6]。这些酵母菌代谢特征独特,通过筛选具有优良发酵特性和酿造特性的宁夏本土酵母如葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)[7]、美极梅奇酵母(Metschnikowia pulcherrima)[7]、克鲁维毕赤酵母(Pichia kluyveri)[8]、酿酒酵母(Saccharomyces cerevisiae)[9-10]等有望生产地域特色的葡萄酒,提升贺兰山东麓葡萄酒品质。
酵母菌在葡萄酒酿造过程中起重要的作用。酵母菌是酒精发酵阶段的主要微生物。工业生产中大都通过添加商业活性干酵母(active dry yeast,ADY)进行葡萄酒酿造,因此,葡萄酒的酿造过程由野生酿酒酵母和商业酵母的不同株系共同完成[11]。研究表明,ADY在发酵中并不都占据主导地位,酵母菌菌株特性及发酵工艺影响其在葡萄酒工业生产中的定殖情况[12-15]。ADY对我国本土酵母菌资源的影响及二者的竞争关系,尤其是不同葡萄品种接种发酵过程中商业酿酒酵母的竞争能力情况,目前尚无全面、系统的研究。因此,进行宁夏葡萄酒产区ADY在发酵中的竞争能力研究及对其功能的解析意义重大、任务紧迫。分子生物学技术的发展为酿酒酵母的菌株区分提供了方法支撑,Interdelta指纹图谱法操作简便、经济节约,适用于酿酒酵母菌株的区分[6, 16-17];微卫星标记(simple sequence repeat,SSR)作为一种经典的分子标记方法,因其高度的多态性、呈孟德尔共显性遗传、稳定性好等优点,在微生物群体的遗传与分化研究中得到了很好的应用[18]。同时,微卫星标记具有多态性丰富、检测快速方便和结果稳定可靠等优点,也非常适合对酵母进行菌株区分、分类鉴定[19]。
商业酵母SP是世界上最早育种的优良酿酒酵母品种之一,适用于口感丰满、圆润的果香类红葡萄酒的生产,SP具有快速植入能力,其挥发酸产量低,与乳酸菌也有良好的兼容性。因此,该酵母在宁夏贺兰山东麓葡萄酒产区应用较为广泛。基于此,本研究以宁夏产区赤霞珠、马瑟兰、紫代夫和小味儿多4个葡萄品种为原料,分别接种商业酵母SP进行工业发酵,对其发酵的3个不同时期进行酿酒酵母的分离,利用Interdelta指纹图谱鉴定和聚类分析,并结合微卫星标记法分析不同酿酒酵母的遗传多样性,从而揭示商业酵母与本土酿酒酵母间的竞争关系,为酿酒工艺的优化和商业酿酒酵母的选择,以及本土优良酿酒酵母资源的开发提供参考与依据。
1 材料与方法 1.1 材料 1.1.1 葡萄原料宁夏贺兰山东麓产区2018年赤霞珠、马瑟兰、紫代夫和小味儿多这4个葡萄品种。
1.1.2 商业酵母商业酵母为法国诺盟公司Excellence® SP。
1.1.3 培养基和主要试剂、仪器YEPD培养基(Yeast Extract Peptone Dextrose Medium)、WLN营养琼脂培养基(Wallerstein Laboratory Nutrient Agar Medium),青岛高科技工业园海博生物技术有限公司;dNTPs、TransTaq HiFi DNA Polymerase,生工生物工程(上海)股份有限公司。恒温培养箱、生化培养箱,常州诺基仪器有限公司;全自动凝胶成像仪,北京赛智创业科技有限公司;PCR仪,耶拿分析仪器股份公司。
1.2 方法 1.2.1 发酵及取样宁夏贺兰山东麓产区2018年葡萄品种赤霞珠(总糖245.7 g/L,总酸4.7 g/L)、马瑟兰(总糖256.4 g/L,总酸3.9 g/L)、紫代夫(总糖186.7 g/L,总酸6.9 g/L)、小味儿多(总糖238.1 g/L,总酸4.1 g/L)的发酵体积均为700 L,于接种后的1、3、5 d取样。如图 1所示,发酵工艺按照干红葡萄酒进行。
|
| 图 1 干红葡萄酒发酵工艺流程图 Figure 1 Flow chart of the fermentation process of dry red wine. |
|
|
将采集的酒样进行梯度稀释,通常稀释至10−4−10−7,于WLN营养培养基上进行平板涂布,28 ℃培养5−7 d后观察菌落颜色及形态,以商业酵母SP为对照,根据菌落颜色和形态随机挑取20个酿酒酵母单菌落(共计240个)。在WLN营养培养基上纯化后,于YPD液体培养基中28 ℃、150 r/min活化1 d,与40%的无菌甘油以1:1 (体积比)混合于1.5 mL离心管中,−80 ℃保藏备用。
1.2.3 酵母菌DNA提取酵母菌DNA的提取方法及酿酒酵母的鉴定参考文献[6]。
1.2.4 Interdelta扩增使用优化引物delta12 (5′-TCAACAATGGA ATCCCAAC-3′)和delta21 (5′-CATCTTAACACC GTATATGA-3′)进行PCR扩增[20]。PCR反应体系:10×HiFi Buffer Ⅰ 2.5 μL,delta12 (1 μmol/L) 0.5 μL,delta21 (1 μmol/L) 0.5 μL,dNTPs (2.5 mmol/L) 2 μL,TransTaq HiFi DNA Polymerase (5 U/μL) 0.25 μL,模板DNA 1 μL,ddH2O 18.25 μL。PCR反应条件:94 ℃ 2 min;94 ℃ 30 s,46 ℃ 30 s,72 ℃ 90 s,35次循环;72 ℃ 10 min。PCR产物在2%琼脂糖凝胶上电泳,然后在凝胶成像仪上观察、照相。
1.2.5 Interdelta数据处理与聚类分析对Interdelta序列的PCR电泳图谱进行统计分析,将特定位置上DNA条带的有和无分别按“1”和“0”进行统计,建立数据矩阵,利用NTsys 2.10e版软件进行类平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类分析[6]。
1.2.6 酿酒酵母菌株SSR分型分析选取9个多态性好的微卫星位点进行SSR分型分析,供试样本送至生工生物工程(上海)股份有限公司进行毛细管电泳分析[21]。所得数据利用PopGene 32软件分析酿酒酵母群体的9个微卫星位点上的观测杂合度(Ho)、期望杂合度(He);利用PowerMarker分析酿酒酵母的等位基因数及各微卫星位点的多态信息含量(polymorphism information contents,PIC);利用NTsys2.0e软件构建基于每对菌株的Jaccard相似性系数的非加权算术平均数(UPGMA)系统发育树。
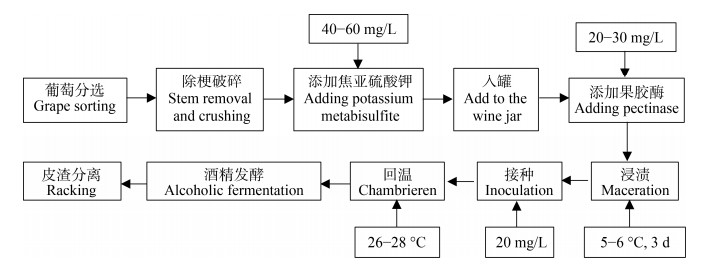
2 结果与分析 2.1 Interdelta指纹图谱鉴定4个发酵中酿酒酵母菌株多样性从宁夏贺兰山东麓葡萄酒产区的赤霞珠、马瑟兰、紫代夫和小味儿多4个葡萄品种工业生产中共分离到240个酿酒酵母单菌落,Interdelta指纹图谱法将其分为24种基因型即24株酿酒酵母,商业酵母SP本身显示出4种基因型为SP1−SP4,本土酵母显示出20种基因型为Type1−Type20 (图 2)。上述24株酿酒酵母菌株的聚类分析树形图及与其对应的Interdelta指纹图谱如图 2所示。在类平均法聚类分析中,菌株相似度越接近1.00,说明其亲缘关系越近,供试菌株之间的Jaccard相似系数均在0.15以上。将相似度大于0.29的具有一定亲缘关系的菌株分为一类,则共可将24株供试菌株分为14大类。其中,分离自赤霞珠葡萄酒的酿酒酵母菌株SP1、Type1、Type3、Type4聚为一类,说明其亲缘关系较其他菌株更近,而分离自马瑟兰、紫代夫和小味儿多3个葡萄品种的酿酒酵母菌株都并未聚在一个分支,说明其亲缘关系较远,即分离自相同葡萄品种发酵中的酿酒酵母菌株间遗传差异性较大。
|
| 图 2 代表性酿酒酵母菌株的聚类分析树形图 Figure 2 Phylogenetic tree of representative Saccharomyces cerevisiae strains. |
|
|
SSR分析将上述24株酿酒酵母分为15种基因型,表明微卫星对酵母菌株的分型效果较Interdelta差。本研究中,9个微卫星位点均表现出较高的多态性,多态信息含量可以反映微卫星标记的多态性水平,度量群体内遗传变异的高低[22]。根据Botstein等[23]提出的PIC判断标准:当PIC < 0.25时,该位点为低度多态;当0.25 < PIC < 0.50时,为中度多态;当PIC > 0.50时,为高度多态。本研究中的9个位点PIC平均值为0.700 0,9个PIC都大于0.50,即每个位点都是高度多态性位点。9个微卫星位点共检测出50个等位基因,平均每个位点的等位基因数为5.555 6个,其中在C4位点上检测到9个等位基因,表现出较高的等位基因多样性,C5、SCYOR267C、YPL009C这3个位点均仅检测出4个等位基因,等位基因最少。杂合度是衡量酿酒酵母群体遗传变异情况的一个参数,杂合度越高说明群体的遗传多样性越高[18]。本研究中,9个位点的观测杂合度(Ho)值在0.600 0−1.000 0之间,平均值为0.753 3,期望杂合度(He)介于0.615 7−0.874 2之间,平均值为0.739 9 (表 1)。整体来看,供试的24株酿酒酵母具有较高的遗传多样性。
| 位点 Locus |
等位基因数 Alleles |
观测杂合度(Ho) Heterozygosity observed |
期望杂合度(He) Heterozygosity expected |
多态信息含量(PIC) Polymorphism information contents |
| C4 | 9 | 0.833 3 | 0.819 2 | 0.781 9 |
| C5 | 4 | 0.633 3 | 0.702 3 | 0.635 6 |
| C8 | 5 | 1.000 0 | 0.874 2 | 0.852 7 |
| C11 | 5 | 0.633 3 | 0.728 2 | 0.667 8 |
| C12 | 5 | 0.703 7 | 0.615 7 | 0.611 7 |
| SCAAT1 | 8 | 0.866 7 | 0.853 7 | 0.819 7 |
| SCAAT3 | 6 | 0.642 9 | 0.679 2 | 0.674 6 |
| SCYOR267C | 4 | 0.600 0 | 0.687 6 | 0.620 8 |
| YPL009C | 4 | 0.866 7 | 0.698 9 | 0.635 0 |
| Mean | 5.555 6 | 0.753 3 | 0.739 9 | 0.700 0 |
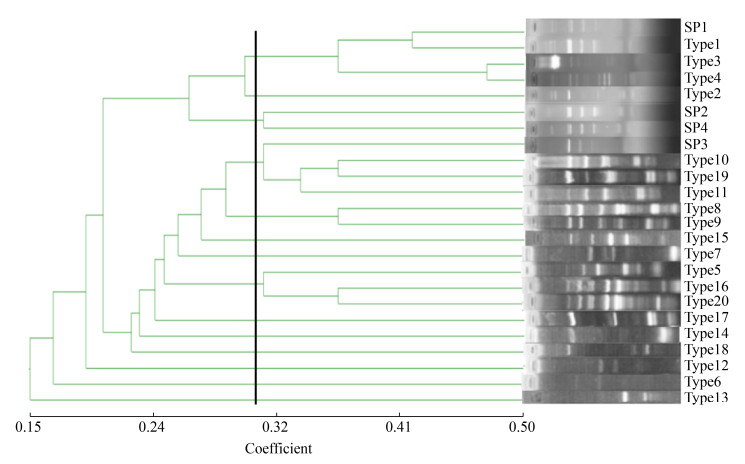
以菌株间的Jaccard相似系数构建20株本土酿酒酵母与4株商业酵母的聚类图(图 3),说明20株本土酿酒酵母与4株商业酵母的亲缘关系。从图 3中可以看出,Type1和Type2的菌株具有相同的基因型,Type3、Type10、Type11、Type15的菌株具有相同的基因型,Type12、Type13、Type14的菌株具有相同的基因型,Type20、SP1、SP2的菌株具有相同的基因型,Type17和Type19的菌株具有相同的基因型。

|
| 图 3 代表性酿酒酵母菌株的亲缘关系聚类图 Figure 3 Clustering diagram of genetic relationship of representative Saccharomyces cerevisiae strains. |
|
|
菌株之间的Jaccard相似系数越接近1,其亲缘关系越近。从图 3中可以看出,分离自相同葡萄品种发酵中的酿酒酵母菌株间遗传差异性较大。Type1、Type2 (SSR类型为L-1)与Type6(SSR类型为L-5)聚在一个分支,Type3、Type10、Type11、Type15 (SSR类型为L-2)与Type12、Type13、Type14 (SSR类型为L-9)聚在一个分支,Type20、SP1、SP2 (SSR类型为SP-1)与SP4 (SSR类型为SP-3)聚在一个分支,Type17、Type19 (SSR类型为L-11)与Type18 (SSR类型为L-12)聚在一个分支,说明其亲缘关系较近;如图 3所示,分离自赤霞珠葡萄酒发酵的商业酵母SP与本土酵母Type1、Type2、Type3、Type4 (SSR类型为L-1、L-2、L-3)菌株的亲缘关系较远;当Jaccard相似系数约为0.05时,分离自马瑟兰葡萄酒的基因型SP3、Type5、Type6、Type7、Type8、Type9、Type10、Type11 (SSR类型为SP-2、L-2、L-4、L-5、L-6、L-7、L-8)聚为一类,表明其亲缘关系较远;当Jaccard相似系数约为0.05时,分离自紫代夫葡萄酒的各个基因型Type5、Type7、Type12、Type13、Type14、Type15 (SSR类型为L-2、L-4、L-6、L-9)聚为一类,表明其亲缘关系较远;当Jaccard相似系数为0.04时,分离自紫代夫葡萄酒的各个基因型聚为一类,表明其亲缘关系最远。
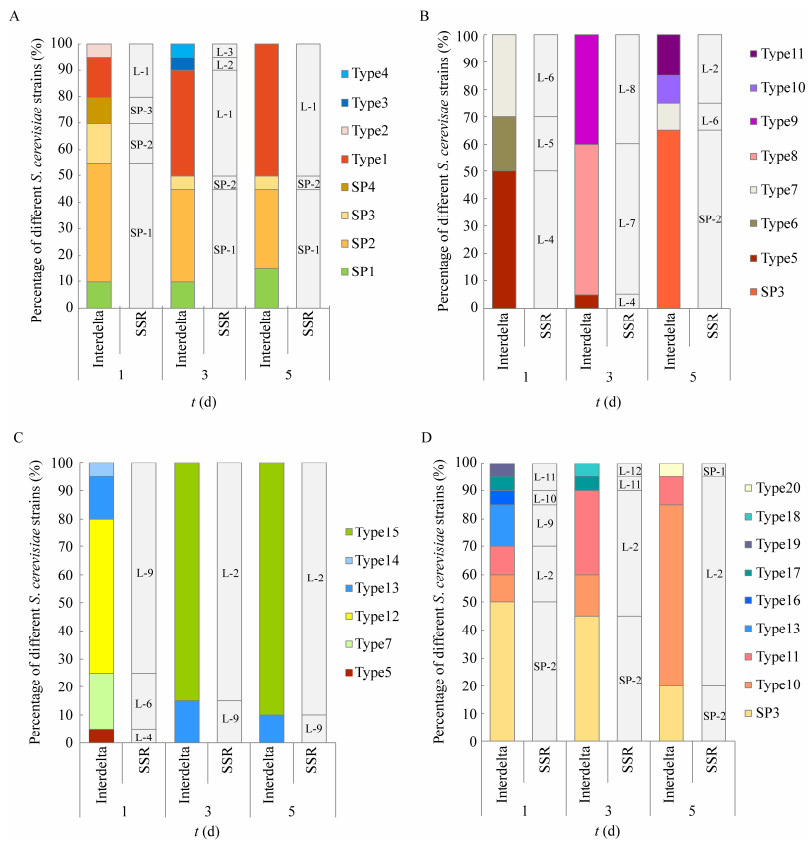
2.3 商业酵母SP的定殖情况如图 4所示,在接种商业酵母SP的赤霞珠、马瑟兰、紫代夫和小味儿多葡萄酒发酵中,商业酵母SP在Interdelta分型中表现出4种基因型(SP1−SP4),在微卫星分型中共表现出3种基因型(SP-1−SP-3)。在赤霞珠葡萄酒发酵中,商业酵母SP存在于整个发酵过程中,Interdelta类型SP2 (SSR类型为SP-1)均是第1、3、5天的主导菌株;马瑟兰葡萄酒发酵中,商业酵母SP只在第5天检测到且占据优势,其类型为SP3 (SSR类型为SP-2),而第1、3天的主导菌株均是本土酵母,分别为Type5 (SSR类型为L-4)、Type8 (SSR类型为L-7);紫代夫葡萄酒发酵中,Interdelta分析和SSR分析均显示整个发酵过程中未分离到与SP基因型相同的菌株,Type12 (SSR类型为L-9)和Type15 (SSR类型为L-2)是发酵中的主导菌株;小味儿多葡萄酒发酵中,SP是第1、3天的优势菌株,其Interdelta类型SP3 (SSR类型为SP-2)、Interdelta类型Type10是5 d的主导菌株,对应SSR分析中的类型L-2。
|
| 图 4 接种商业酵母SP的赤霞珠、马瑟兰、紫代夫和小味儿多发酵中不同酿酒酵母菌株数量动态变化 Figure 4 Dynamic changes of the number of different Saccharomyces cerevisiae strains in the fermentation of Cabernet Sauvignon, Marselan, Dunkelfelder and Petit Verdot. A: Cabernet Sauvignon wine fermentation; B: Maserland wine fermentation; C: Fermentation of Zidav wine; D: Fermentation of petit much wine. A:赤霞珠葡萄酒发酵;B:马瑟兰葡萄酒发酵;C:紫代夫葡萄酒发酵;D:小味儿多葡萄酒发酵 |
|
|
宁夏贺兰山东麓葡萄酒产区具有特殊的地理环境,这使其蕴含着丰富的本土酿酒微生物资源,从而为葡萄酒酿造创造了优越的条件[1]。目前,我国多数葡萄酒生产企业使用ADY进行葡萄酒酿造与生产,长期使用ADY可能造成葡萄酒同质化严重,破坏我国本土酿酒微生物多样性。因此,本研究对宁夏贺兰山东麓产区葡萄酒工业生产过程中ADY的定殖情况及酿酒酵母菌株多样性进行研究,并分析不同品种葡萄酒工业生产过程中不同酿酒酵母菌株间的数量竞争关系,研究结果可为选育具有本土特色和自主知识产权的葡萄酒酵母提供理论依据。
本研究从接种商业酵母SP的4个葡萄品种的发酵液中共分离出240个酿酒酵母单菌落,Interdelta指纹图谱将其分为24种基因型,其中商业酵母共显示出4种基因型;而SSR分析结果显示出15种基因型,其中商业酵母共显示出3种基因型。因此,Interdelta指纹图谱技术对于不同酿酒酵母菌株显示了较高的区分能力。Interdelta序列的数目和位置在酿酒酵母种内具有一定的差异性,常被作为基因标记用于区分不同酿酒酵母菌株。通过Interdelta分型获得遗传背景不同的菌株,再进行酿酒特性研究可极大降低筛选的工作强度,提高工作效率。Ness等第一次系统地研究了用Interdelta技术进行酵母菌株鉴定的可行性,他们根据5′端的保守序列设计出δ1和δ2这2个引物进行扩增,结果发现这种方法对于酵母属的不同种以及亚种的菌株都有很好的鉴定效果,但是对其他属的酵母(Candida vini、Pichia canadensis和Hanseniaspora uvarum)不能得到有效的扩增条带[24]。2003年,Legras等设计了一对新引物(delta12、delta21)对53株酿酒酵母进行了PCR扩增分析[20],扩增结果与BLAST数据库中计算得来的虚拟电泳图谱比较分析得出,所有检测到的条带都对应于一个计算出来的可能条带,同时,与原先的引物相比较,优化的引物所扩增出的条带明显增多,多态性更加丰富,具有很好的菌株区分能力[20]。
Ayoub等[25]利用Interdelta指纹图谱法与多位点测序技术对84株不同来源的酿酒酵母和3株模式菌株进行了分析,结果显示Interdelta指纹图谱的菌株区分能力达到99.90%,而多位点测序技术的菌株区分能力达到92.27%,说明Interdelta指纹图谱具有更好的菌株区分能力。然而杨金仙等[26]证实了实验室PCR扩增和电泳条件及菌种获取来源的不同对Interdelta指纹图谱分析结果的稳定性具有一定的影响,因此,对中国不同产区酿酒酵母基因型的比较需要选用相同来源(如商业活性干酵母或菌种保藏中心酵母)的参考菌株,并在相同实验条件下进行比对分析。微卫星分子标记法主要依赖微卫星位点的高度多态性和特异性进行分子鉴定,可在种内不同个体间展现差异。相较于其他片段长度多态性分析方法,微卫星分子标记法具有较优的种内分型效果[19, 27-29]。自酿酒酵母全基因组序列公布以后,科学家开始构建搜索酿酒酵母微卫星序列的方法,并取得了显著成果。Pérez等[30]从10个微卫星位点中选出6个高多态性位点,对来自不同酒厂的51株酿酒酵母进行区分,得到57个等位基因和44个基因型,他们指出多个微卫星位点组合分析具有很高的分辨率。Legras等[31]对41个微卫星位点的多态信息进行评估和筛选,得到6个稳定的高变异微卫星位点,而这6个位点丰富的多态性也在随后其他学者的研究中得到认可,使得微卫星组合分型达到相对较高的分辨率。贾佳等[32]对Interdelta和SSR基因分型的可行性进行了研究,结果表明SSR的区分能力强于Interdelta,其原因之一为SSR在对样品进行鉴定时所选用引物的数量远远高于Interdelta,对比的基因片段累计长度远远大于Interdelta基因片段长度,能够捕捉更多的基因突变点[33]。杨金仙等[26]利用Interdelta指纹图谱技术结合SSR分子标记法研究了贵州紫云县刺葡萄自然发酵过程中丰富的酿酒酵母菌株基因型多样性,结果表明,Interdelta指纹图谱分析和微卫星分子标记法的结合使用提供了更强的分析酿酒酵母基因型多样性的能力,也验证了较多遗传标记的使用,理论上可以赋予每种酿酒酵母菌株独特的基因型的报道[22, 24]。本研究结果表明,Interdelta指纹图谱技术结合SSR分子标记法在菌株水平上都具有很好的区分效果。Interdelta指纹图谱法容易操作,不需要投入大量的仪器设备,只需要进行PCR扩增和电泳分析检测即可获得结果,但容易出现暗带,给分析带来困难;SSR分析需合成荧光标记引物,成本较高,但其结果是扩增片段大小的具体数值(bp),容易对不同来源的研究结果进行比较。本研究表明Interdelta指纹图谱技术与SSR标记技术在酵母基因型的区分上具有不同的区分能力,这与前人研究结果相似,一些能被Interdelta指纹图谱技术区分的酿酒酵母菌株,微卫星分型技术却不能将其区分[21, 25]。
目前可以查到的资料显示,商业酵母SP属于酿酒酵母种,该酵母是否由单菌株构成未见报道,对于本研究检测到的不同基因型而言,可以推测该酵母是由不同株系构成的。关于商业酵母由不同株系构成,前人已有相似报道[21, 34]。在葡萄酒酿造中,商业ADY的成功植入与否取决于酵母添加量、酵母本身的特性和接种温度等因素[14, 35-36]。也有研究表明,氮源在混菌发酵体系中会影响酵母的生长和代谢,酵母在混菌发酵中对不同氮源的利用可能会影响各自的生长[37]。有研究指出,在商业酿酒酵母与本地酵母的竞争中,商业酿酒酵母并不占优势[38-39]。本研究得到了相似的结果,接种的商业酵母SP与本土酵母在发酵中相互竞争,而且所接种的SP并不都是各个品种发酵各个时期的优势菌株。在不同的葡萄品种葡萄酒的工业生产中,SP在发酵中的主导地位存在显著差异:在赤霞珠葡萄酒接种发酵中,商业酵母SP-1 (Interdelta类型SP2)是整个发酵的主导菌株;而在紫代夫葡萄酒接种发酵中,Interdelta分析和SSR分析均显示本土酵母是整个发酵的主导菌株。这可能与葡萄原料导致的发酵条件如pH、SO2存在差异有关[40-41]。研究表明,不同酵母菌株对pH、SO2等的耐受性存在明显差异,即不同酵母菌株对发酵条件的适应能力存在差异[40-41]。
4 结论接种商业酵母SP的4个葡萄品种发酵中,SP与本土酵母相互竞争,二者共同参与完成酒精发酵。SP在不同葡萄酒工业生产中的定殖情况存在差异,在赤霞珠葡萄酒发酵中其定殖力最强,而在紫代夫葡萄酒发酵中其定殖力最弱。虽然也有其他研究表明温度、pH值、乙醇、细胞间接触、氮源及SO2等因素对酿酒酵母种内竞争关系有重要影响,然而什么因素是影响酿酒酵母菌株优势地位及其持久性的根本因素,哪些因素抑制或促进了ADY的定殖及其背后的分子机制等,这些问题还有待进一步研究。
| [1] |
Liu ST, Li Q, Lv W, Qin P. Present situation and development trend of Chinese wine industry: a case study of producing area at eastern foot of Helan Mountain in Ningxia[J]. Modern Agricultural Science and Technology, 2019(9): 241-243. (in Chinese) 刘松涛, 李茜, 吕雯, 秦萍. 中国葡萄酒产业现状及发展趋势: 以宁夏贺兰山东麓产区为例[J]. 现代农业科技, 2019(9): 241-243. DOI:10.3969/j.issn.1007-5739.2019.09.146 |
| [2] |
Liu AG. Isolation and identification of wine-related yeast from east foot of Helanshan Mountains of Ningxia[D]. Yangling: Master's Thesis of Northwest A & F University, 2008 (in Chinese) 刘爱国. 宁夏贺兰山东麓葡萄酿酒酵母菌的分离及其分类鉴定[D]. 杨凌: 西北农林科技大学硕士学位论文, 2008 |
| [3] |
Pei YF, Wang GP, Liu YL. Strain typing of Saccharomyces cerevisiae during spontaneous fermentation of cabernet sauvigon wine[J]. Microbiology China, 2009, 36(10): 1532-1535. (in Chinese) 裴颖芳, 王国平, 刘延琳. 赤霞珠葡萄酒自然发酵中酿酒酵母的菌株区分[J]. 微生物学通报, 2009, 36(10): 1532-1535. |
| [4] |
Zhang CZ, Mo YB. Classification, identification and diversity of wine-related yeast from Ningxia regions[J]. China Brewing, 2014, 33(10): 49-54. (in Chinese) 张春芝, 莫寅斌. 宁夏产区酿酒葡萄酵母菌初步分类鉴定及多样性研究[J]. 中国酿造, 2014, 33(10): 49-54. DOI:10.11882/j.issn.0254-5071.2014.10.012 |
| [5] |
Wang ZH, Liu YQ, Feng CE, Li RJ, Chen QP. Isolation and identification of Saccharomyces cerevisiae strain of east Helan Mountain Area in Ningxia[J]. Food Research and Development, 2017, 38(11): 176-180. (in Chinese) 王志恒, 刘雅琴, 冯翠娥, 李仁杰, 陈启鹏. 宁夏贺兰山东麓酿酒酵母分离筛选及菌株鉴定[J]. 食品研究与开发, 2017, 38(11): 176-180. DOI:10.3969/j.issn.1005-6521.2017.11.039 |
| [6] |
Sun Y, Qin Y, Pei YF, Wang GP, Joseph CML, Bisson LF, Liu YL. Evaluation of Chinese Saccharomyces cerevisiae wine strains from different geographical origins[J]. American Journal of Enology and Viticulture, 2017, 68(1): 73-80. DOI:10.5344/ajev.2016.16059 |
| [7] |
Wang XC. Isolation and identification of non-Saccharomyces cerevisiae from east foot of Helanshan Moutains of Ningxia and fermentation characteristics[D]. Yinchuan: Master's Thesis of Ningxia University, 2016 (in Chinese) 王晓昌. 宁夏贺兰山东麓非酿酒酵母的分离鉴定与发酵特性研究[D]. 银川: 宁夏大学硕士学位论文, 2016 |
| [8] |
Feng L, Chen X, Li L, Liu YL. The enology characteristics of five strains of Pichia kluyveri[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(12): 66-73. (in Chinese) 冯莉, 陈雪, 李丽, 刘延琳. 5株克鲁维毕赤酵母的酿造学特性[J]. 中国食品学报, 2018, 18(12): 66-73. |
| [9] |
Li JP. Isolation and identification of Saccharomyces cerevisiae form east foot of Helanshan Moutains of Ningxia and fermentation characteristics[D]. Yinchuan: Master's Thesis of Ningxia University, 2017 (in Chinese) 李金鹏. 宁夏贺兰山东麓酿酒酵母的分离鉴定与发酵特性研究[D]. 银川: 宁夏大学硕士学位论文, 2017 |
| [10] |
Liu N, Qin Y, Song YY, Tao YS, Sun Y, Liu YL. Aroma composition and sensory quality of cabernet sauvignon wines fermented by indigenous Saccharomyces cerevisiae strains in the eastern base of the Helan Mountain, China[J]. International Journal of Food Properties, 2016, 19(11): 2417-2431. DOI:10.1080/10942912.2015.1089278 |
| [11] |
Barrajón N, Arévalo-Villena M, Rodríguez-Aragón LJ, Briones A. Ecological study of wine yeast in inoculated vats from La Mancha region[J]. Food Control, 2009, 20(9): 778-783. DOI:10.1016/j.foodcont.2008.10.002 |
| [12] |
Vigentini I, Fabrizio V, Faccincani M, Picozzi C, Comasio A, Foschino R. Dynamics of Saccharomyces cerevisiae populations in controlled and spontaneous fermentations for Franciacorta D.O.C.G. base wine production[J]. Annals of Microbiology, 2014, 64(2): 639-651. DOI:10.1007/s13213-013-0697-7 |
| [13] |
Lange JN, Faasse E, Tantikachornkiat M, Gustafsson FS, Halvorsen LC, Kluftinger A, Ledderhof D, Durall DM. Implantation and persistence of yeast inoculum in Pinot noir fermentations at three Canadian wineries[J]. International Journal of Food Microbiology, 2014, 180: 56-61. DOI:10.1016/j.ijfoodmicro.2014.04.003 |
| [14] |
Maturano YP, Lerena MC, Mestre MV, Casassa LF, Toro ME, Vazquez F, Mercado L, Combina M. Inoculation strategies to improve persistence and implantation of commercial S. cerevisiae strains in red wines produced with prefermentative cold soak[J]. LWT, 2018, 97: 648-655. DOI:10.1016/j.lwt.2018.07.063 |
| [15] |
Sun Y, Ye DQ, Chu Y, Zhang YF, Liu YL. Effects of different inoculation methods & temperature on the fermentation of active dry yeast[J]. Liquor-Making Science & Technology, 2019(3): 24-28, 37. (in Chinese) 孙悦, 叶冬青, 褚越, 张怡飞, 刘延琳. 不同接种方式及温度对活性干酵母发酵的影响[J]. 酿酒科技, 2019(3): 24-28, 37. |
| [16] |
Goodwin TJ, Poulter RT. Multiple LTR-retrotransposon families in the asexual yeast Candida albicans[J]. Genome Research, 2000, 10(2): 174-191. DOI:10.1101/gr.10.2.174 |
| [17] |
De Celis M, Ruiz J, Martín-Santamaría M, Alonso A, Marquina D, Navascués E, Gómez-Flechoso MÁ, Belda I, Santos A. Diversity of Saccharomyces cerevisiae yeasts associated to spontaneous and inoculated fermenting grapes from Spanish vineyards[J]. Letters in Applied Microbiology, 2019, 68(6): 580-588. DOI:10.1111/lam.13155 |
| [18] |
Yang K, Mao RZ, Zhao Y, He C, Wang HL, Cao JH, Su W, He XH. Biodiversity of wine-related yeasts isolated from Shangri-La wine-producing region of Yunnan[J]. Microbiology China, 2018, 45(12): 2708-2721. (in Chinese) 杨宽, 毛如志, 赵悦, 何迟, 王慧玲, 曹建宏, 速伟, 何霞红. 云南香格里拉葡萄酒产区酿酒相关酵母菌的生物多样性[J]. 微生物学通报, 2018, 45(12): 2708-2721. |
| [19] |
Tie CY. Evaluation of the genetic diversity for Saccharomyces cerevisiae by sequence analysis and microsatellite markers[D]. Wuxi: Master's Thesis of Jiangnan University, 2013 (in Chinese) 铁春燕. 利用序列分析法和微卫星标记研究酿酒酵母的遗传多样性[D]. 无锡: 江南大学硕士学位论文, 2013 |
| [20] |
Legras JL, Karst F. Optimisation of Interdelta analysis for Saccharomyces cerevisiae strain characterisation[J]. FEMS Microbiology Letters, 2003, 221(2): 249-255. DOI:10.1016/S0378-1097(03)00205-2 |
| [21] |
Sun Y, Yang HM, He RR, Zhang JX. Implantation and persistence of inoculated active dry yeast in industrial wine fermentations[J]. Scientia Agricultura Sinica, 2021, 54(9): 2006-2016. (in Chinese) 孙悦, 杨慧敏, 何荣荣, 张军翔. 商业酵母在葡萄酒工业化生产中的定殖情况分析[J]. 中国农业科学, 2021, 54(9): 2006-2016. |
| [22] |
Tie CY, Hu Y, Zhang L, Shi GY. Genetic analysis of industrial yeast (Saccharomyces cerevisiae) based on sequencing of 26S rRNA gene D1/D2 domain and microsatellite markers[J]. Mycosystema, 2014, 33(4): 894-904. (in Chinese) 铁春燕, 胡芸, 张梁, 石贵阳. 利用26S rDNAD1/D2区序列和微卫星标记分析各种工业酿酒酵母的种内遗传差异[J]. 菌物学报, 2014, 33(4): 894-904. |
| [23] |
Botstein D, White RL, Skolnick M, Davis RW. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. American Journal of Human Genetics, 1980, 32(3): 314-331. |
| [24] |
Ness F, Lavallée F, Dubourdieu D, Aigle M, Dulau L. Identification of yeast strains using the polymerase chain reaction[J]. Journal of the Science of Food and Agriculture, 1993, 62(1): 89-94. DOI:10.1002/jsfa.2740620113 |
| [25] |
Ayoub MJ, Legras JL, Saliba R, Gaillardin C. Application of Multi Locus Sequence Typing to the analysis of the biodiversity of indigenous Saccharomyces cerevisiae wine yeasts from Lebanon[J]. Journal of Applied Microbiology, 2006, 100(4): 699-711. DOI:10.1111/j.1365-2672.2006.02817.x |
| [26] |
Yang JX, Wu C, Wang CX, Tian J, Xu YH, Qiu SY. Genotype diversity analysis of indigenous Saccharomyces cerevisiae during spontaneous fermentations of Vitis davidii Föex in Ziyun, Guizhou[J/OL]. Acta Microbiologica Sinica, 2021. DOI: 10.13343/j.cnki.wsxb.20210004 杨金仙, 吴成, 王春晓, 田进, 许引虎, 邱树毅. 贵州紫云刺葡萄自然发酵中野生酿酒酵母基因型多样性分析[J/OL]. 微生物学报, 2021. DOI: 10.13343/j.cnki.wsxb.20210004 |
| [27] |
Xiao Y, Hu Y, Zhang L, Shi GY. Screening of microsatellite markers associated with acetic acid tolerance of Saccharomyces cerevisiae[J]. Microbiology China, 2015, 42(11): 2065-2072. (in Chinese) 肖银, 胡芸, 张梁, 石贵阳. 酿酒酵母乙酸耐受性相关的微卫星分子标记筛选[J]. 微生物学通报, 2015, 42(11): 2065-2072. |
| [28] |
Zhang LY, Huang YZ, Liu YL. Genetic diversity analysis of Saccharomyces cerevisiae strains by microsatellite marker technique[J]. Food Science, 2014, 35(1): 130-133. (in Chinese) 张留燕, 黄英子, 刘延琳. 利用微卫星标记分析酿酒酵母的遗传多样性[J]. 食品科学, 2014, 35(1): 130-133. |
| [29] |
Feng M, Wang CX, Liu YL. Genetic diversity of Saccharomyces cerevisiae strains revealed by microsatellite sequence polymorphism[J]. Scientia Agricultura Sinica, 2012, 45(12): 2537-2543. (in Chinese) 冯敏, 王春晓, 刘延琳. 利用微卫星多态性揭示酿酒酵母菌株遗传多样性[J]. 中国农业科学, 2012, 45(12): 2537-2543. DOI:10.3864/j.issn.0578-1752.2012.12.024 |
| [30] |
Pérez MA, Gallego FJ, Martinez I, Hidalgo P. Detection, distribution and selection of microsatellites (SSRs) in the genome of the yeast Saccharomyces cerevisiae as molecular markers[J]. Letters in Applied Microbiology, 2001, 33(6): 461-466. DOI:10.1046/j.1472-765X.2001.01032.x |
| [31] |
Legras JL, Ruh O, Merdinoglu D, Karst F. Selection of hypervariable microsatellite loci for the characterization of Saccharomyces cerevisiae strains[J]. International Journal of Food Microbiology, 2005, 102(1): 73-83. DOI:10.1016/j.ijfoodmicro.2004.12.007 |
| [32] |
Jia J, Wang GQ, Zhu LX, Han PJ, Guo DQ, Chen M. Structure characteristics of Saccharomyces cerevisiae population associated with grape and wine in Xinjiang[J]. Journal of Dalian Polytechnic University, 2018, 37(2): 94-99. (in Chinese) 贾佳, 王冠群, 朱丽霞, 韩培杰, 郭东起, 陈明. 新疆葡萄和葡萄酒相关酿酒酵母种群的结构特征[J]. 大连工业大学学报, 2018, 37(2): 94-99. |
| [33] |
Ezeronye OU, Legras JL. Genetic analysis of Saccharomyces cerevisiae strains isolated from palm wine in eastern Nigeria. Comparison with other African strains[J]. Journal of Applied Microbiology, 2009, 106(5): 1569-1578. DOI:10.1111/j.1365-2672.2008.04118.x |
| [34] |
Ciani M, Comitini F. Yeast interactions in multi-starter wine fermentation[J]. Current Opinion in Food Science, 2015, 1: 1-6. |
| [35] |
Ferrarini R, Bocca E, Cavazza A. Mechanical dispersion procedures improve the rehydration of active dry yeast[J]. Enzyme and Microbial Technology, 2007, 40(5): 1251-1255. DOI:10.1016/j.enzmictec.2006.09.021 |
| [36] |
Soubeyrand V, Julien A, Sablayrolles JM. Rehydration protocols for active dry wine yeasts and the search for early indicators of yeast activity[J]. American Journal of Enology and Viticulture, 2006, 57(4): 474-480. |
| [37] |
Gobert A, Tourdot-Maréchal R, Sparrow C, Morge C, Alexandre H. Influence of nitrogen status in wine alcoholic fermentation[J]. Food Microbiology, 2019, 83: 71-85. DOI:10.1016/j.fm.2019.04.008 |
| [38] |
Di Maro E, Ercolini D, Coppola S. Yeast dynamics during spontaneous wine fermentation of the Catalanesca grape[J]. International Journal of Food Microbiology, 2007, 117(2): 201-210. DOI:10.1016/j.ijfoodmicro.2007.04.007 |
| [39] |
Santamaría P, Garijo P, López R, Tenorio C, Rosa Gutiérrez A. Analysis of yeast population during spontaneous alcoholic fermentation: effect of the age of the cellar and the practice of inoculation[J]. International Journal of Food Microbiology, 2005, 103(1): 49-56. DOI:10.1016/j.ijfoodmicro.2004.11.024 |
| [40] |
Tang YY. Screening and identification of quality yeast strains in grape dry red wine[D]. Hohhot: Master's Thesis of Inner Mongolia Agricultural University, 2018 (in Chinese) 唐莹莹. 干红葡萄酒优良酵母菌株的筛选[D]. 呼和浩特: 内蒙古农业大学硕士学位论文, 2018 |
| [41] |
Yang J. Studies on the breeding and application of good thorn wine yeast[D]. Changsha: Master's Thesis of Hunan Agricultural University, 2011 (in Chinese) 杨捷. 优良刺葡萄酒酵母的选育及应用研究[D]. 长沙: 湖南农业大学硕士学位论文, 2011 |
 2022, Vol. 49
2022, Vol. 49