扩展功能
文章信息
- 高蝶, 段燕文, 朱湘成
- GAO Die, DUAN Yanwen, ZHU Xiangcheng
- 气囊在细菌中的生理功能、生物合成及应用研究进展
- Physiological, biosynthetic and application studies of gas vesicles in bacteria: a review
- 微生物学通报, 2021, 48(6): 2176-2186
- Microbiology China, 2021, 48(6): 2176-2186
- DOI: 10.13344/j.microbiol.china.200891
-
文章历史
- 收稿日期: 2020-09-04
- 接受日期: 2020-10-21
- 网络首发日期: 2020-12-24
2. 新药组合生物合成国家地方联合工程研究中心 湖南 长沙 410205;
3. 组合生物合成与天然产物药物湖南省工程研究中心 湖南 长沙 410205
2. National Engineering Research Center of Combinatorial Biosynthesis for Drug Discovery, Changsha, Hunan 410205, China;
3. Hunan Engineering Research Center of Combinatorial Biosynthesis and Natural Product Drug Discovery, Changsha, Hunan 410205, China
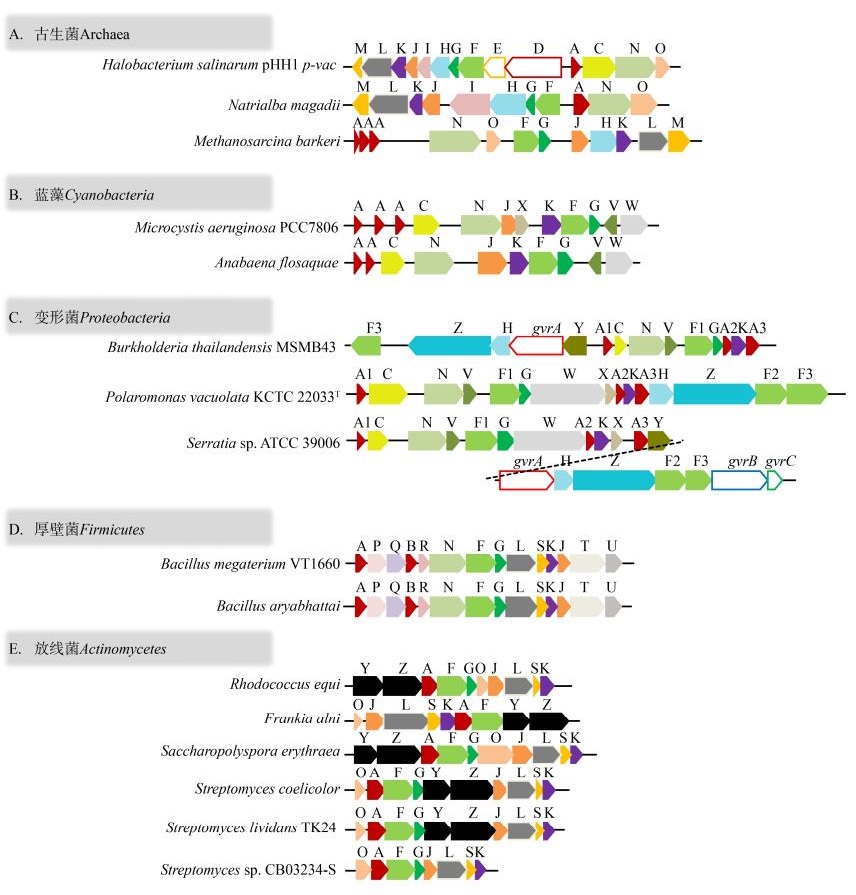
气囊(Gas Vesicles)是在蓝藻(蓝细菌)、异养细菌、厌氧光合细菌和嗜盐古菌等许多水生细菌中普遍存在的一类具有刚性中空结构、充满气体的特殊细胞器,主要为细胞提供浮力使其在水环境中迁移,对于水生细菌在逆境或胁迫应激条件下的生存起着非常关键的作用[1]。气囊完全由不同的气囊蛋白(Gas Vesicle Protein,Gvp)组成,其中高度保守的GvpA作为最主要的结构蛋白具有极强的疏水性[1],而编码这些Gvp蛋白的基因在基因组中成簇排列形成气囊生物合成基因簇(gvp)。随着基因测序技术的快速发展,在很多细菌基因组中都发现了结构不同的gvp基因簇,除了保守的gvpA核心基因以外,其他gvp基因在数量和排列顺序上都存在不同种属之间各自鲜明的特征(图 1)。此外,已报道的不同细菌中的气囊具有多样性的生理功能:其在蓝藻和嗜盐古菌中主要提供浮力,还可以减轻嗜盐古菌在高盐极端环境下的渗透压[2];在异养细菌中通过与成熟内生孢子的黏附来促进孢子在水环境中的扩散[1];而在沙雷氏肠杆菌和链霉菌中则对菌体的生长和次级代谢产生一定的影响[3-4]。本综述重点阐述气囊在不同种属细菌中的分布、生物合成及调控机制和对宿主生理代谢的潜在影响,并在介绍其现有生物技术应用的基础上对其开发前景进行展望。
|
| 图 1 不同种属细菌来源的gvp基因簇对比 Figure 1 Comparison of gvp gene clusters from different bacterial species 注:保守的同源gvp基因用相同颜色标记 Note: The homologous gvp genes were labeled with the same color |
|
|
古生菌大多生活在各种极端环境中,按其生活习性和生理特性可分为产甲烷菌、嗜热嗜酸菌、极端嗜盐菌三大类型。虽然很多嗜盐古菌中都存在gvp基因簇,但仅有少数如盐沼盐杆菌(Halobacterium salinarum)和地中海富盐菌(Haloferax mediterranei)可以产生气囊,呈纺锤状或圆柱状的成熟气囊由小双锥形囊泡发育而来,主要由疏水性蛋白GvpA包裹组成,并以GvpC附着在外表面以增强气囊的结构稳定性,形成的疏水性内表面可以阻止液态水进入,但却不妨碍气体透过和迅速扩散[5]。在最佳生长条件下,盐沼盐杆菌单个细胞内可含有多达70个成熟的纺锤状气囊,含气囊的菌落在固体培养基上的外观为不透明的粉红色,而无气囊的菌落则呈现出透明的红色[1]。除嗜盐古菌外,在产甲烷古菌如嗜热甲烷单胞菌(Methanosaeta thermophila)、嗜冷甲烷氧化菌(Psychrophilic methanotroph)和巴氏甲烷八叠球菌(Methanosarcina barkeri)中也发现了气囊结构,其中巴氏甲烷八叠球菌仅在含有氢气的培养环境中产生气囊,可能与菌体对氢气的趋化效应有关[6];嗜冷甲烷氧化菌产生气囊的数量在7-20 ℃范围内随温度的升高而增多,在4 ℃时仅40%的细胞含有气囊,而到20 ℃时几乎所有细胞内都含有气囊,气囊的产生可能有利于嗜冷甲烷氧化菌在温度升高时的生存[7]。
古生菌gvp基因簇的遗传和调控表达机制在嗜盐古菌尤其是盐沼盐杆菌中研究得较为透彻。盐沼盐杆菌PHH1的2个gvp基因簇分别位于质粒DNA (p-vac)和染色体DNA (c-vac)上,均由14个基因组成,分别排列在相反方向的gvpACNO和gvpDEFGHIJKLM这2个操纵子中(图 1A),但在整个生长周期均只能观察到p-vac产生的纺锤状气囊,只有在敲除p-vac的突变菌中才能观察到c-vac产生的圆柱状气囊[1]。p-vac的转录表达及气囊的形成不仅依赖于高细胞密度,还受到氧气含量、温度、盐浓度和碳源等诸多因素的影响[1],低温或适当的高盐环境均会促使大量气囊的形成,而缺氧条件或过多的碳源则不利于气囊形成。将p-vac中所有gvp基因进行逐一缺失,并将不同的突变p-vac分别在不产生气囊的沃氏富盐菌(Haloferax volcanii)中进行异源表达,发现gvpA、gvpO、gvpF、gvpG、gvpJ、gvpK、gvpL和gvpM等8个基因是合成气囊所必需的,其中gvpO的敲除会导致gvpACN转录本数量的显著减少,提示其可能是gvpACNO操纵子的转录激活基因或与mRNA的稳定性有关;其他辅助基因如gvpC、gvpI、gvpH和gvpN与气囊的正常形态发育有关:敲除gvpC会产生许多不规则的气囊,敲除gvpI会使产生的气囊变长,敲除gvpH后气囊由纺锤状变为圆柱状且气囊的合成变得不稳定,而敲除gvpN后不仅菌体内气囊形态变小且数量降低,还会对gvpO的转录产生一定影响[8]。随着蛋白检测技术的不断发展,嗜盐古菌纺锤状气囊蛋白外壳中的具体成分也逐渐被鉴定出来。免疫学检测技术发现,气囊中除GvpA外还含有其他6种结构蛋白GvpC、GvpF、GvpJ、GvpM、GvpG和GvpL[9],其中除GvpC以外其他Gvp蛋白的含量远低于GvpA;随后通过液相色谱串联质谱技术(LC-MS/MS)进一步从气囊中检测到了GvpI、GvpO和GvpN[10]。由于在菌体生长早期可以观察到gvpFGHIJKLM的mRNA低表达,因此这些Gvp蛋白被认为参与了气囊组装的早期步骤,其中GvpF和GvpL两者都含有与自我寡聚化有关的卷曲螺旋结构域,可能在气囊形成的初期发挥作用[9];GvpJ和GvpM是与GvpA相似的疏水蛋白,也参与构成气囊的蛋白质外壳,由不同比例GvpA、GvpJ和GvpM组成的蛋白复合体可能决定着气囊“肋骨”的宽度,而GvpA含量越高则“肋骨”宽度越大[9]。利用免疫金标记法研究GvpF,发现金颗粒没有附着在完整气囊的表面,而当气囊经过超声处理塌陷后,金颗粒开始聚集且密度较高,提示GvpF极有可能定位于气囊的内表面[11]。荧光蛋白标记实验则进一步揭示了GvpM与GvpH、GvpJ和GvpL之间潜在的相互作用,GvpM很可能与这些Gvp蛋白发生聚合形成生长早期时观察到的双锥形气囊泡,随后在GvpA和GvpC的组装下进一步发育为成熟的气囊结构,这些针对不同Gvp蛋白的研究也进一步佐证了上述gvp基因表征的结果[12-13]。另一方面,GvpE是gvpACNO操纵子的激活正调控子,而GvpD通过与GvpE结合来抑制gvpACNO操纵子的转录表达,对气囊的生物合成起到了重要的调控作用[14]。由于其他嗜盐古菌如空泡盐红菌(Halorubrum vacuolatum)的gvp基因簇中缺乏gvpDE (图 1A),因此,GvpD和GvpE对气囊生物合成的调控影响也仅限于少数菌种中[14]。此外,各个辅助Gvp蛋白的单独过表达并不能增加气囊的形成,其数量可能需要达到一定的平衡才能保证气囊的正常组装[12]。与嗜盐古菌不同的是,产甲烷古菌如巴氏甲烷八叠球菌的gvp基因簇中往往包含多个gvpA拷贝,同时还缺少gvpC、gvpD、gvpE及gvpI等基因[1],其相关的生物合成和调控机制尚未见报道(图 1A)。
1.2 蓝藻(Cyanobacteria)蓝藻是一类分布十分广泛的光合放氧微生物,需要获取足够的光能量来进行产氧性光合作用和营养生长,气囊这一特殊细胞器最早就是在蓝藻中被发现并定义的。丝状蓝藻如鱼腥藻(Anabaena)、浮丝藻(Planktothrix)、念珠藻属(Nostoc)和眉藻(Calothrix)以及单细胞蓝藻如微囊藻(Microcystis)和蓝纤维藻(Dactylococcopsis)等都可以产生气囊。蓝藻的gvp基因簇不仅含有多个gvpA拷贝,还具有种属相关的遗传特征[15],例如:丝状蓝藻水华鱼腥藻(Anabaena flosaquae)的gvp基因簇由2个gvpA和其他6个嗜盐古菌同源gvp基因,以及gvpV和gvpW这2个未知功能基因组成;单细胞蓝藻铜绿微囊藻(Microcystis aeruginosa) PCC7806的gvp基因簇中除了含有3个gvpA和其他6个嗜盐古菌同源gvp基因外,也含有gvpV、gvpW和gvpX这3个未知功能的基因(图 1B)。蛋白序列分析表明,铜绿微囊藻的GvpX与其GvpJ的C末端显示出部分相似性,而GvpW的长度和pI值均与嗜盐古菌中的GvpL一致,而且表现出一定的序列相似性;此外,GvpW被破坏后虽然能检测到gvpA的转录表达但无法产生气囊,推测GvpW的缺失可能会阻碍气囊的组装,而GvpV的缺失也导致气囊无法产生[16]。此外,浮丝藻的gvp基因簇还被报道含有长度不同的多个gvpC,其对气囊的直径和临界压力均产生影响[17]。
蓝藻中gvp基因的转录表达和气囊的形成受到光照强度、CO2、温度或者水环境pH等诸多因素的影响。当水环境中光辐照度较低时会诱导蓝藻中气囊的产生,并且当气囊占据细胞体积的3%-10%时,即可为细胞提供浮力以支持其在水栖环境中的上浮[18],而在光合作用过程中,不断积累的碳水化合物会导致菌体因密度增加而下沉,或因为K+浓度增加引起细胞膨胀而导致气囊崩塌使菌体失去浮力,最终在气囊合成和光合作用的相互调节下实现蓝藻在水域环境中的垂直迁移[18]。某些蓝藻甚至还表现出对特定光频率的选择性,例如相比于绿光而言,红光照射可以诱导眉藻PCC7601合成大量气囊[18]。在营养匮乏,尤其是缺乏CO2及光照时,铜绿微囊藻中的气囊数量会明显增多[15],而pH升高不仅可以上调微囊藻gvp基因的转录,还使gvpA和gvpC的mRNA衰退减慢,从而增加气囊的合成[19]。值得注意的是,丝状蓝藻眉藻和念珠藻的藻植段分化的一个关键特征就是伴随着气囊的产生。点形念珠藻(Nostoc punctiforme)的藻植段分化受Sigma因子J的调控,而其gvpA上游也存在一个SigJ依赖型启动子,因此,SigJ在激活藻植段分化特异性基因表达的同时,也可以启动gvpA的转录[15, 20]。
1.3 变形菌(Proteobacteria)作为自然界中最大的一类细菌,很多变形菌都具有迁移能力,在γ-变形菌沙雷氏肠杆菌(Serratia sp.) ATCC 39006、β-变形菌空泡极地单胞菌(Polaromonas vacuolata) KCTC 22033T和泰国伯克氏菌(Burkholderia thailandensis) MSMB43的基因组中均含有gvp基因簇,并且在沙雷氏肠杆菌ATCC 39006及空泡极地单胞菌KCTC 22033T中观察到了气囊的存在[21-22]。沙雷氏肠杆菌ATCC 39006中存在一个由分布于2个操纵子共19个基因组成的gvp基因簇,其中含有3个gvpA、8个嗜盐古菌同源gvp基因、3个调控基因gvrA、gvrB和gvrC,以及未知功能的gvpV、gvpW、gvpX、gvpY和gvpZ (图 1C),而产生的气囊主要为圆柱状,即使在同一细胞中其形态大小也存在差异[23],并且细胞在水环境中的浮力和运动方式与气囊有关[24]。针对该gvp基因簇的基因敲除实验表明,要形成明确可见的气囊且能够维持细胞的浮力,gvpA1、gvpA2、gvpA3、gvpG、gvpF1、gvpF2、gvpF3、gvpG、gvpK、gvrA和gvrB这11个基因缺一不可;此外,gvpN和gvpV被敲除后菌体会积累大量体积较小的不成熟双锥型囊泡,提示GvpN和GvpV可能促进气囊的成熟发育,而且两者的作用是相互独立不能互补的[21]。与盐沼盐杆菌的情况相似,gvp基因单独过表达的结果同样说明,不同Gvp蛋白的相对化学计量对于气囊的发育和功能形态至关重要,单一基因的过表达并不能增加气囊的形成[3];然而gvpG的过表达会明显抑制菌体的生长,但是移除C末端的gvpG过表达却无明显作用,提示GvpG的酸性C末端很可能对气囊的形成和细胞的生长均有重要的影响[3]。
另一方面,沙雷氏肠杆菌ATCC 39006中gvp基因的转录表达,严格受到群体感应化学信号分子N-酰基高丝氨酸内酯(N-Butanoyl-L-Homoserine Lactone,BHL)的正调控,并且气囊的生成还会抑制其次级代谢产物灵菌红素的合成[23]。在液体培养时,生长静止期的高细胞密度和缺氧条件会激活信号分子BHL的产生,使其与转录阻遏蛋白SmaR结合以解除对gvpA1的转录抑制作用,进而诱导气囊的合成来协助细胞向气液界面迁移并保持悬浮状态,从而避开细胞之间的相互竞争以维持存活[21]。同时,调控蛋白GvrA与大肠杆菌的氮代谢调控子NtrC有一定的相似性,而据报道磷酸化的NtrC可以与σ54因子作用启动基因的转录,因此,GvrA可以通过影响gvpA1上游的σ54因子结合位点来调控gvpA1的转录表达;GvrB中含有一个与缺氧条件下信号转导有关的Per-ARNT-Sim (PAS)结构域,很可能与低氧浓度时促进气囊合成的信号转导过程有关[3]。然而gvrA、gvrB和gvrC的过表达或敲除都会显著抑制气囊的产生,其具体的调控机制仍不明了[3, 21]。除此以外,沙雷氏肠杆菌ATCC 39006中气囊的形成还受到其他转录调节因子如RsmA、RbsR (LacI家族)及FloR (DeoR家族)的影响,这3种转录因子的突变均会使gvrA及gvpA1操纵子的转录水平降低,从而抑制气囊的形成,并且还会负调控细胞基于鞭毛的群集运动能力[23, 25-26]。另外,钾离子转运蛋白TrkH也可以通过改变细胞内的渗透压来调节gvpA1的转录水平,进而影响胞质内的气囊合成,在高浓度钾离子环境中,trkH转录水平的增强会抑制气囊的产生[27]。
1.4 厚壁菌(Firmicutes)早期关于气囊的研究主要都是围绕水生细菌展开的,而巨大芽孢杆菌VT1660是首个被发现并报道含有14个gvp基因簇的土壤细菌[28],而且这一类型的gvp基因簇在芽孢杆菌属中也十分常见[29]。虽然并没有在巨大芽孢杆菌VT1660或其他芽孢杆菌的胞质中观察到气囊结构,但是该gvp基因簇的异源表达可以在大肠杆菌中形成小的气囊泡并增加其浮力[28]。与嗜盐古菌相比,巨大芽孢杆菌gvp基因簇中出现了一些新的gvp基因(图 1D),其中GvpB与GvpA高度相似,GvpR可能是GvpO的同源蛋白,GvpS为GvpM的同源蛋白,GvpQ与GvpI的大小和等电点极为相似,很可能为非同源但功能类似的蛋白;而GvpP、GvpT和GvpU的具体功能未知,但GvpT和GvpU是异源合成气囊必需的蛋白[8, 28]。
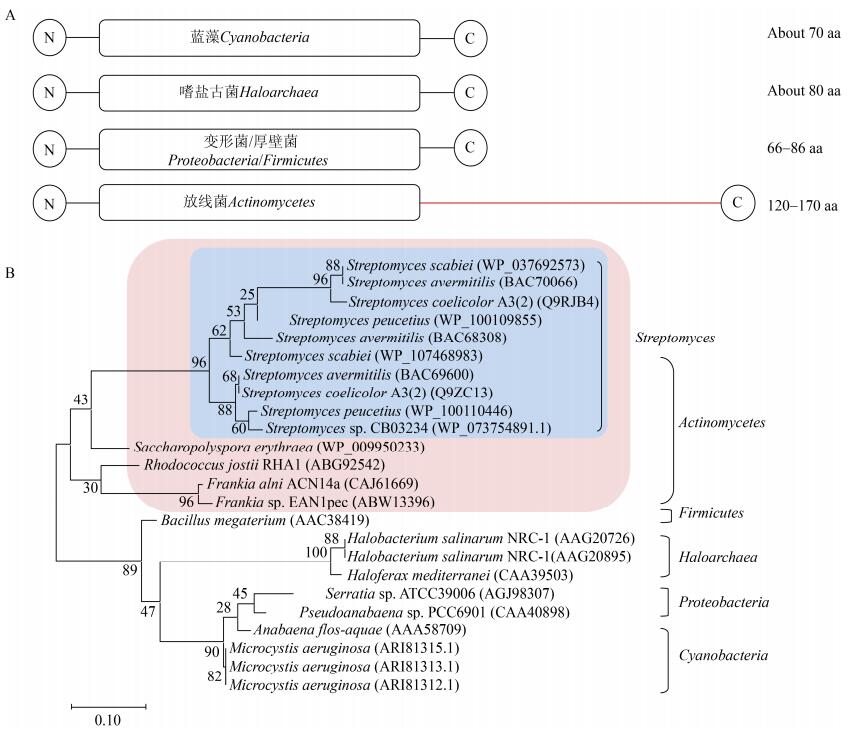
1.5 放线菌(Actinomycetes)随着全基因组测序技术的不断发展,嗜盐古菌中气囊形成必需的8个gvp基因的同源基因被发现,它们也广泛存在于如链霉菌属(Streptomycetes)、红球菌属(Rhodococcus)、弗兰克氏菌属(Frankia)和糖多孢菌属(Saccharopolyspora)等放线菌基因组中(图 1E)[30]。放线菌gvp基因簇的一个明显特征是,没有气囊用于抵抗外界压力的关键结构辅助蛋白编码基因gvpC,同时也不含gvpN或gvpV等促进气囊发育成熟的基因,预示着放线菌中可能形成的气囊形态应该不同于现有已表征的气囊。此外,大部分放线菌gvp基因簇中还存在2个未知功能的基因gvpY和gvpZ,而且这2个基因在不同种属放线菌gvp基因簇中的排列顺序明显不同。相比于其他放线菌,链霉菌属的gvp基因簇排列方式通常为gvpOAFGYZJLSK,并遵循统一的转录方向,而且链霉菌基因组中往往存在多个拷贝相似的gvp基因簇(图 1E)[1]。作为构成气囊的核心蛋白,放线菌GvpA中有一段很长、不具备任何其他种属GvpA同源性的C末端延伸序列,而其N-端部分与其他种属的全长GvpA具有很好的序列相似性(图 2A)[31]。基于这段高度保守结构域进行系统发育分析发现(图 2B),GvpA在不同微生物中表现出鲜明的种属聚集特性,各自形成对应的末端进化分支[4]。值得注意的是,放线菌GvpA与目前已被表征的非水生细菌来源(巨大芽孢杆菌)和水生细菌来源的同源蛋白差别较大,单独形成了一个分支群落,预示放线菌并非通过水平的基因转移来获得GvpA,具备该蛋白进化上的独立性。此外,链霉菌GvpA又独立成为一个亚类分支群落,与其他放线菌GvpA存在显著区别。放线菌GvpA独特的C末端延伸序列长度几乎与其他种属GvpA相当,并且具有较高含量交替呈现的酸性氨基酸(谷氨酸E和天冬氨酸D)和碱性氨基酸(精氨酸R和赖氨酸K)[31]。放线菌在潮湿土壤或者液体表面产生气生菌丝的过程需要提供可以附着在空气-水界面的疏水表面以穿过水环境,GvpA可能通过将疏水性的N端暴露于空气-水界面、亲水性的C端附着在细胞表面来参与这一过程[32]。此外,这种类似的带电荷氨基酸束也出现在病毒外壳蛋白和RNA结合蛋白上,同时还有报道表明富含精氨酸的肽可以协助其他肽的膜转运[30],总之,放线菌GvpA的C端特性是否在放线菌中发挥独特作用仍有待深入研究。
|
| 图 2 不同种属细菌来源GvpAs的生物信息分析 Figure 2 Bioinformatic analyses of GvpAs from different bacterial species 注:A:蛋白序列对比(放线菌GvpA特有的C末端延伸序列用红色标示);B:进化树分析(红色部分为放线菌GvpA分支,其中的蓝色部分为链霉菌GvpA亚类分支;菌株名称后括号内序列号代表该菌株GvpA蛋白序列的GenBank登录号;进化树分支点的数字代表该分支点的Bootstrap值,数值以百分比(%)形式展示;标尺数字代表该长度的分支所代表的基因组遗传变异度) Note: A: Comparison of protein sequences (the specific C-terminal extension sequence of GvpA from Actinomycetes is marked red); B: Phylogenetic tree analysis (the GvpA branch of Actinomycetes is shaded red, and the GvpA subclass branch of Streptomyces is shaded blue; The numbers within brackets following the bacterial strains indicate the NCBI GenBank accession numbers for protein sequences of GvpA; The numbers at the nodes of different branches in the phylogenetic tree indicate the bootstrap values, which are displayed in the form of percentage (%); The number of scale bar indicates the genetic variability of the genome sequences represented by the branch of this determined length) |
|
|
链霉菌是各类活性微生物天然产物的重要来源,其中绝大部分次级代谢产物主要是通过液体培养发酵获得的。虽然gvp基因簇在链霉菌中广泛分布,并且在链霉菌液体培养过程中空气-水界面普遍存在,但是却一直没有观察到气囊的形成。作为研究最多的模式菌之一,天蓝色链霉菌(Streptomyces coelicolor)中存在2个gvp基因簇(gvp1和gvp2),其中gvp2中的GvpF2、GvpG2和GvpL2由于精氨酸含量较高,其等电点显著高于gvp1中的同源蛋白;此外蛋白序列分析表明,GvpJ和GvpS与GvpA有一定的直系同源性;GvpO中存在一个典型的可与DNA结合的螺旋-转角-螺旋序列,可能具有调控作用;GvpY中存在1个以谷氨酸为主的酸性区域和多个以赖氨酸为主的碱性区域,而GvpZ的C末端同样富含谷氨酸,这2个Gvp蛋白的功能尚未明确[31]。在液体培养条件下,当渗透压、磷酸盐含量或温度升高后,天蓝色链霉菌中的gvp1及其邻近基因会短暂被诱导表达,但并未观察到气囊的存在,而gvp2始终处于沉默状态[33-34]。此外,针对NCBI-GEO公共数据库中不同条件下(不同生长时间节点、调控蛋白敲除和培养基改变等)天蓝色链霉菌的转录样本分析也均未发现gvpA1和gvpA2的显著激活[4]。非游动的天蓝色链霉菌在液体中静置培养时可以形成漂浮的菌落群体,但对其任一gvp基因簇的单一或同时敲除均不影响菌体的漂浮[30],而且将该gvp基因簇在大肠杆菌中进行异源表达,也未能观察到对细胞浮力产生影响或类似气囊结构的形成[31]。最近在十元环烯二炔天赐霉素(TNM)的高产链霉菌(Streptomyces sp.) CB03234-S中发现了一个不含gvpYZ的新型gvp基因簇(gvpOAFGJLSK,gvp3234),并且所有gvp基因的转录水平在富含氮源的优化培养基中均显著上调,同时通过透射电镜在菌丝体中还观察到许多类似气囊结构;将gvp3234在CB03234-S中过表达不仅会增加菌丝体中气囊结构的数量,还能将TNM发酵产量进一步提升30%以上,而且gvp3234在其他链霉菌的异源表达也对宿主的菌体形态和次级代谢产生明显影响[4]。
2 气囊的生物技术应用气囊无孔、疏水的内表面对气体具有很强的渗透性,但可以阻止水分子的穿透,这一独特的性质使得气囊可以作为有效的空气载体来提高液态培养体系的供氧。哺乳动物细胞在液体培养生长过程中需要较多氧气,由于缺乏细胞壁不能通过剧烈搅拌来增加氧气供应,一般利用血红蛋白、碳氢化合物和全氟碳化合物等不同氧载体为这些细胞提供足够的氧气,但往往在成本、稳定性和生物相容性等因素方面具有一定的局限性。从水华鱼腥藻中分离出的气囊具有较大的比表面积(载氧量和氧扩散效率较高)和生物相容性,相对于全氟碳化合物而言,不仅稳定性好且具有更大的氧气携带量和氧扩散率(超过3个数量级);在添加1.8% (体积分数)气囊的培养基中,哺乳动物细胞对葡萄糖的最大利用率调高了30%,并且对细胞代谢无明显影响[35]。另一方面,肿瘤内部的低氧环境是限制耗氧型癌症治疗效果的关键因素,将源于水华鱼腥藻的气囊进行脂质体包裹开发成有效的氧气载体,在其自身并未表现出明显毒性的前提下,通过静脉注射可以在以5-氨基酮戊酸为光敏剂的光动力疗法(Photodynamic Therapy,PDT)中显著促进鳞状细胞癌细胞系(Squamous Cell Carcinoma Cell Line,SCC7)的凋亡和坏死,在缓解癌症缺氧环境以及其他与缺氧相关的临床治疗上表现出较好的应用前景[36]。
此外,气囊的纳米级蛋白结构较为稳定且具有较好的生物兼容性,可以耐受化学试剂或者酶的降解,因此可作为潜在的生物纳米材料用于递送来自病毒、细菌和真核生物的抗原或者其他药物,并具有增加稳定性、免疫原性和增强细胞膜吸收等优势[37]。从盐沼盐杆菌NRC-1中分离纯化出来的气囊可以刺激小鼠的免疫反应且无毒副作用,而将其气囊中GvpC的酸性尾部与伤寒沙门氏菌的效应分泌蛋白SopB片段进行融合的重组蛋白可以作为一种候选的疫苗,在接种到注射了伤寒沙门氏菌毒株的小鼠体内时可出现明显的免疫应答反应,脾脏、肝脏和肠系膜淋巴结的伤寒沙门氏菌数量至少减少了2个数量级[37]。采用微针辅助的经皮给药系统,可以显著提高来源于NRC-1的气囊生物纳米粒在猪皮上的渗透性,初步显示了其作为蛋白质和肽类药物的皮内/经皮渗透递送体系的潜力[38]。最新研究表明,基于光敏剂二氢卟吩e6 (Chlorin e6,Ce6)分子的末端羧酸与GvpA的赖氨酸ε-氨基,可以在单个NRC-1气囊表面连接近6万个Ce6分子来形成偶合物Ce6-GVs,在光照条件下Ce6-GVs较游离的Ce6而言,杀死人乳腺癌细胞(MCF-7)和人咽癌细胞(FaDu-GFP)的效率均提升超过200倍[39]。
气囊独特的充满气体的蛋白质纳米结构能够散射声波,从而与周围环境形成对比,并且在一定的外界压力条件下会发生坍塌,这一特性使气囊作为纳米级的声学分子报告器,在磁共振成像(Magnetic Resonance Imaging,MRI)和超声成像等非侵入式活体细胞成像技术的造影开发方面得到了迅速的应用和发展。将源自盐沼盐杆菌NRC-1的气囊经皮下注射到小鼠的腹部后,可以明显观察到气囊注射一侧相比于对照组信号明显增强,当使用超声波脉冲处理后,气囊破裂导致信号消失[40]。基于这一新型成像技术,将来源于水华鱼腥藻gvp基因簇的gvpA和gvpC与来源于巨大芽孢杆菌gvp基因簇的gvpR-gvpU,共同组成一个重组gvp基因簇作为声学报告器,其在大肠杆菌和鼠伤寒沙门氏菌中的异源表达能够在体积密度低于0.01%且分辨率小于100 μm的条件下进行无创成像,而且能够分别在胃肠道和肿瘤模型中进行细胞的体内成像定位[41]。同时,针对水华鱼腥藻气囊、盐沼盐杆菌NRC-1气囊以及巨大芽孢杆菌gvp基因簇在大肠杆菌中异源表达产生的气囊均可以形成敏感的MRI对比,但各自具有不同的特征临界坍塌压强,通过调节超声波的强度还可以进一步形成基于声学调控的多重MRI[42]。由于水华鱼腥藻气囊中的结构加强蛋白GvpC对气囊临界坍塌压强的影响十分显著,通过在GvpC序列中引入特定的蛋白酶裂解位点,可以合成能够响应该蛋白酶活性而产生非线性超声造影信号的工程化气囊,从而开发出通过无创超声成像来监测蛋白酶活性的声学生物传感器[43]。因此,基于气囊的不同声学分子报告器和传感器的开发,为我们深入观察哺乳动物机体内部提供了有效的手段,将极大地促进活细胞研究以及诊断和治疗细胞制剂的开发。
3 总结与展望气囊广泛存在于许多原核生物特别是水生细菌中,其生理功能、对应的gvp基因簇和生物合成机制在不同种属细菌之间具有各自鲜明的特点。总体而言,气囊的产生是细菌在水环境中为生存或应对不利条件时所形成的自我适应,虽然气囊的主要作用是提供浮力,但随着研究的逐渐深入,发现气囊或其相关蛋白对某些宿主细菌的生长和次级代谢也会产生一定的影响。链霉菌产生的活性天然产物是医用和农用抗生素的主要来源,其中绝大部分都是通过液体有氧发酵获得的,溶氧水平的变化与链霉菌的生长和代谢密切相关。最新发现的链霉菌气囊对液体发酵时链霉菌的菌丝体形态和次级代谢均产生了一定的影响,很可能作为氧气载体促进了液体发酵时菌丝中的物质和溶氧交换,进而影响次级代谢产物合成。gvp3234作为链霉菌中首个被表征的功能性gvp基因簇,对链霉菌气囊的生物合成及其相关生理功能的研究具有重要意义。gvp3234有异于其他链霉菌常见gvp基因簇的基因特征是否是影响其表达和气囊合成的遗传机制,GvpA中加长的C末端延伸是否具有其独特的生理作用,除核心蛋白GvpA以外的其他蛋白到底在气囊的生物合成中扮演着怎样的角色,这些问题都有待探究。在深入解析链霉菌气囊产生的遗传机制和生物合成机制的基础上,可以进一步通过整合其他细菌来源的gvp辅助基因对gvp3234进行重组优化,从而提高气囊的形态及数量,以利于将其开发成为有效的氧载体底盘模块,改善链霉菌在液体培养时的菌体形态和氧气需求,为链霉菌细胞工厂的合成生物学构建提供新的见解。
气囊可容纳气体和纳米级蛋白质结构的特性使其在生物应用领域具有独特的优势,不仅可以为各类细菌和细胞的好氧培养甚至肿瘤的缺氧微环境增强氧气递送,而且作为生物纳米材料,在基于声学的生物传感器和报告器开发等方面更是具有极大的应用前景。此外,气囊作为藻类细菌产生浮力的基础,是形成水华的关键,利用偏振光散射法检测蓝藻中的气囊,可以快速无损地预测蓝藻的垂直迁移和水华的产生[44];同时利用超声波来崩塌气囊,从而使蓝藻失去浮力,也可以作为控制水华的一种物理方法,比用化学灭藻剂更为环保,不会造成鱼、昆虫等较大生物体的死亡。由于不同细菌来源的气囊在外形、大小和临界坍塌压强等参数方面的差异较大,这为我们对气囊进行理性的人工重组以满足特定的生物应用需求提供了更多的可能性。在阐明生物合成机制的基础上,通过对目标gvp基因簇的重组优化和工程化改造来获得设计的人造气囊,将极大地促进气囊在细胞工厂构建、肿瘤治疗和成像以及水华防治等方面的多元化开发和应用。
| [1] |
Pfeifer F. Distribution, formation and regulation of gas vesicles[J]. Nature Reviews Microbiology, 2012, 10(10): 705-715. DOI:10.1038/nrmicro2834 |
| [2] |
Oren A. The function of gas vesicles in halophilic archaea and bacteria: theories and experimental evidence[J]. Life (Basel), 2013, 3(1): 1-20. |
| [3] |
Monson RE, Tashiro Y, Salmond GPC. Overproduction of individual gas vesicle proteins perturbs flotation, antibiotic production and cell division in the enterobacterium Serratia sp. ATCC 39006[J]. Microbiology, 2016, 162(9): 1595-1607. DOI:10.1099/mic.0.000347 |
| [4] |
Huang R, Lin J, Gao D, Zhang F, Yi LW, Huang Y, Yan XH, Duan YW, Zhu XC. Discovery of gas vesicles in Streptomyces sp. CB03234-S and potential effects of gas vesicle gene overexpression on morphological and metabolic changes in streptomycetes[J]. Applied Microbiology and Biotechnology, 2019, 103(14): 5751-5761. DOI:10.1007/s00253-019-09891-z |
| [5] |
Knitsch R, Schneefeld M, Weitzel K, Pfeifer F. Mutations in the major gas vesicle protein GvpA and impacts on gas vesicle formation in Haloferax volcanii[J]. Molecular Microbiology, 2017, 106(4): 530-542. DOI:10.1111/mmi.13833 |
| [6] |
Maeder DL, Anderson I, Brettin TS, Bruce DC, Gilna P, Han CS, Lapidus A, Metcalf WW, Saunders E, Tapia R, et al. The Methanosarcina barkeri genome: comparative analysis with Methanosarcina acetivorans and Methanosarcina mazei reveals extensive rearrangement within methanosarcinal genomes[J]. Journal of Bacteriology, 2006, 188(22): 7922-7931. DOI:10.1128/JB.00810-06 |
| [7] |
Daviso E, Belenky M, Griffin RG, Herzfeld J. Gas vesicles across kingdoms: a comparative solid-state nuclear magnetic resonance study[J]. Journal of Molecular Microbiology and Biotechnology, 2013, 23(4/5): 281-289. |
| [8] |
Offner S, Hofacker A, Wanner G, Pfeifer F. Eight of fourteen gvp genes are sufficient for formation of gas vesicles in halophilic archaea[J]. Journal of Bacteriology, 2000, 182(15): 4328-4336. DOI:10.1128/JB.182.15.4328-4336.2000 |
| [9] |
Shukla HD, DasSarma S. Complexity of gas vesicle biogenesis in Halobacterium sp. strain NRC-1: identification of five new proteins[J]. Journal of Bacteriology, 2004, 186(10): 3182-3186. DOI:10.1128/JB.186.10.3182-3186.2004 |
| [10] |
Chu LJ, Chen MC, Setter J, Tsai YS, Yang HY, Fang XF, Ting YS, Shaffer SA, Taylor GK, Von Haller PD, et al. New structural proteins of Halobacterium salinarum gas vesicle revealed by comparative proteomics analysis[J]. Journal of Proteome Research, 2011, 10(3): 1170-1178. DOI:10.1021/pr1009383 |
| [11] |
Xu BY, Dai YN, Zhou K, Liu YT, Sun QQ, Ren YM, Chen YX, Zhou CZ. Structure of the gas vesicle protein GvpF from the cyanobacterium Microcystis aeruginosa[J]. Acta Crystallographica Section D Biological Crystallography, 2014, 70(Pt 11): 3013-3022. |
| [12] |
Tavlaridou S, Faist K, Weitzel K, Pfeifer F. Effect of an overproduction of accessory Gvp proteins on gas vesicle formation in Haloferax volcanii[J]. Extremophiles, 2013, 17(2): 277-287. DOI:10.1007/s00792-013-0515-y |
| [13] |
Tavlaridou S, Winter K, Pfeifer F. The accessory gas vesicle protein GvpM of haloarchaea and its interaction partners during gas vesicle formation[J]. Extremophiles, 2014, 18(4): 693-706. DOI:10.1007/s00792-014-0650-0 |
| [14] |
Pfeifer F. Haloarchaea and the formation of gas vesicles[J]. Life (Basel), 2015, 5(1): 385-402. |
| [15] |
Cai K, Xu BY, Jiang YL, Wang Y, Chen YX, Zhou CZ, Li Q. The model cyanobacteria Anabaena sp. PCC 7120 possess an intact but partially degenerated gene cluster encoding gas vesicles[J]. BMC Microbiology, 2020, 20(1): 110. DOI:10.1186/s12866-020-01805-8 |
| [16] |
Mlouka A, Comte K, Castets AM, Bouchier C, De Marsac NT. The gas vesicle gene cluster from Microcystis aeruginosa and DNA rearrangements that lead to loss of cell buoyancy[J]. Journal of Bacteriology, 2004, 186(8): 2355-2365. DOI:10.1128/JB.186.8.2355-2365.2004 |
| [17] |
Beard SJ, Handley BA, Walsby AE. Spontaneous mutations in gas vesicle genes of Planktothrix spp. affect gas vesicle production and critical pressure[J]. FEMS Microbiology Letters, 2002, 215(2): 189-195. DOI:10.1111/j.1574-6968.2002.tb11390.x |
| [18] |
Wei K, Amano Y, Machida M, Asukabe H, Harada KI. Effects of light and potassium ion on buoyancy regulation with gas vesicle in a cyanobacterium Microcystis aeruginosa NIES-843[J]. Water, Air, & Soil Pollution, 2018, 229(11): 352. DOI:10.1007/s11270-018-4010-z |
| [19] |
Gao H, Zhu T, Xu M, Wang S, Xu XD, Kong RQ. pH-dependent gas vesicle formation in Microcystis[J]. FEBS Letters, 2016, 590(18): 3195-3201. DOI:10.1002/1873-3468.12370 |
| [20] |
Gonzalez A, Riley KW, Harwood TV, Zuniga EG, Risser DD. A tripartite, hierarchical sigma factor cascade promotes hormogonium development in the filamentous cyanobacterium Nostoc punctiforme[J]. mSphere, 2019, 4(3): e00231-19. |
| [21] |
Tashiro Y, Monson RE, Ramsay JP, Salmond GPC. Molecular genetic and physical analysis of gas vesicles in buoyant enterobacteria[J]. Environmental Microbiology, 2016, 18(4): 1264-1276. DOI:10.1111/1462-2920.13203 |
| [22] |
Hwang K, Choe H, Nasir A, Kim KM. Complete genome of Polaromonas vacuolata KCTC 22033T isolated from beneath Antarctic Sea ice[J]. Marine Genomics, 2021, 55: 100790. DOI:10.1016/j.margen.2020.100790 |
| [23] |
Ramsay JP, Williamson NR, Spring DR, Salmond GPC. A quorum-sensing molecule acts as a morphogen controlling gas vesicle organelle biogenesis and adaptive flotation in an enterobacterium[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(36): 14932-14937. DOI:10.1073/pnas.1109169108 |
| [24] |
Park J, Kim KW. Microscopy of microbial gas vesicles[J]. Applied Microscopy, 2017, 47(3): 165-170. DOI:10.9729/AM.2017.47.3.165 |
| [25] |
Lee CM, Monson RE, Adams RM, Salmond GPC. The LacI-family transcription factor, RbsR, is a pleiotropic regulator of motility, virulence, siderophore and antibiotic production, gas vesicle morphogenesis and flotation in Serratia[J]. Frontiers in Microbiology, 2017, 8: 1678. DOI:10.3389/fmicb.2017.01678 |
| [26] |
Quintero-Yanes A, Lee CM, Monson R, Salmond G. The FloR master regulator controls flotation, virulence and antibiotic production in Serratia sp. ATCC 39006[J]. Environmental Microbiology, 2020, 22(7): 2921-2938. DOI:10.1111/1462-2920.15048 |
| [27] |
Quintero-Yanes A, Monson RE, Salmond GPC. Environmental potassium regulates bacterial flotation, antibiotic production and turgor pressure in Serratia through the TrkH transporter[J]. Environmental Microbiology, 2019, 21(7): 2499-2510. DOI:10.1111/1462-2920.14637 |
| [28] |
Li N, Cannon MC. Gas vesicle genes identified in Bacillus megaterium and functional expression in Escherichia coli[J]. Journal of Bacteriology, 1998, 180(9): 2450-2458. DOI:10.1128/JB.180.9.2450-2458.1998 |
| [29] |
Eppinger M, Bunk B, Johns MA, Edirisinghe JN, Kutumbaka KK, Koenig SSK, Creasy HH, Rosovitz MJ, Riley DR, Daugherty S, et al. Genome sequences of the biotechnologically important Bacillus megaterium strains QM B1551 and DSM319[J]. Journal of Bacteriology, 2011, 193(16): 4199-4213. DOI:10.1128/JB.00449-11 |
| [30] |
Van Keulen G, Hopwood DA, Dijkhuizen L, Sawers RG. Gas vesicles in actinomycetes: old buoys in novel habitats?[J]. Trends in Microbiology, 2005, 13(8): 350-354. DOI:10.1016/j.tim.2005.06.006 |
| [31] |
Van Keulen G. Gas vesicles in actinomycetes: not simply a case of flotation in water-logged soil[A]//Shively JM. Complex Intracellular Structures in Prokaryotes. Vol. Microbiology Monographs[M]. Berlin, Heidelberg: Springer, 2006: 349-357
|
| [32] |
Walsby AE, Dunton PG. Gas vesicles in actinomycetes?[J]. Trends in Microbiology, 2006, 14(3): 99-100. DOI:10.1016/j.tim.2006.01.002 |
| [33] |
Karoonuthaisiri N, Weaver D, Huang JQ, Cohen SN, Kao CM. Regional organization of gene expression in Streptomyces coelicolor[J]. Gene, 2005, 353(1): 53-66. DOI:10.1016/j.gene.2005.03.042 |
| [34] |
Lee EJ, Karoonuthaisiri N, Kim HS, Park JH, Cha CJ, Kao CM, Roe JH. A master regulator σB governs osmotic and oxidative response as well as differentiation via a network of sigma factors in Streptomyces coelicolor[J]. Molecular Microbiology, 2005, 57(5): 1252-1264. DOI:10.1111/j.1365-2958.2005.04761.x |
| [35] |
Sundararajan A, Ju LK. Use of cyanobacterial gas vesicles as oxygen carriers in cell culture[J]. Cytotechnology, 2006, 52(2): 139-149. |
| [36] |
Song L, Wang GH, Hou XD, Kala S, Qiu ZH, Wong KF, Cao F, Sun L. Biogenic nanobubbles for effective oxygen delivery and enhanced photodynamic therapy of cancer[J]. Acta Biomaterialia, 2020, 108: 313-325. DOI:10.1016/j.actbio.2020.03.034 |
| [37] |
Hill AM, Salmond GPC. Microbial gas vesicles as nanotechnology tools: exploiting intracellular organelles for translational utility in biotechnology, medicine and the environment[J]. Microbiology, 2020, 166(6): 501-509. DOI:10.1099/mic.0.000912 |
| [38] |
Andar AU, Karan R, Pecher WT, DasSarma P, Hedrich WD, Stinchcomb AL, DasSarma S. Microneedle-assisted skin permeation by nontoxic bioengineerable gas vesicle nanoparticles[J]. Molecular Pharmaceutics, 2017, 14(3): 953-958. DOI:10.1021/acs.molpharmaceut.6b00859 |
| [39] |
Fernando A, Gariépy J. Coupling Chlorin e6 to the surface of Nanoscale Gas Vesicles strongly enhances their intracellular delivery and photodynamic killing of cancer cells[J]. Scientific Reports, 2020, 10(1): 2802. DOI:10.1038/s41598-020-59584-1 |
| [40] |
Shapiro MG, Goodwill PW, Neogy A, Yin M, Foster FS, Schaffer DV, Conolly SM. Biogenic gas nanostructures as ultrasonic molecular reporters[J]. Nature Nanotechnology, 2014, 9(4): 311-316. DOI:10.1038/nnano.2014.32 |
| [41] |
Bourdeau RW, Lee-Gosselin A, Lakshmanan A, Farhadi A, Kumar SR, Nety SP, Shapiro MG. Acoustic reporter genes for noninvasive imaging of microorganisms in mammalian hosts[J]. Nature, 2018, 553(7686): 86-90. DOI:10.1038/nature25021 |
| [42] |
Lu GJ, Farhadi A, Szablowski JO, Lee-Gosselin A, Barnes SR, Lakshmanan A, Bourdeau RW, Shapiro MG. Acoustically modulated magnetic resonance imaging of gas-filled protein nanostructures[J]. Nature Materials, 2018, 17(5): 456-463. DOI:10.1038/s41563-018-0023-7 |
| [43] |
Lakshmanan A, Jin ZY, Nety SP, Sawyer DP, Lee-Gosselin A, Malounda D, Swift MB, Maresca D, Shapiro MG. Acoustic biosensors for ultrasound imaging of enzyme activity[J]. Nature Chemical Biology, 2020, 16(9): 988-996. DOI:10.1038/s41589-020-0591-0 |
| [44] |
Li JJ, Liao R, Tao Y, Zhuo ZP, Liu ZD, Deng HB, Ma H. Probing the cyanobacterial Microcystis gas vesicles after static pressure treatment: a potential in situ rapid method[J]. Sensors, 2020, 20(15): 4170. DOI:10.3390/s20154170 |
 2021, Vol. 48
2021, Vol. 48




