扩展功能
文章信息
- 雷曦, 张蕊, 黄遵锡, 周峻沛
- LEI Xi, ZHANG Rui, HUANG Zunxi, ZHOU Junpei
- 透明质酸酶的研究进展
- Research progress of hyaluronidases
- 微生物学通报, 2021, 48(3): 882-895
- Microbiology China, 2021, 48(3): 882-895
- DOI: 10.13344/j.microbiol.china.200486
-
文章历史
- 收稿日期: 2020-05-18
- 接受日期: 2020-08-27
- 网络首发日期: 2020-12-09
2. 生物能源持续开发利用教育部工程中心 云南 昆明 650500;
3. 云南省生物质能与环境生物技术重点实验室 云南 昆明 650500;
4. 云南省高校高原特色食品酶重点实验室 云南 昆明 650500
2. Engineering Research Center of Sustainable Development and Utilization of Biomass Energy, Ministry of Education, Kunming, Yunnan 650500, China;
3. Key Laboratory of Yunnan for Biomass Energy and Biotechnology of Environment, Kunming, Yunnan 650500, China;
4. Key Laboratory of Yunnan Provincial Education Department for Plateau Characteristic Food Enzymes, Kunming, Yunnan 650500, China
透明质酸酶(Hyaluronidase,HAase)是指能够将透明质酸(Hyaluronan或Hyaluronic acid,HA)及部分糖胺聚糖(Glycosaminoglycan,GAG)降解成二糖或小分子寡糖的一类糖苷酶。透明质酸酶可作为药物扩散剂,降解人体组织的透明质酸以增加其通透性,促进注射液的扩散;还可用于制备有生物活性的低分子量糖胺寡糖[1];也可用于降解动物皮革组织的糖胺聚糖,替代传统皮革制备工艺中石灰法,以降低环境污染[2]。
透明质酸酶在自然界分布广泛,从复杂的高等动物到低等的细菌中均已发现透明质酸酶。目前透明质酸酶的分类主要依据其来源和降解产物[3],但此分类方法与透明质酸酶结构和催化机制的关系未见综述;此外,透明质酸酶的酶学性质及其具有生物活性的降解产物也未见相关综述。为了深入理解透明质酸酶及透明质酸寡糖的研究现状和发展趋势,促进透明质酸酶的进一步开发利用,本文梳理了透明质酸酶的分类、结构和催化机理,归纳总结了透明质酸酶的酶活力测定方法、重组表达、酶学性质和应用。
1 透明质酸和透明质酸酶 1.1 透明质酸透明质酸又叫玻尿酸,是一种天然存在于生物体内的糖胺聚糖。透明质酸是由D-葡萄糖醛酸和N-乙酰-D-葡萄糖胺以β-1, 3糖苷键相连构成二糖单元,该二糖单元再以β-1, 4糖苷键连接形成多糖(图 1),其分子式为(C14H21NO11)n。透明质酸广泛存在于动物结缔组织中,如关节、软骨、皮肤、玻璃体、脐带、滑液、鸡冠、华顿胶以及A族和C族溶血性链球菌中,具有为动物机体提供韧性、作为软组织支持结构以及调节细胞代谢等重要功能[4]。透明质酸一般是无色无味的无定形固体,极易溶于水,不溶于有机溶剂。透明质酸分子在空间结构上呈刚性螺旋柱形,柱内侧的羟基连续定向排列,使透明质酸分子同时具有亲水和憎水特性,并使透明质酸分子在浓度很低时也可以形成三维网状结构,因此,透明质酸有超强的吸湿性、保水性和粘弹性,能亲和本身质量1 000倍的水分,是绝佳的天然保湿因子,常用于化妆品成分以及临床手术防粘连保护剂等领域[5]。
根据分子量的不同,可将透明质酸分为3类:高分子量(5×103-2×108 kD)、低分子量(10-50 kD)和寡聚透明质酸(10 kD以下)。透明质酸的生物活性与分子量的高低密切相关[6],高分子量透明质酸有较强的保水性,但缺乏生理活性,低分子量透明质酸具有促进骨和血管生成、促进伤口愈合、增强免疫调节等生理功能[7],而透明质酸酶解法是制备有生物活性低分子透明质酸的重要方法。
1.2 透明质酸酶透明质酸酶是一种内源性糖苷酶,可以降解透明质酸聚合物中的糖苷键。透明质酸酶于1929年被Duran等首次发现[8],来源于哺乳动物睾丸提取物,当时被称为“扩散因子”,因为其对疫苗、染料、毒素等物质的扩散具有促进作用。由于透明质酸酶分离纯化困难且对其功能的了解较少,导致透明质酸酶的研究长期处于相对停滞状态。近年来,透明质酸酶的研究已成为一个热点,其功能和性质被逐渐揭示,其应用,特别是在制药工业和临床医疗领域的应用被慢慢探明[9]。目前降解透明质酸的方法主要有物理降解法(包括超声降解、γ-射线辐射、加热降解、高压均质降解)和化学降解法(包括酸水解、碱水解、氧化降解)及酶降解法[10]。与物理和化学法相比,用透明质酸酶法制备低分子量或寡聚透明质酸,能更加特异性地降解化学键而不对其他分子基团产生影响,具有反应温和、重复性好、降解可控等优点,因此,挖掘更多新颖的透明质酸酶,以及更加深入地了解透明质酸酶的功能和性质具有重要的研究意义。
2 透明质酸酶的分类目前对透明质酸酶进行分类有4种方法。
第1种分类方法依据酶的来源,将透明质酸酶分为真核生物、原核生物和病毒透明质酸酶。例如,哺乳动物来源透明质酸酶主要发现于睾丸和各种身体组织中,如肝脏、肾脏、淋巴系统和皮肤[3]。在蛇、蜥蜴、蝎子和蜜蜂等动物毒液中也存在透明质酸酶[11]。在微生物中也发现了透明质酸酶,肺炎链球菌(Streptococcus pneumoniae)、无乳链球菌(Streptococcus agalactiae)和兽疫链球菌(Streptococcus zooepidemicus)来源的透明质酸裂解酶,是被研究最多且具有代表性的微生物透明质酸酶[12]。我们从土壤中筛选出多株具有透明质酸降解活性的菌株,经分离鉴定,发现了一株革兰氏阴性细菌弗氏柠檬酸杆菌(Citrobacter freundii)来源的透明质酸酶[13]。
第2种分类方法依据酶的最适反应pH值,将透明质酸酶分为酸性和中性透明质酸酶,如人类肝脏和血清及部分动物毒素来源的透明质酸酶最适pH值为3.0-4.0,属于酸性酶;而多数透明质酸酶的最适pH值为5.0-8.0,属于中性酶[14]。
第3种分类方法依据酶的专一性,将透明质酸酶划分为内切透明质酸氨基葡糖苷酶(Hyaluronoglucosaminidase,EC 3.2.1.35)、内切透明质酸葡糖醛酸酶(Hyaluronoglucuronidase,EC 3.2.1.36)和透明质酸裂解酶(Hyaluronate Lyase,EC 4.2.2.1),该分类方法是Meyer于1971年提出的,也是透明质酸酶最为经典的分类方法(图 1,https://enzyme.expasy.org/)。该分类方法依据透明质酸酶的专一性,同时与酶的来源和降解产物相关。第1类EC 3.2.1.35:以人、牛睾丸和蜂毒来源透明质酸酶为代表的氨基葡糖苷酶,该类酶属于糖苷水解酶类,可通过水解二糖单元间β-1, 4-糖苷键来降解透明质酸,一般以N-乙酰-D-葡萄糖胺为还原末端的透明质酸四糖或六糖为终产物[15]。第2类EC 3.2.1.36:以水蛭唾液腺来源透明质酸酶为代表的葡糖醛酸酶[16],该类酶也属于糖苷水解酶类,其水解二糖单元内β-1, 3-糖苷键降解透明质酸,从而产生具有葡萄糖醛酸还原性末端的寡糖,一般以透明质酸四糖为终产物[17]。第3类EC 4.2.2.1:以链球属来源透明质酸酶为代表, 该类酶属于裂解酶类,其通过裂解二糖单位间β-1, 4-糖苷键来降解透明质酸,生成不饱和二糖,即2-氨基乙酰-2-脱氧-3-O-(β-D-葡萄糖-4-烯吡喃糖醛酸-)D-葡萄糖[18],因而与前两类水解酶的作用机制和产物有明显区别。
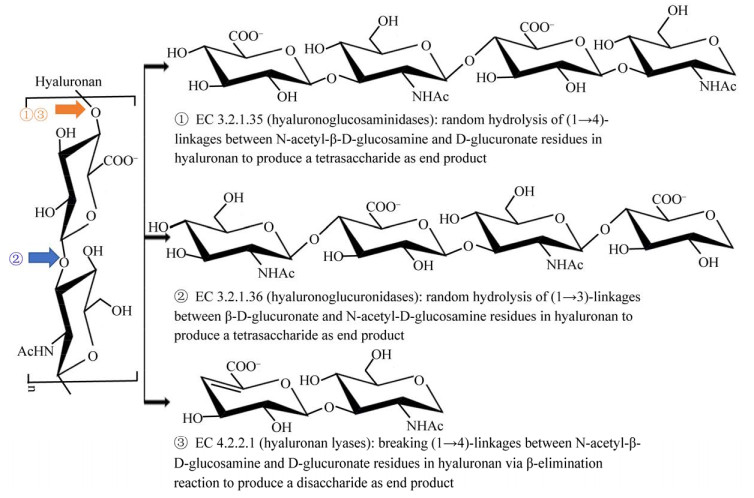
|
| 图 1 基于酶的专一性对透明质酸酶进行分类 Figure 1 Classification of hyaluronidases according to enzyme specificity |
|
|
第4种分类方法依据酶的氨基酸序列同源性,将透明质酸酶归类到不同的糖苷水解酶(Glycoside Hydrolase,GH)或多糖裂解酶(Polysaccharide Lyase,PL)家族(Carbohydrate-Active Enzymes Database,CAZy,表 1)。EC 3.2.1.35透明质酸酶分布于GH16、GH56和GH84家族,其中多数已报道的动物及其毒液来源透明质酸酶属于GH56家族[19];而产气荚膜梭菌来源GH84家族NagH和NagJ标注为透明质酸酶,但却没有明确的实验证明其目标底物确实是透明质酸[20]。EC 3.2.1.36透明质酸酶仅分布在GH79家族,均是水蛭来源酶(http://www.cazy.org/GH79_characterized.html)。EC 4.2.2.1透明质酸酶分布于PL8、PL16、PL30和PL31家族,其中多数已报道的细菌来源透明质酸酶属于PL8和PL16家族[21]。
| EC号 EC No. |
家族 Family |
结构 Structure |
典型结构 Typical structure |
催化基团 Catalytic active site |
催化机制 Catalytic mechanism |
| EC 3.2.1.35 | GH16 | β-jelly roll | - | 谷氨酸/谷氨酸(推测) Glu/Glu (inferred) |
保留机制 Retaining mechanism |
| GH56 | (β/α)7 | PDB ID: 2ATM[22] | 谷氨酸/天冬氨酸 Glu/Asp |
||
| GH84 | (β/α)8 | - | - | ||
| EC 3.2.1.36 | GH79 | (β/α)8 | - | 谷氨酸/谷氨酸(推测) Glu/Glu (inferred) |
|
| EC 4.2.2.1 | PL8 | (α/α)5/6 toroid + anti-parallel β-sheet | PDB ID: 1C82[23] | 组氨酸/酪氨酸,天冬酰胺 His/Tyr, Asn |
β-消除反应 β-elimination catalytic mechanism |
| PL16 | Triple strand β-helix | PDB ID: 4UFQ[24] | 精氨酸/酪氨酸,谷氨酰胺 Arg/Tyr, Gln |
||
| PL30 | - | - | - | ||
| PL31 | - | - | - | ||
| 注:PDB ID:RCSB蛋白数据库登录号;-:没有透明质酸酶晶体结构信息 Note: PDB ID: RCSB protein data bank identity number; -: No crystal structure information of hyaluronidase | |||||
透明质酸酶氨基酸序列同源性与其结构和催化机制密切相关。因此,本部分内容主要依据CAZy数据库分类进行阐述,该分类方式与酶专一性关系详见表 1。
透明质酸水解酶的整体结构类似,但催化机制存在差异。在结构方面,大多数透明质酸水解酶属于GH56、GH79和GH84,其整体结构类似于TIM折叠桶,仅β/α折叠片的数量存在差异[17, 25-26]。目前仅发现2个青霉(Penicillium spp.)来源透明质酸水解酶属于GH16家族,推测其结构类似于卷心β折叠桶[27]。在催化机制方面,糖苷水解酶的保留机制有4种类型,分别是经典保留机制、底物辅助保留机制、亲核试剂替代保留机制、NAD依赖保留机制(https://www.cazypedia.org/)。所有家族的透明质酸水解酶的催化机制都属于保留机制,但类型不同。GH16和GH79家族透明质酸酶是经典保留机制,其催化反应过程可参见脊椎动物透明质酸、β-葡聚糖酶或甘露聚糖酶综述[28-30]。GH56和GH84家族透明质酸酶是底物辅助保留机制,其催化反应过程可参见β-乙酰氨基葡糖糖苷酶的催化机制[26, 31]。
透明质酸裂解酶的结构差异显著,但催化机制相同。PL8家族透明质酸酶结构由环面(α/α)5/6螺旋桶和反向平行β-折叠片2个结构域构成,而PL16家族透明质酸酶结构由三链β-螺旋构成[23-24]。所有透明质酸裂解酶的催化机制均为顺式β-消除反应,其催化反应过程可参见肺炎链球菌来源透明质酸的β-消除反应机制研究[32-33]或含糖醛酸多糖裂解酶综述[21]。
4 透明质酸酶的性质 4.1 透明质酸酶活性测定方法透明质酸酶活性测定方法有物理法、化学法和生物指示法[34]。物理方法包括蛋白凝结抑制法、粘度法、比浊法;化学方法包括还原糖定量法、Morgan-Elson比色法、紫外分光光度法;生物指示法是指注射扩散效应法。目前实验研究中常使用的方法是比浊法、Morgan-Elson比色法和紫外分光光度法。前2种是比较经典和常用的方法,适用于各种透明质酸酶的活性测定[34]。紫外分光光度法仅用于测定透明质酸裂解酶的活性,其测定原理是依据降解产物中的双键在232 nm紫外光下有最大吸收值[35]。
4.2 透明质酸酶的重组表达原核生物来源的透明质酸酶通常在大肠杆菌(Escherichia coli)宿主中重组表达,少数真核生物来源的透明质酸酶也在大肠杆菌宿主中重组表达,但大多数真核生物来源的透明质酸酶常在毕赤酵母(Pichia pastoris)宿主中重组表达(表 2)。其中,水蛭来源透明质酸酶在毕赤酵母GS115表达宿主中获得最高的发酵产量(1.68×106 U/mL)。除上述2个常用的重组表达宿主外,一些透明质酸酶在中国仓鼠卵巢细胞(Chinese Hamster Ovary,CHO)[69]、昆虫细胞[70]、植物细胞[71]、兽疫链球菌[7]和杆状病毒[72]表达宿主中也成功获得表达。例如,在CHO细胞中获得了重组表达的人精液来源透明质酸酶rPH-20,该酶已通过美国食品及药物管理局(Food and Drug Administration,FDA)认证,现已用于医疗领域[73]。
| 来源 Source |
类别 Classification |
家族 Family |
宿主 Host |
最适pH Optimal pH |
最适温度 Optimal temperature (℃) |
比活 Specific activity (U/mg) |
底物特异性 Substrate specificity |
酶活测定方法 Measurement method |
| 人精液 Homo sapiens sperm[36] |
EC 3.2.1.35 | GH56 | P. pastoris | 5.0 | - | 0.23 | - | 比色法 Morgan-Elson colorimetry |
| 牦牛精液 Bos grunniens sperm[37] |
EC 3.2.1.35 | - | - | 3.8 | 37 | 42.3 | HA、CS和DS | 比色法 Morgan-Elson colorimetry |
| 猕猴精液 Macaca sp. sperm[38] |
EC 3.2.1.35 | - | - | 7.0 | 37 | - | - | - |
| 五步蛇毒液 Agkirtrodon status venom[39] |
EC 3.2.1.35 | - | - | 3.5-5.0 | 37 | 6 510.0 | - | 比浊法 Turbidimetry |
| 南美响尾蛇毒液 Crotalus durissus terrificus venom[40] |
EC 3.2.1.35 | GH56 | - | 5.5 | 37 | 5 066.0 | HA、CS和DS | 比浊法 Turbidimetry |
| 蝮蛇毒液 Bothrops atrox venom[41] |
EC 3.2.1.35 | GH56 | - | 6.0 | 40 | 437.5 | HA | 比浊法 Turbidimetry |
| 蜜蜂 Apis mellifera[42] |
EC 3.2.1.35 | - | P. pastoris | 3.8 | 62 | 0.024 | HA和CS | 比色法 Morgan-Elson colorimetry |
| 胡蜂毒液 Vespa affinis venom[25] |
EC 3.2.1.35 | GH56 | E. coli | 2.0 | 25 | - | - | 比浊法 Turbidimetry |
| 印度黑蝎毒素 Palamneus gravimanus venom[43] |
EC 3.2.1.35 | - | - | 4.5 | 37 | 6 411.7 | - | 比浊法 Turbidimetry |
| 巴西钳蝎毒液 Tityus serrulatus venom[44] |
EC 3.2.1.35 | GH56 | P. pastoris | 6.0 | 40 | 1 097.0 | HA、CS和DS | 比浊法 Turbidimetry |
| 蜘蛛毒液 Cupiennius salei venom[45] |
EC 3.2.1.35 | GH56 | E. coli | 4.5 | 50 | 3 115.0 | HA和CS | 比浊法 Turbidimetry |
| 漏斗网蜘蛛毒液 Hippasa partita venom[46] |
EC 3.2.1.35 | - | - | 5.8 | 37 | - | HA | 比色法 Morgan-Elson colorimetry |
| 蜘蛛毒液 Loxosceles intermedia venom[47] |
EC 3.2.1.35 | GH56 | E. coli | - | - | - | HA和CS | - |
| 海鳌虾 Nephrops norvegicus[48] |
EC 3.2.1.35 | - | - | 3.8-5.4 | 45 | - | HA | 比浊法 Turbidimetry |
| 淡水黄貂鱼毒液 Potamotrygon motoro venom[49] |
EC 3.2.1.35 | - | - | 4.2 | 40 | 1.3×108 | - | 比浊法 Turbidimetry |
| 石鱼毒液 Synanceia horrid venom[50] |
EC 3.2.1.35 | GH56 | - | 6.0 | 37 | 2 540.0 | HA | 比浊法 Turbidimetry |
| 石鱼毒液 Synanceia verrucose venom[51] |
EC 3.2.1.35 | GH56 | - | 6.6 | 37 | 1.6×106 | HA | 比浊法 Turbidimetry |
| 产紫青霉 Penicillium purpurogenum[52] |
EC 3.2.1.35 | GH16 | E. coli | 3.0 | 43 | - | - | 比色法 Morgan-Elson colorimetry |
| 水蛭 Hirudo sp.[53] |
EC 3.2.1.36 | GH79 | P. pastoris | 6.5 | 45 | 1.2×106 | HA | 二硝基水杨酸比色法 DNS colorimetry |
| 球形节杆菌A152 Arthrobacter globiformis A152[54] |
EC 4.2.2.1 | - | - | 6.0 | 42 | 297.2 | HA和CS | 紫外法 UV spectrophotometry |
| 芽孢杆菌A50 Bacillus sp. A50[55] |
EC 4.2.2.1 | PL8 | - | 6.5 | 44 | 1.0×104 | HA、CS和DS | 比浊法 Turbidimetry |
| 弗氏柠檬酸杆菌 Citrobacter freundii[56] |
EC 4.2.2.1 | - | - | 5.5 | 50 | - | HA和CS | 二硝基水杨酸比色法 DNS colorimetry |
| 细小杆菌H14 Microbacterium sp. H14[57] |
EC 4.2.2.1 | PL8 | E. coli | 7.0 | 40 | 278.3 | HA、CS和DS | 紫外法 UV spectrophotometry |
| 消化链球菌84H14S Peptostreptococcus sp. 84H14S[58] |
EC 4.2.2.1 | - | - | 7.2 | - | 7.6×105 | HA和CS | 比浊法 Turbidimetry |
| 疮疱丙酸杆菌 Propionibacterium acnes[59] |
EC 4.2.2.1 | - | - | 6.4 | - | 7.8×106 | HA和CS | 比色法 Morgan-Elson colorimetry |
| 无乳链球菌 Streptococcus agalactiae[60-61] |
EC 4.2.2.1 | PL8 | E. coli | 6.3 | 40 | 8.1×104 | HA、CS和DS | 比浊法 Turbidimetry |
| 停乳链球菌 Streptococcus dysgalactiae[62] |
EC 4.2.2.1 | - | - | 6.2 | 37 | 5 041.0 | - | 紫外法 UV spectrophotometry |
| 肺炎链球菌 Streptococcus pneumoniae[63] |
EC 4.2.2.1 | PL8 | E. coli | 6.0 | 37 | - | HA和CS | 紫外法 UV spectrophotometry |
| 乳房链球菌 Streptococcus uberis[64] |
EC 4.2.2.1 | - | - | 6.0 | 45 | 1 013.5 | - | 比浊法 Turbidimetry |
| 兽疫链球菌 Streptococcus zooepidemicus[65] |
EC 4.2.2.1 | PL8 | E. coli | 6.0 | 37 | 6.3×105 | - | 二硝基水杨酸比色法 DNS colorimetry |
| 弧菌FC509 Vibrio sp. FC509[66] |
EC 4.2.2.1 | PL8 | E. coli | 8.0 | 30 | 4.5×105 | HA和CS | 紫外法 UV spectrophotometry |
| 透明质酸链霉菌 Streptomyces hyalurolyticus[67] |
EC 4.2.2.1 | - | - | 5.0 | 60 | 6.4×104 | 比浊法 Turbidimetry |
|
| 共同链霉菌 Streptomyces koganeiensis[24] |
EC 4.2.2.1 | PL16 | E. coli | 7.0 | - | - | HA | 比浊法 Turbidimetry |
| 酿脓链球菌噬菌体 Streptococcus pyogenes bacteriophage[68] |
EC 4.2.2.1 | PL16 | E. coli | 5.5 | 37 | - | HA | 比色法 Morgan-Elson colorimetry |
| 注:HA:透明质酸;CS:硫酸软骨素;DS:硫酸皮肤素。比色法:在特定条件下每分钟降解透明质酸释放1 μmolN-乙酰-D-氨基葡萄糖所需要的酶量;比浊法:在特定条件下单位时间内降解一定量的透明质酸所需要的酶量(具体酶活力单位定义需参见表中引用参考文献);二硝基水杨酸比色法:在特定条件下每分钟降解透明质酸释放1 μmol还原糖所需要的酶量;紫外法:在特定条件下每分钟降解透明质酸形成1 μmol不饱和双键所需要的酶量 Note: HA: Hyaluronic acid; CS: Chondroitin sulfate; DS: Dermatan sulfate. Morgan-Elson colorimetry: The amount of enzyme required to degrade hyaluronan and release 1 μmol N-acetyl-D-glucosamine per minute under certain conditions; Turbidimetry: The amount of enzyme required to degrade hyaluronan under certain conditions (see references for the specific activity definition of each enzyme); DNS colorimetry: The amount of enzyme required to degrade hyaluronan and release 1 μmol reducing sugars per minute under certain conditions; UV spectrophotometry: The amount of enzyme required to degrade hyaluronan and release 1 μmol unsaturated double bond per minute under certain conditions | ||||||||
如表 2所示,不同来源透明质酸酶的性质有较大差异,酶反应最适pH大多偏酸性,主要在pH 3.5-7.0之间,大都在接近最适pH的条件下能保持相对稳定。然而,胡蜂(Vespa affinis)来源的透明质酸酶最适反应pH值为2.0,其在pH 4.0下处理1 h后便完全失活[25]。透明质酸酶最适反应温度主要分布在20-50 ℃,大都属于中低温酶,普遍在高于55 ℃时便会失活。但是,蜜蜂(Apis mellifera)来源的透明质酸酶具有较高的温度耐受性,该酶最适反应温度为62 ℃,在80 ℃下处理1 h后还剩30%活性[42]。
4.3.2 透明质酸酶的比活力酶比活力原是衡量酶纯度的指标,但同种纯化酶之间也可用来比较酶催化能力。关于透明质酸酶比活力大小的研究发现,透明质酸酶的活性主要分布在1.0×103-1.3×108 U/mg之间,但是由于不同的测定酶活力方法所对应的酶活定义不一样,例如比浊法是单位时间内降解一定量的透明质酸需要的酶量,还原糖法是单位时间内降解透明质酸形成1 μmol还原糖所需要的酶量,而紫外法是单位时间内降解透明质酸形成1 μmol不饱和双键所需的酶量,所以要统一比较透明质酸酶酶活性大小仍存在一定难度。Magalhães等[49]用比浊法检测从淡水黄貂鱼(Potamotrygon motoro)毒液中提取的透明质酸酶,分离纯化后该酶酶活高达1.3×108 U/mg,是目前EC 3.2.1.35类透明质酸酶表现出的最高活性。张娜等[53, 74]用还原糖法检测水蛭(Hirudo sp.)中提取纯化的透明质酸酶,其活性可达1.2×106 U/mg,是目前EC 3.2.1.36类透明质酸酶表现出的最高活性。王文爽等[66, 75]将弧菌(Vibrio sp.) FC509的透明质酸裂解酶进行异源表达,纯化透明质酸酶的比活为4.5×105 U/mg,是目前EC 4.2.2.1类透明质酸裂解酶用紫外法检测出的最高活性。
4.3.3 透明质酸酶的底物降解特异性大部分透明质酸酶除了降解透明质酸外,还能降解硫酸软骨素(Chondroitin Sulfate,CS)和硫酸皮肤素(Dermatan Sulfate,DS)等其他糖胺聚糖底物,但至今未发现能降解肝素的透明质酸酶[3]。不同EC类型的透明质酸酶在底物特异性上有区别(图 2)。EC 3.2.1.35和EC 4.2.2.1透明质酸酶的底物专一性低,多数可降解透明质酸和硫酸软骨素,如棕蜘蛛毒液和肺炎链球菌(S. pneumoniae)等[45]。除了降解上述2种底物外,芽孢菌(A50)来源透明质酸裂解酶还可降解硫酸皮肤素[55]。然而酿脓链球菌噬菌体(S. pyogenes Bacteriophage)和共同链霉菌(S. koganeiensis)来源透明质酸裂解酶仅能特异性降解透明质酸,不能降解硫酸软骨素[24, 68]。EC 3.2.1.36透明质酸酶具有较强的底物专一性,一般仅能降解透明质酸,而对其他糖胺聚糖没有活性[17]。
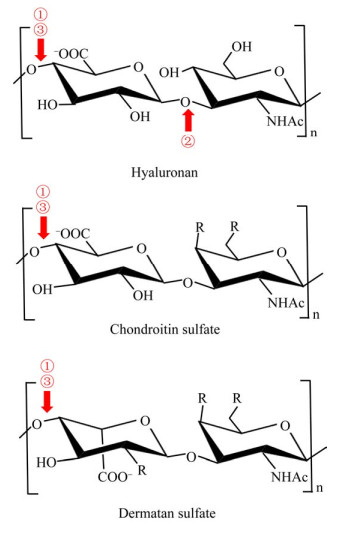
|
| 图 2 透明质酸酶的底物降解特异性 Figure 2 Substrate specificity of hyaluronidases 注:①:EC 3.2.1.35类型;②:EC 3.2.1.36类型;③:EC 4.2.2.1类型。R为–OH或–OSO3- Note: ①: EC 3.2.1.35; ②: EC 3.2.1.36; ③: EC 4.2.2.1. R indicates –OH or –OSO3- |
|
|
透明质酸酶被广泛应用于骨科、外科、眼科、内科、皮肤科、妇科等多个领域。由于透明质酸酶对组织中的透明质酸有解聚作用,导致透明质酸酶具有良好的促进药物扩散效果,所以其可作为药物注射添加剂以增强机体对药物的吸收效率,同时也可促进局部积血或积液的消散以达到消除血肿和水肿的作用[76]。在局部麻醉注射麻药时,与透明质酸酶联合用药可加快麻药的扩散,缩短麻醉起效的时间,减少局部浸润所致的肿胀。例如,在眼科手术中,透明质酸酶作为辅助剂可减少麻药的使用量,降低因麻药过多导致的结膜水肿及眼压升高的风险,加速麻药发挥效应的时间,加大扩散效率,提高手术的安全性[77]。
5.2 美容整形中的治疗作用透明质酸作为一种理想的软组织填充剂,在整形中常用于治疗皱纹、凹陷、萎缩等。但当滥用透明质酸注射时,可能引起过敏反应、皮下硬结、炎性肉水肿、血管栓塞致组织坏死等副作用[78]。特异性透明质酸酶可作为药物用于治疗注射透明质酸的术后并发症,特别是各类血管危象,防止血管栓塞。例如,当透明质酸进入眼动脉,容易造成视网膜中央动脉栓塞,从眼球后注射透明质酸酶能降解血管内及周围组织的透明质酸,从而达到治疗效果[79];出现因透明质酸引起的栓塞征兆时,可在诊断后及时使用高剂量透明质酸酶治疗[80];有临床实例在发现右眶下动脉阻塞和皮肤坏死的迹象时,及时对组织注射高剂量透明质酸酶,成功阻止了血管病情的恶化[81]。
5.3 工业制革中的应用在工业生产方面,透明质酸酶制剂可降解动物皮中糖胺聚糖类物质以分离生皮中的胶原纤维,联合其他生物酶制剂定量使用可去除蛋白多糖等纤维间质,使皮层中胶原纤维束适度松散,而皮革粒面可保持相对完整,因而透明质酸降解酶可作为皮革加工酶替代传统石灰浸灰松散动物皮革,以改进制革工艺,生产得到的皮革样品的在物理、化学、感官性能等指标上与常规石灰处理效果相似,但是酶法处理的排放物更容易降解,与传统石灰处理相比较,环境污染显著降低[2, 82]。
5.4 制备具有生物活性的寡糖近年来,糖胺寡糖制备及其生物活性的研究越来越受到人们的关注,而透明质酸酶是制备糖胺寡糖的重要酶之一(表 3)。许多研究表明,与高分子量糖胺聚糖相比,低分子量糖胺寡糖具有很强的抗氧化活性和细胞活性。在抗氧化方面,张莲[87]使用非特异性牛睾丸透明质酸酶降解硫酸软骨素,发现各个降解水平的寡糖产物对含氮自由基1, 1-二苯基-2-三硝基苯肼(1, 1-Diphenyl-2-Picrylhydrazyl,DPPH)的清除效果均优于高分子硫酸软骨素。在修复细胞损伤方面,Tolg等[84]通过划痕伤口试验和体内皮肤切除伤口修复实验,比较了天然大分子透明质酸、透明质酸低聚糖混合物(4-10糖)和特定大小透明质酸低聚糖(5 kD和40 kD)对成纤维细胞迁移的影响,结果显示透明质酸低聚糖混合物,特别是6糖和8糖具有更佳的促进伤口愈合和细胞修复的作用。在抑制细胞异常增殖方面,Jordan等[85]在体外培养膀胱肿瘤细胞时加入少量透明质酸酶降解的透明质酸二糖,结果显示该二糖对肿瘤细胞的增殖有明显抑制作用。在改善炎症方面,赵含丹等[89]在临床试验中使用透明质酸寡糖与高分子透明质酸,对68例慢性咽炎患者定时喷涂治疗,结果显示透明质酸寡糖比高分子透明质酸能更迅速有效地抑制咽喉部炎症,是治疗慢性咽炎的有效制剂。
| 寡糖类型 Oligosaccharide type |
寡糖制备方法 The method of oligosaccharides preparation |
功能 Function |
活性验证方法 The method of activity verification |
| 透明质酸不饱和二糖 Unsaturated HA disaccharide[83] |
芽孢杆菌透明质酸裂解酶酶解 Enzymolysis using Bacillus hyaluronate lyase |
抗氧化、抑制皮肤细胞氧化损伤 Antioxidant activity, inhibition of oxidative damage to skin cells |
细胞实验 Cell experiment |
| 透明质酸不饱和六糖和八糖 Unsaturated HA hexasaccharide and octasaccharide[84] |
链球菌透明质酸裂解酶酶解 Enzymolysis using Streptococcus hyaluronate lyase |
促进伤口愈合、增强细胞修复 Wound healing and cells repair enhancement |
细胞实验和小鼠伤口实验 Cell and mouse wound experiments |
| 透明质酸不饱和寡糖 Unsaturated HA oligosaccharides[62] |
芽孢杆菌透明质酸裂解酶酶解 Enzymolysis using Bacillus hyaluronate lyase |
具有强还原能力、修复紫外损伤细胞、降低细胞内活性氧自由基浓度 Strong reducing capacity, UV-damaged cells repair, intracellular superoxide radical concentration decrease |
体外抗氧化检测和细胞实验 In vitro antioxidant detection and cell experiments |
| 透明质酸二糖 HA disaccharides[85] |
透明质酸酶酶解 Enzymolysis using hyaluronidase |
抑制膀胱癌细胞增殖 Inhibition of bladder cancer cell proliferation |
细胞实验 Cell experiment |
| 透明质酸四糖和六糖 HA tetrasaccharide and hexasaccharide[86] |
水蛭透明质酸酶酶解 Enzymolysis using Leech hyaluronidase |
免疫增殖、促进血管生成、逆转肿瘤细胞耐药性 Immune proliferation, angiogenesis enhancement, drug resistance reverse of tumor cells |
细胞实验和小鼠注射 Cell experiment and mouse injection |
| 硫酸软骨素二、四、六糖 CS disaccharide, tetrasaccharide and hexasaccharide[87] |
牛睾丸透明质酸酶酶解 Enzymolysis using Bovine testis hyaluronidase |
抗氧化性 Antioxidant activity |
体外抗氧化检测 In vitro antioxidant detection |
| 硫酸软骨素四糖 CS tetrasaccharide[88] |
牛睾丸透明质酸酶酶解 Enzymolysis using Bovine testis hyaluronidase |
抑制细胞分泌炎症介质以达到抗炎作用 Inhibiting cells to secrete inflammatory mediators to achieve anti-inflammatory effects |
小鼠细胞模型试验 Mouse cell model experiment |
透明质酸酶是一类具有重要生理作用和应用价值的糖苷酶类。医疗中,透明质酸酶的安全性问题还需深入研究,可通过细胞试验或小鼠体内注射来检测其毒性。制革工业中,动物皮组织含有少量糖胺聚糖类物质,但其存在会严重影响皮胶原纤维的分离松散。针对透明质酸酶在制革中的应用研究,一方面需要进行更全面的应用实验,获得不同类型透明质酸酶的效用;另一方面还需要极大提高透明质酸酶产量以及改良其酶学性质,可利用酵母表达系统等对透明质酸酶进行异源表达以提高产量,可通过理性设计、定向进化等来改良透明质酸酶的性质。
动物来源的透明质酸酶已被应用于临床中促进药物扩散和吸收,但是从动物组织中提取透明质酸酶的生产方式成本过高,大规模制备较为困难。重组酶是提高产量、降低生产成本的重要途径。微生物来源的透明质酸酶不受来源限制,而且微生物已有成熟的异源表达模式,表达的酶提取容易,可高度纯化,因此不少学者更加倾向研究微生物透明质酸酶,或者使用微生物异源表达来生产透明质酸酶。自细菌透明质酸酶发现以来,已发现多种微生物可以产生透明质酸酶,但是目前仍存在酶活性相对较低、产量少、安全性未知、降解产物复杂及不明确等问题,限制了微生物来源透明质酸酶的工业化应用。
从自然界微生物中挖掘高活性透明质酸酶,分析酶的性质、功能,以及用酶解法制备寡糖并揭示其功能和安全性,是重要的研究方向。酶解透明质酸是制备透明质酸寡糖的重要方法,与物理和化学法相比,用透明质酸酶制备低分子透明质酸具有反应温和、重复性好、降解可控等优点。不同分子量寡糖具有不同作用,因此,将来可研究如何利用透明质酸酶制备八糖以上的低分子量透明质酸并测定其效用。
| [1] |
Tempestini-Horliana ACR, Lamers ML, Yonamine M, Aulestia-Viera PV, Dos Santos MF, Borsatti MA. Late hyaluronidase injection in local anesthesia: morphofunctional evaluation in rat sciatic nerve block[J]. Indian Journal of Dental Research, 2019, 30(5): 692-696. DOI:10.4103/ijdr.IJDR_745_16 |
| [2] |
Hu Y, Liu L, Dan WH, Dan NH. Bio-enzyme based fiber opening technology for greener leather processing[J]. China Leather, 2013, 42(15): 16-22. (in Chinese) 胡杨, 刘兰, 但卫华, 但年华. 基于生物酶制剂的绿色皮纤维分离松散技术[J]. 中国皮革, 2013, 42(15): 16-22. |
| [3] |
Wang WS, Wang JH, Li FC. Hyaluronidase and chondroitinase[A]//Atassi MZ. Protein Reviews[M]. Singapore: Springer, 2016: 75-87
|
| [4] |
Mai VQ, Vo TT, Meere M. Modelling hyaluronan degradation by Streptococcus pneumoniae hyaluronate lyase[J]. Mathematical Biosciences, 2018, 303: 126-138. DOI:10.1016/j.mbs.2018.07.002 |
| [5] |
Hoffman AS. Hydrogels for biomedical applications[J]. Advanced Drug Delivery Reviews, 2002, 54(1): 3-12. DOI:10.1016/S0169-409X(01)00239-3 |
| [6] |
Zhang HY. Expression of a hyaluronidase and preparation oligomers hyaluronate by enzymolysis[D]. Tianjin: Master's Thesis of Tianjin University of Science and Technology, 2016 (in Chinese) 张海洋. 透明质酸酶的表达及酶法制备低聚透明质酸[D]. 天津: 天津科技大学硕士学位论文, 2016 |
| [7] |
Wei CB, Du GC, Chen J, Kang Z. Construction of engineered Streptococcus zooepidemicus for the production of hyaluronic acid ligosaccharide[J]. Chinese Journal of Biotechnology, 2019, 35(5): 805-815. (in Chinese) 韦朝宝, 堵国成, 陈坚, 康振. 发酵透明质酸寡糖兽疫链球菌工程菌株的构建[J]. 生物工程学报, 2019, 35(5): 805-815. |
| [8] |
Zhang XJ, Gong QH. Research progress of specific hyaluronidases[J]. Journal of Qingdao University (Medical Sciences), 2018, 54(6): 750-752, 755. (in Chinese) 张晓娟, 宫倩红. 特异性透明质酸酶的研究进展[J]. 青岛大学学报: 医学版, 2018, 54(6): 750-752, 755. |
| [9] |
Buhren BA, Schrumpf H, Hoff NP, Bölke E, Hilton S, Gerber PA. Hyaluronidase: from clinical applications to molecular and cellular mechanisms[J]. European Journal of Medical Research, 2016, 21(1): 5. DOI:10.1186/s40001-016-0201-5 |
| [10] |
Chen HY, Qin J, Hu Y. Efficient degradation of high-molecular-weight hyaluronic acid by a combination of ultrasound, hydrogen peroxide, and copper ion[J]. Molecules, 2019, 24(3): 617. DOI:10.3390/molecules24030617 |
| [11] |
Liu YK. Protein components analysis and functions of four bee venom[D]. Harbin: Master's Thesis of Harbin University of Commerce, 2019 (in Chinese) 刘印康. 四种蜂毒的蛋白成分解析及其功效研究[D]. 哈尔滨: 哈尔滨商业大学硕士学位论文, 2019 |
| [12] |
Dangi SK, Yadav PK, Mashooq M, Agarwal RK, Nagaleekar VK. Cloning and expression analysis of nagJ hyaluronidase gene of Clostridium chauvoei[J]. Indian Journal of Animal Sciences, 2018, 88(3): 304-306. |
| [13] |
Lei X, Zhou JP, Huang ZX, Ding L, Zhang R. Screening and identification of glycosaminoglycan degradation strains[J]. Journal of Microbiology, 2020, 40(3): 22-27. (in Chinese) 雷曦, 周峻沛, 黄遵锡, 丁琳, 张蕊. 糖胺聚糖降解菌株的筛选及鉴定[J]. 微生物学杂志, 2020, 40(3): 22-27. |
| [14] |
Girish KS, Kemparaju K. The magic glue hyaluronan and its eraser hyaluronidase: a biological overview[J]. Life Sciences, 2007, 80(21): 1921-1943. DOI:10.1016/j.lfs.2007.02.037 |
| [15] |
Cramer JA, Bailey LC, Bailey CA, Miller RT. Kinetic and mechanistic studies with bovine testicular hyaluronidase[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 1994, 1200(3): 315-321. DOI:10.1016/0304-4165(94)90173-2 |
| [16] |
Linker A, Hoffman P, Meyer K. The hyaluronidase of the leech: an endoglucuronidase[J]. Nature, 1957, 180(4590): 810-811. DOI:10.1038/180810b0 |
| [17] |
Jin P, Kang Z, Zhang N, Du GC, Chen J. High-yield novel leech hyaluronidase to expedite the preparation of specific hyaluronan oligomers[J]. Scientific Reports, 2014, 4: 4471. |
| [18] |
Rigden DJ, Littlejohn JE, Joshi HV, De Groot BL, Jedrzejas MJ. Alternate structural conformations of Streptococcus pneumoniae hyaluronan lyase: insights into enzyme flexibility and underlying molecular mechanism of action[J]. Journal of Molecular Biology, 2006, 358(4): 1165-1178. DOI:10.1016/j.jmb.2006.02.066 |
| [19] |
Marković-Housley Z, Miglierini G, Soldatova L, Rizkallah PJ, Müller U, Schirmer T. Crystal structure of hyaluronidase, a major allergen of bee venom[J]. Structure, 2000, 8(10): 1025-1035. DOI:10.1016/S0969-2126(00)00511-6 |
| [20] |
Pluvinage B, Massel PM, Burak K, Boraston AB. Structural and functional analysis of four family 84 glycoside hydrolases from the opportunistic pathogen Clostridium perfringens[J]. Glycobiology, 2020, 30(1): 58-68. DOI:10.1093/glycob/cwz069 |
| [21] |
Garron ML, Cygler M. Structural and mechanistic classification of uronic acid-containing polysaccharide lyases[J]. Glycobiology, 2010, 20(12): 1547-1573. DOI:10.1093/glycob/cwq122 |
| [22] |
Skov LK, Seppälä U, Coen JJF, Crickmore N, King TP, Monsalve R, Kastrup JS, Spangfort MD, Gajhede M. Structure of recombinant Ves v 2 at 2.0 Ả resolution: structural analysis of an allergenic hyaluronidase from wasp venom[J]. Acta Crystallographica Section D Biological Crystallography, 2006, 62(6): 595-604. DOI:10.1107/S0907444906010687 |
| [23] |
Ponnuraj K, Jedrzejas MJ. Mechanism of hyaluronan binding and degradation: structure of Streptococcus pneumoniae hyaluronate lyase in complex with hyaluronic acid disaccharide at 1.7 Ả resolution[J]. Journal of Molecular Biology, 2000, 299(4): 885-895. DOI:10.1006/jmbi.2000.3817 |
| [24] |
Messina L, Gavira JA, Pernagallo S, Unciti-Broceta JD, Martin RMS, Diaz-Mochon JJ, Vaccaro S, Conejero-Muriel M, Pineda-Molina E, Caruso S, et al. Identification and characterization of a bacterial hyaluronidase and its production in recombinant form[J]. FEBS Letters, 2016, 590(14): 2180-2189. DOI:10.1002/1873-3468.12258 |
| [25] |
Rungsa P, Janpan P, Saengkun Y, Jangpromma N, Klaynongsruang S, Patramanon R, Uawonggul N, Daduang J, Daduang S. Heterologous expression and mutagenesis of recombinant Vespa affinis hyaluronidase protein (rVesA2)[J]. Journal of Venomous Animals and Toxins Including Tropical Diseases, 2019, 25(21): e20190030. |
| [26] |
Zhang R, Zhou JP, Song ZF, Huang ZX. Enzymatic properties of β-N-acetylglucosaminidases[J]. Applied Microbiology and Biotechnology, 2018, 102(1): 93-103. DOI:10.1007/s00253-017-8624-7 |
| [27] |
Viborg AH, Terrapon N, Lombard V, Michel G, Czjzek M, Henrissat B, Brumer H. A subfamily roadmap of the evolutionarily diverse glycoside hydrolase family 16 (GH16)[J]. Journal of Biological Chemistry, 2019, 294(44): 15973-15986. DOI:10.1074/jbc.RA119.010619 |
| [28] |
Zhang R, Zhu H, Zhou JP, Huang ZX. Research progress on molecular biology of β-mannanases[J]. Journal of Agricultural Science and Technology, 2018, 20(5): 34-46. (in Chinese) 张蕊, 朱虹, 周峻沛, 黄遵锡. β-甘露聚糖酶分子生物学研究进展[J]. 中国农业科技导报, 2018, 20(5): 34-46. |
| [29] |
Planas A. Bacterial 1, 3-1, 4-β-glucanases: structure, function and protein engineering[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2000, 1543(2): 361-382. DOI:10.1016/S0167-4838(00)00231-4 |
| [30] |
Jedrzejas MJ, Stern R. Structures of vertebrate hyaluronidases and their unique enzymatic mechanism of hydrolysis[J]. Proteins-structure Function and Bioinformatics, 2005, 61(2): 227-238. DOI:10.1002/prot.20592 |
| [31] |
Chen XD, Wang FS, Xiao M. β-N-Acetylhexosaminidases and their application in the synthesis of β-N-acetyl-D-hexosaminides[J]. Acta Microbiologica Sinica, 2017, 57(8): 1189-1205. (in Chinese) 陈晓迪, 王凤山, 肖敏. β-N-乙酰氨基己糖苷酶及其合成寡糖的研究进展[J]. 微生物学报, 2017, 57(8): 1189-1205. |
| [32] |
Jedrzejas MJ, Mello LV, De Groot BL, Li SL. Mechanism of hyaluronan degradation by Streptococcus pneumoniae hyaluronate lyase. Structures of complexes with the substrate[J]. Journal of Biological Chemistry, 2002, 277(31): 28287-28297. DOI:10.1074/jbc.M112009200 |
| [33] |
Li SL, Kelly SJ, Lamani E, Ferraroni M, Jedrzejas MJ. Structural basis of hyaluronan degradation by Streptococcus pneumoniae hyaluronate lyase[J]. EMBO Journal, 2000, 19(6): 1228-1240. DOI:10.1093/emboj/19.6.1228 |
| [34] |
Wang N, Guo XP, Luan YH, Shi YL. Hyaluronidase from microorganisms[J]. Food and Drug, 2007, 9(9): 40-44. (in Chinese) 王娜, 郭学平, 栾贻宏, 石艳丽. 微生物来源的透明质酸酶[J]. 食品与药品, 2007, 9(9): 40-44. DOI:10.3969/j.issn.1672-979X.2007.09.014 |
| [35] |
Kurata A, Matsumoto M, Kobayashi T, Deguchi S, Kishimoto N. Hyaluronate lyase of a deep-sea Bacillus niacini[J]. Marine Biotechnology, 2015, 17(3): 277-284. DOI:10.1007/s10126-015-9618-z |
| [36] |
Chen KJ, Sabrina S, El-Safory NS, Lee GC, Lee CK. Constitutive expression of recombinant human hyaluronidase PH20 by Pichia pastoris[J]. Journal of Bioscience and Bioengineering, 2016, 122(6): 673-678. DOI:10.1016/j.jbiosc.2016.06.007 |
| [37] |
Li RR. Isolation, characterization and mechanism of hyaluronate degrdation by hyaluronidase from Yak (Bos grunniens) testis[D]. Lanzhou: Doctoral Dissertation of Gansu Agricultural University, 2015 (in Chinese) 李儒仁. 牦牛睾丸透明质酸酶分离纯化、酶学性质及其降解透明质酸的机理[D]. 兰州: 甘肃农业大学博士学位论文, 2015 |
| [38] |
Li MW, Yudin AI, Robertson KR, Cherr GN, Overstreet JW. Importance of glycosylation and disulfide bonds in hyaluronidase activity of macaque sperm surface PH-20[J]. Journal of Andrology, 2002, 23(2): 211-219. |
| [39] |
Xu X, Wang XS, Xi XT, Liu J, Huang JT, Lu ZX. Purification and partial characterization of hyaluronidase from five pace snake (Agkistrodon acutus) venom[J]. Toxicon, 1982, 20(6): 973-981. DOI:10.1016/0041-0101(82)90099-X |
| [40] |
Bordon KCF, Perino MG, Giglio JR, Arantes EC. Isolation, enzymatic characterization and antiedematogenic activity of the first reported rattlesnake hyaluronidase from Crotalus durissus terrificus venom[J]. Biochimie, 2012, 94(12): 2740-2748. DOI:10.1016/j.biochi.2012.08.014 |
| [41] |
Vivas-Ruiz DE, Gonzalez-Kozlova EE, Delgadillo J, Palermo PM, Sandoval GA, Lazo F, Rodríguez E, Chávez-Olórtegui C, Yarlequé A, Sanchez EF. Biochemical and molecular characterization of the hyaluronidase from Bothrops atrox Peruvian snake venom[J]. Biochimie, 2019, 162: 33-45. DOI:10.1016/j.biochi.2019.03.022 |
| [42] |
Reitinger S, Boroviak T, Laschober GT, Fehrer C, Müllegger J, Lindner H, Lepperdinger G. High-yield recombinant expression of the extremophile enzyme, bee hyaluronidase in Pichia pastoris[J]. Protein Expression and Purification, 2008, 57(2): 226-233. DOI:10.1016/j.pep.2007.10.001 |
| [43] |
Morey SS, Kiran KM, Gadag JR. Purification and properties of hyaluronidase from Palamneus gravimanus (Indian black scorpion) venom[J]. Toxicon, 2006, 47(2): 188-195. DOI:10.1016/j.toxicon.2005.10.014 |
| [44] |
Amorim FG, Boldrini-França J, De Castro Figueiredo Bordon K, Cardoso IA, De Pauw E, Quinton L, Kashima S, Arantes EC. Heterologous expression of rTsHyal-1: the first recombinant hyaluronidase of scorpion venom produced in Pichia pastoris system[J]. Applied Microbiology and Biotechnology, 2018, 102(1): 3145-3158. DOI:10.1007/s00253-018-8821-z |
| [45] |
Biner O, Trachsel C, Moser A, Kopp L, Langenegger N, Kämpfer U, Von Ballmoos C, Nentwig W, Schürch S, Schaller J, et al. Isolation, N-glycosylations and function of a hyaluronidase-like enzyme from the venom of the spider Cupiennius salei[J]. PLoS One, 2015, 10(12): e0143963. DOI:10.1371/journal.pone.0143963 |
| [46] |
Nagaraju S, Devaraja S, Kemparaju K. Purification and properties of hyaluronidase from Hippasa partita (funnel web spider) venom gland extract[J]. Toxicon, 2007, 50(3): 383-393. DOI:10.1016/j.toxicon.2007.04.007 |
| [47] |
Ferrer VP, De Mari TL, Gremski LH, Silva DT, Da Silveira RB, Gremski W, Chaim OM, Senff-Ribeiro A, Nader HB, Veiga SS. A novel hyaluronidase from brown spider (Loxosceles intermedia) venom (dietrich's hyaluronidase): from cloning to functional characterization[J]. PLoS Neglected Tropical Diseases, 2013, 7(5): e2206. DOI:10.1371/journal.pntd.0002206 |
| [48] |
Krishnapillai AM, Taylor KDA, Morris AEJ, Quantick PC. Characterisation of norway lobster (Nephrops norvegicus) hyaluronidase and comparison with sheep and bovine testicular hyaluronidase[J]. Food Chemistry, 1999, 65(4): 515-521. DOI:10.1016/S0308-8146(98)00238-6 |
| [49] |
Magalhães MR, Da Silva Jr N, Ulhoa CJ. A hyaluronidase from Potamotrygon motoro (freshwater stingrays) venom: isolation and characterization[J]. Toxicon, 2008, 51(6): 1060-1067. DOI:10.1016/j.toxicon.2008.01.008 |
| [50] |
Poh CH, Yuen R, Chung MCM, Khoo HE. Purification and partial characterization of hyaluronidase from stonefish (Synanceja horrida) venom[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1992, 101(1/2): 159-163. |
| [51] |
Madokoro M, Ueda A, Kiriake A, Shiomi K. Properties and cDNA cloning of a hyaluronidase from the stonefish Synanceia verrucosa venom[J]. Toxicon, 2011, 58(4): 285-292. DOI:10.1016/j.toxicon.2011.07.014 |
| [52] |
Bakke M, Kamei JI, Obata A. Identification, characterization, and molecular cloning of a novel hyaluronidase, a member of glycosyl hydrolase family 16, from Penicillium spp.[J]. FEBS Letters, 2011, 585(1): 115-120. DOI:10.1016/j.febslet.2010.11.021 |
| [53] |
Kang Z, Zhang N, Zhang YF. Enhanced production of leech hyaluronidase by optimizing secretion and cultivation in Pichia pastoris[J]. Applied Microbiology and Biotechnology, 2016, 100(2): 707-717. DOI:10.1007/s00253-015-7056-5 |
| [54] |
Zhu CL, Zhang JL, Li LY, Zhang J, Jiang YH, Shen ZP, Guan HS, Jiang XL. Purification and characterization of hyaluronate lyase from Arthrobacter globiformis A152[J]. Applied Biochemistry and Biotechnology, 2016, 182(1): 216-228. |
| [55] |
Guo XP. Study on the hyaluronidase from Bacillus sp. A50[D]. Jinan: Doctoral Dissertation of Shandong University, 2014 (in Chinese) 郭学平. 芽孢杆菌Bacillus sp. A50透明质酸酶的研究[D]. 济南: 山东大学博士学位论文, 2014 |
| [56] |
Lei X, Zhou JP, Huang ZX, Cen XL, Yang L, Zhang R. Identification of a hyaluronidase producing strain and its enzymatic properties[J]. Genomics and Applied Biology, 2020, 1-7. (in Chinese) 雷曦, 周峻沛, 黄遵锡, 岑潇龙, 杨露, 张蕊. 一株产透明质酸酶的菌株鉴定及酶学性质研究[J]. 基因组学与应用生物学, 2020, 1-7. |
| [57] |
Sun JH, Han X, Song GR, Gong QH, Yu WG. Cloning, expression, and characterization of a new glycosaminoglycan lyase from Microbacterium sp. H14[J]. Marine Drugs, 2019, 17(12): 681. DOI:10.3390/md17120681 |
| [58] |
Tam YC, Chan EC. Purification and characterization of hyaluronidase from oral Peptostreptococcus species[J]. Infection and Immunity, 1985, 47(2): 508-513. DOI:10.1128/IAI.47.2.508-513.1985 |
| [59] |
Ingham E, Holland KT, Gowland G, Cunliffe WJ. Purification and partial characterization of hyaluronate lyase (EC 4.2.2.1) from Propionibacterium acnes[J]. Journal of General Microbiology, 1979, 115(2): 411-418. DOI:10.1099/00221287-115-2-411 |
| [60] |
Jedrzejas MJ, Chantalat L. Structural studies of Streptococcus agalactiae hyaluronate lyase[J]. Acta Crystallographica Section D Biological Crystallography, 2000, 56(4): 460-463. DOI:10.1107/S0907444900000706 |
| [61] |
Ozegowski JH, Günther E, Reichardt W. Purification and characterization of hyaluronidase from Streptococcus agalactiae[J]. Zentralblatt für Bakteriologie, 1994, 280(4): 497-506. DOI:10.1016/S0934-8840(11)80509-8 |
| [62] |
Suzuki K, Terasaki Y, Uyeda M. Inhibition of hyaluronidases and chondroitinases by fatty acids[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2002, 17(3): 183-186. DOI:10.1080/14756360290032930 |
| [63] |
Jedrzejas MJ, Mewbourne RB, Chantalat L, McPherson DT. Expression and purification of Streptococcus pneumoniae hyaluronate lyase from Escherichia coli[J]. Protein Expression and Purification, 1998, 13(1): 83-89. DOI:10.1006/prep.1997.0864 |
| [64] |
Schaufuss P, Sting R, Schaeg W, Blobel H. Isolation and characterization of hyaluronidase from Streptococcus uberis[J]. Zentralblatt für Bakteriologie, 1989, 271(1): 46-53. DOI:10.1016/S0934-8840(89)80052-0 |
| [65] |
Chen YF. Expression, purification and enzymatic proporties of recombinant hyaluronidase[D]. Shanghai: Master's Thesis of Shanghai Institute of Technology, 2016 (in Chinese) 陈怡斐. 重组透明质酸酶的表达、纯化及其酶学性质研究[D]. 上海: 上海应用技术学院硕士学位论文, 2016 |
| [66] |
Han WJ, Wang WS, Zhao M, Kazuyuki S, Li FC. A novel eliminase from a marine bacterium that degrades hyaluronan and chondroitin sulfate[J]. Journal of Biological Chemistry, 2014, 289(40): 27886-27898. DOI:10.1074/jbc.M114.590752 |
| [67] |
Ohya T, Kaneko Y. Novel hyaluronidase from Streptomyces[J]. Biochimica et Biophysica Acta (BBA)-Enzymology, 1970, 198(3): 607-609. DOI:10.1016/0005-2744(70)90139-7 |
| [68] |
El-Safory NS, Lee GC, Lee CK. Characterization of hyaluronate lyase from Streptococcus pyogenes bacteriophage H4489A[J]. Carbohydrate Polymers, 2011, 84(3): 1182-1191. DOI:10.1016/j.carbpol.2011.01.019 |
| [69] |
Ren L. Expression and purification of rhPH-20 in CHO expression system[D]. Changchun: Master's Thesis of Jilin University, 2019 (in Chinese) 任璐. 重组人透明质酸酶在CHO表达系统中的表达及纯化研究[D]. 长春: 吉林大学硕士学位论文, 2019 |
| [70] |
Ng HC, Ranganathan S, Chua LK, Khoo HE. Cloning and molecular characterization of the first aquatic hyaluronidase, SFHYA1, from the venom of stonefish (Synanceja horrida)[J]. Gene, 2005, 346: 71-81. DOI:10.1016/j.gene.2004.09.024 |
| [71] |
Jung Y, Jung MY, Park JH, Jung GC, Hong YS, Yeom CH, Lee S. Production of human hyaluronidase in a plant-derived protein expression system: plant-based transient production of active human hyaluronidase[J]. Protein Expression and Purification, 2010, 74(2): 181-188. DOI:10.1016/j.pep.2010.06.003 |
| [72] |
Vigdorovich V, Strong RK, Miller AD. Expression and characterization of a soluble, active form of the jaagsiekte sheep retrovirus receptor, Hyal2[J]. Journal of Virology, 2005, 79(1): 79-86. DOI:10.1128/JVI.79.1.79-86.2005 |
| [73] |
Locke KW, Maneval DC, LaBarre MJ. ENHANZE® drug delivery technology: a novel approach to subcutaneous administration using recombinant human hyaluronidase PH20[J]. Drug Delivery, 2019, 26(1): 98-106. DOI:10.1080/10717544.2018.1551442 |
| [74] |
Zhang N. Enhanced expression of hyaluronidase via molecular modification and fermentation optimization[D]. Wuxi: Master's Thesis of Jiangnan University, 2015 (in Chinese) 张娜. 基于分子改造和发酵优化提高透明质酸酶的表达[D]. 无锡: 江南大学硕士学位论文, 2015 |
| [75] |
Wang WS. Screening, identification and application of novel glycosaminoglycan-degrading enzymes from marine bacteria[D]. Jinan: Doctoral Dissertation of Shandong University, 2017 (in Chinese) 王文爽. 海洋细菌来源的新型糖胺聚糖降解酶的筛选、鉴定与应用[D]. 济南: 山东大学博士学位论文, 2017 |
| [76] |
Han JH, Kim J, Yoon KC, Shin HW. Treatment of post-traumatic hematoma and fibrosis using hyaluronidase injection[J]. Archives of Craniofacial Surgery, 2018, 19(3): 218-221. DOI:10.7181/acfs.2017.01396 |
| [77] |
Abu Elyazed MM, Abdelghafar MS, Mogahed MM, Nassif MA. The effect of adding cisatracurium versus hyaluronidase to levobupivacaine and lidocaine mixture in single injection peribulbar block for cataract surgery[J]. Egyptian Journal of Anaesthesia, 2017, 33(3): 245-250. DOI:10.1016/j.egja.2017.05.005 |
| [78] |
Chen ZX, Jiang CA, Liu K. Application of hyaluronidase in the treatment of hyaluronic acid injection induced complications[J]. Journal of Tissue Engineering and Reconstructive Surgery, 2017, 13(3): 175-177. (in Chinese) 陈筑昕, 蒋承安, 刘凯. 透明质酸酶在透明质酸软组织填充并发症治疗中的应用[J]. 组织工程与重建外科杂志, 2017, 13(3): 175-177. |
| [79] |
Pavlidis L, Spyropoulou GA, Deliligka A, Demiri E. Intravenous hyaluronidase with urokinase as treatment for arterial hyaluronic acid embolism[J]. Plastic and Reconstructive Surgery, 2016, 138(2): 370e-371e. DOI:10.1097/PRS.0000000000002377 |
| [80] |
Cohen JL, Biesman BS, Dayan SH, De Lorenzi C, Lambros VS, Nestor MS, Sadick N, Sykes J. Treatment of hyaluronic acid filler-induced impending necrosis with hyaluronidase: consensus recommendations[J]. Aesthetic Surgery Journal, 2015, 35(7): 844-849. DOI:10.1093/asj/sjv018 |
| [81] |
Loh KTD, Phoon YS, Phua V, Kapoor KM. Successfully managing impending skin necrosis following hyaluronic acid filler injection, using high-dose pulsed hyaluronidase[J]. Plastic and Reconstructive Surgery Global Open, 2018, 6(2): e1639. DOI:10.1097/GOX.0000000000001639 |
| [82] |
Zhou RQ, Shi B. Present applications and prospect of enzyme preparation in leather industry[J]. Leather Science and Engineering, 2003, 13(5): 24-30. (in Chinese) 周荣清, 石碧. 酶制剂在制革工业中的应用现状与展望[J]. 皮革科学与工程, 2003, 13(5): 24-30. |
| [83] |
Li Q. Study on the preparation and biological activities of 4, 5-unsaturated hyaluronate disaccharide[D]. Jinan: Master's Thesis of Shandong University, 2013 (in Chinese) 李强. 不饱和透明质酸二糖的制备和活性研究[D]. 济南: 山东大学硕士学位论文, 2013 |
| [84] |
Tolg C, Telmer P, Turley E. Specific sizes of hyaluronan oligosaccharides stimulate fibroblast migration and excisional wound repair[J]. PLoS One, 2015, 9(2): e88479. |
| [85] |
Jordan AR, Lokeshwar SD, Lopez LE, Hennig M, Chipollini J, Yates T, Hupe MC, Merseburger AS, Shiedlin A, Cerwinka WH, et al. Antitumor activity of sulfated hyaluronic acid fragments in pre-clinical models of bladder cancer[J]. Oncotarget, 2017, 8(15): 24262-24274. DOI:10.18632/oncotarget.10529 |
| [86] |
Lv MX. Study on the preparation and biological activities of hyaluronan tetrasaccharide and hexasaccharide[D]. Wuxi: Master's Thesis of Jiangnan University, 2016 (in Chinese) 吕梦娴. 透明质酸四糖和六糖的制备及生物活性研究[D]. 无锡: 江南大学硕士学位论文, 2016 |
| [87] |
Zhang L. Preparation and antioxidant activity in vitro of chondroitin sulfate oligosaccharides[D]. Wuxi: Master's Thesis of Jiangnan University, 2012 (in Chinese) 张莲. 硫酸软骨素寡糖的制备及其体外抗氧化活性研究[D]. 无锡: 江南大学硕士学位论文, 2012 |
| [88] |
Zhou SY. Isolation, characterization and bioactivity of heparinoids from swimming bladder[D]. Zhanjiang: Master's Thesis of Guangdong Ocean University, 2019 (in Chinese) 周斯仪. 鱼鳔类肝素的提取分离、结构表征及活性评价[D]. 湛江: 广东海洋大学硕士学位论文, 2019 |
| [89] |
Zhao HD, Hui MZ. Preliminary study on the treatment of chronic pharyngitis with bioactive hyaluronic acid fragments[J]. Clinical Journal of Medical Officers, 2014, 42(8): 864-865, 867. (in Chinese) 赵含丹, 惠觅宙. 生物活性透明质酸片段治疗慢性咽炎初步探讨[J]. 临床军医杂志, 2014, 42(8): 864-865, 867. DOI:10.3969/j.issn.1671-3826.2014.08.35 |
 2021, Vol. 48
2021, Vol. 48




