扩展功能
文章信息
- 孙菁兰, 朱玉章, 王华敏, 牛肖凡, 张健, 高强
- SUN Jinglan, ZHU Yuzhang, WANG Huamin, NIU Xiaofan, ZHANG Jian, GAO Qiang
- 大肠杆菌异源表达的Indigoidine与靛蓝的稳定性比较
- Comparison of stability between heterologous expressed indigoidine in Escherichia coli and indigo
- 微生物学通报, 2021, 48(1): 1-13
- Microbiology China, 2021, 48(1): 1-13
- DOI: 10.13344/j.microbiol.china.200325
-
文章历史
- 收稿日期: 2020-03-31
- 接受日期: 2020-08-03
- 网络首发日期: 2020-09-25
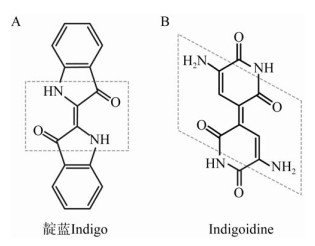
色素分为天然色素和合成色素,与合成色素相比,天然色素具有营养价值高、无毒副作用、来源安全等优点[1]。天然蓝色素主要来源于植物和微生物,植物源天然蓝色素主要有靛蓝(Indigo)、栀子蓝等[2]。某些种类的链霉菌(Streptomyces)、假单胞菌(Pseudomonas)等微生物能够产生天然蓝色素,如兼有抗菌作用的Indigoidine[3]和放线菌紫(红)素[2]。靛蓝是一种广泛用于食品、医药、印染和化妆品等行业的古老蓝色素[4] (图 1A)。天然靛蓝最初从木蓝、菘蓝、蓼蓝等植物中提取,目前可用微生物发酵的方法制备天然靛蓝[4-5]。靛蓝属还原类染料,难溶于水、稀酸和碱溶液,能够溶解于少数几种有机溶剂,如呋喃甲醛、N, N-二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)、硝基苯、呋喃、丙酮、氯仿等,而且稳定性较差,容易褪色[6-7]。靛蓝染色机理为:由于靛蓝难溶于水,将其变为隐色体盐形式(可溶于水)上染纺织物,随后纺织物上的靛蓝隐色体在空气中氧化为靛蓝[7-8]。
Indigoidine是一种无毒的细菌天然蓝色产物(图 1B)。Indigoidine合成酶(Indigoidine Synthetase)是非核糖体肽合成酶,经4′-磷酸泛酰巯基乙胺基转移酶(Phosphopantetheinyl Transferases,PPTase,EC2.7.8.7)活化,将微生物体内的2分子谷氨酰胺合成为1分子Indigoidine[9]。近年来,在某些种类的链霉菌中发现沉默的Indigoidine合成酶基因,可经其他宿主异源表达色素产物[10-11]。此外,在吸水链霉菌(S. hygroscopicus)中发现合成Indigoidine的非核糖体肽合成酶同时参与合成最小霉素(Minimycin)[12]。Indigoidine为非水溶性蓝色素,能够溶解于少数几种有机溶剂,如DMF、DMSO、四氢呋喃、吡啶、N-甲基吡咯烷酮等[9],还可被连二亚硫酸钠还原为隐色体形式[13-15]。该色素具有抗菌性[3]和氧化还原性,其清除自由基的能力使植物病原菌可耐受植物应激防御反应所分泌的过氧化物[16]。该色素明亮深邃的蓝色类似于靛蓝,能够作为新型天然蓝色素及染料应用于印染、食品和医药行业,已有报道其用于蛋白质类纤维织物的染色[17]。在分子生物学研究中,Indigoidine合成酶基因不仅可以作为标记基因构建筛选体系[11, 13, 18],还通过合成生物学技术使色素基因在玫瑰花中成功表达,将花瓣变成蓝色,为培育蓝色玫瑰提供了一种新思路[19]。Indigoidine色素分子具有的1.3 eV窄禁带及其他化学结构性质,使其具有作为有机半导体材料的潜能[20],在太阳能、信息记录和液晶材料等方面有广阔的开发应用前景。
目前已有文献报道Indigoidine合成酶基因在大肠杆菌(Escherichia coli)、谷氨酸棒杆菌(Corynebacterium glutamicum)和酵母(Yeast)中异源表达并发酵生产Indigoidine。Xu等[21]在大肠杆菌中异源表达来自色褐链霉菌(S. chromofuscus)的Indigoidine合成酶基因,同时过表达谷氨酰胺合成酶基因,优化后的摇瓶水平产量为8.81±0.21 g/L。徐捷[22]在谷氨酸棒杆菌(C. glutamicum)中异源表达来自淡紫灰链霉菌(S. lavendulae)的Indigoidine合成酶基因,优化后的摇瓶水平产量为1.75 g/L。Wehrs等[23]在酿酒酵母(Saccharomyces cerevisiae)中异源表达来自淡紫灰链霉菌的Indigoidine合成酶基因,以葡萄糖为碳源,通过分批补料发酵最终获得上罐产量为980 mg/L。随后,Wehrs等[24]在圆红冬孢酵母(Rhodosporidium toruloides)中异源表达来自淡紫灰链霉菌的Indigoidine合成酶基因,利用木质纤维素水解物作为碳源,经分批发酵获得上罐产量为2.91 g/L,利用葡萄糖作为碳源,经高浓度底物分批补料发酵获得上罐产量为86.3±7.4 g/L,这也是目前报道中最高的Indigoidine发酵产量。
靛蓝已成为市场上广泛工业化应用的一种蓝色素,目前对Indigoidine色素稳定性影响因素的研究较少,本实验将大肠杆菌(E. coli)中异源表达的Indigoidine与商品级靛蓝在相同条件下进行色素稳定性测试,进而对Indigoidine进行比较和评价。
1 材料与方法 1.1 材料 1.1.1 质粒和菌种质粒pCIMt002 (含有Indigoidine合成酶基因idgS和4′-磷酸泛酰巯基乙胺基转移酶基因sfp)由中国科学院微生物研究所陈义华研究员惠赠;E. coli-Staphylococci穿梭质粒pBT2-ET-5R-EGFP为本实验室前期构建[25];E. coli DH5α感受态为本实验室保藏。
1.1.2 培养基LB培养基(g/L):胰蛋白胨10.0,酵母浸粉5.0,氯化钠10.0,琼脂20.0 (固体培养基加入),1×105 Pa灭菌20 min。
1.1.3 主要试剂和仪器靛蓝(分析纯),天津市大茂化学试剂厂;N, N-二甲基甲酰胺(DMF,分析纯),天津市津东天正精细化学试剂厂;维生素C (Vc)、k3 (Vk3) (BR级),上海源叶生物技术有限公司;限制性内切酶Hind Ⅲ、Nhe Ⅰ和T4 DNA Ligase,宝生物工程(大连)有限公司;2×Rapid Taq Master Mix,南京诺唯赞生物科技有限公司;高纯质粒小量制备试剂盒、多功能DNA纯化回收试剂盒,天根生化科技(北京)有限公司。
紫外-可见分光光度计,北京普析通用仪器有限责任公司;pH计,梅特勒-托利多仪器有限公司;高速冷冻离心机,赛默飞世尔(中国)科技公司;MasterCycler Nexus PCR仪,Eppendorf公司。
1.2 方法 1.2.1 idgS-sfp基因的克隆及表达载体p28s的构建重组质粒构建流程如图 2所示。以pCIMt002质粒为模板,使用引物idgS-F (5′-CCCAAGCTTATGACTCTTCAGGAGACCAGC-3′)和sfp-R (5′-CTAGCTAGCTTATAAAAGCTCTTCGTACGAGACC-3′)扩增idgS-sfp基因,下划线为酶切位点。PCR反应体系:质粒DNA 2 μL,引物F和R (10 μmol/L)各2 μL,2×Rapid Taq Master Mix 25 μL,ddH2O 19 μL。PCR反应条件:98 ℃ 5 min;98 ℃ 30 s,55 ℃ 30 s,72 ℃ 2.5 min,30个循环;72 ℃ 10 min。PCR产物经琼脂糖电泳检测,纯化回收并测序分析。用Hind Ⅲ和Nhe Ⅰ限制性内切酶分别将目的基因idgS-sfp与质粒pBT2-ET-5R-EGFP双酶切,得到线性化目的片段和质粒载体,纯化回收,T4连接酶16 ℃连接过夜。

|
| 图 2 表达载体p28s和基因工程菌株E. coli DH5α/p28s的构建 Figure 2 Construction of the expression vector p28s and recombinant strain E. coli DH5α/p28s |
|
|
异源表达Indigoidine的基因工程菌E. coli DH5α/p28s构建流程如图 2所示。将连接产物用化学转化法转化至E. coli DH5α感受态中[26],涂布到含有0.1 mg/mL氨苄青霉素的LB抗性平板上进行筛选,37 ℃培养14 h后,变温28 ℃培养6 h,挑取菌落变为蓝色的转化子至上述抗性LB培养液的试管中,37 ℃、180 r/min培养10 h后,变温至28 ℃、180 r/min培养6 h,取适量蓝色菌液提取质粒,经Hind Ⅲ与Nhe Ⅰ双酶切鉴定及测序分析(测序委托苏州金唯智生物科技有限公司完成)。
1.2.3 色素发酵挑取单菌落E. coli DH5α/p28s接种到含有0.1 mg/mL氨苄青霉素的50 mL LB液体培养基中,37 ℃、180 r/min培养11 h,变温至28 ℃,180 r/min培养8-10 h。
1.2.4 色素溶液制备Indigoidine色素溶液:取发酵液12 000 r/min离心20 min弃上清,沉淀(菌体与Indigoidine色素的混合沉淀)依次用超纯水、甲醇重悬离心反复2次,向洗涤后的沉淀加入适量DMF,超声至溶剂颜色不再加深,12 000 r/min离心20 min,取上清,用DMF将其稀释至OD590为2.00±0.05,经0.22 μm有机微孔滤膜过滤,即为Indigoidine色素溶液。
靛蓝色素溶液:取适量靛蓝粉末溶解于DMF中稀释至OD610为2.00±0.05,即为靛蓝色素溶液。
1.2.5 色素保存率计算方法

|
式中ODλn、ODλck分别代表某条件处理后的色素溶液和对照色素溶液在λ处的吸光光度值,其中靛蓝色素溶液λ=610 nm,Indigoidine色素溶液λ=590 nm。以下实验均设置3个重复。
1.2.6 色素光谱特性将色素溶液置于1 cm光程的狭缝石英比色皿中,用紫外-可见分光光度计扫描色素溶液在200-800 nm区间的紫外-可见光吸收光谱,测得色素的最大吸收波长(λmax)。
1.2.7 紫外线对色素稳定性的影响两种色素溶液各取3 mL于EP管中,置于紫外灯下(功率8 W,照射距离25 cm,光照强度80 lx,25 ℃),在0-150 min的测量时间范围内,每30 min取样一次,记录相应ODλn,以初始0 h未被紫外线照射的色素溶液作为对照,计算色素保存率。
1.2.8 可见光对色素稳定性的影响两种色素溶液各取3 mL于EP管中,置于日光灯下(功率8 W,照射距离25 cm,光照强度800 lx,25 ℃),分别在第12 h和第24 h取样,记录相应ODλn,以初始0 h未被光照的色素溶液作为对照,计算色素保存率。
1.2.9 pH对色素稳定性的影响各取20 mL初始色素溶液,用1 mol/L HCl、2 mol/L HCl和2 mol/L NaOH分别调溶液至pH为1.0、3.0、5.0、7.0、9.0、11.0、13.0、≥14.0。混匀后室温避光静置0 h和12 h,记录相应ODλn,以0 h未调pH的初始色素溶液作为对照,计算色素保存率。
1.2.10 温度对色素稳定性的影响两种色素溶液各取3 mL于EP管中,以0 h未处理的色素溶液作为对照,计算色素保存率。温度因素设置3个实验组:
(1) 高温组:色素溶液分别置于45、60、75、90 ℃的恒温水浴锅中避光保温,每1 h取样一次,共取样4次,用自来水冷却至室温后记录相应的ODλn。
(2) 常温组:色素溶液分别置于16、28、37 ℃的生化培养箱中避光恒温存放,每12 h取样一次,共取样7次,恢复至室温后记录相应的ODλn。
(3) 低温组:色素溶液分别置于-80、-20、4 ℃冰箱中恒温避光存放,每12 h取样一次,共取样7次,恢复至室温后记录相应的ODλn。
1.2.11 氧化还原剂对色素稳定性的影响分别取1 mL 1%、2% (质量体积分数)的Vc、Vk3溶液,1%、2% (体积分数)的植酸、H2O2,蒸馏水加入到3 mL色素溶液中混匀,避光室温静置3 h,记录相应ODλn,以3 h时蒸馏水与色素溶液的混合液作为对照,计算色素保留率。
1.2.12 食品添加剂对色素稳定性的影响分别取500 μL 2% (质量体积分数)的甘露醇、山梨醇、葡萄糖、蔗糖、柠檬酸、苯甲酸、甘油和蒸馏水,加入到3 mL色素溶液中混匀,室温静置24 h和7 d,记录相应ODλn,再分别以对应24 h和7 d的蒸馏水与色素溶液的混合液作为对照,计算24 h和7 d的色素保存率。
1.2.13 金属离子对色素稳定性的影响分别使用NaCl、KCl、CaCl2、MgSO4、ZnSO4、LiCl、MnSO4、Al2(SO4)3、Pb(CH3COO)2、CuSO4、FeSO4、FeCl3配制0.05、0.2 mol/L的Na+、K+、Ca2+、Mg2+、Zn2+、Li+、Mn2+、Al3+、Pb2+、Cu2+、Fe2+、Fe3+溶液。分别取500 μL以上金属离子溶液和蒸馏水加入到3 mL色素溶液中混匀,室温避光静置4 h和24 h后,12 000 r/min离心10 min,取上清,记录相应ODλn,分别以对应4 h和24 h的蒸馏水与色素溶液的混合液作为对照,计算4 h和24 h的色素保留率。
2 结果与分析 2.1 表达载体p28s和基因工程菌E. coli DH5α/ p28s的构建质粒pCIMt002中idgS基因来自淡紫灰(薰衣草)链霉菌(S. lavendulae) CGMCC 4.1386[11],GenBank登录号为AHW58010;sfp基因来自枯草芽胞杆菌(Bacillus subtilis),GenBank登录号为X63158.1[11, 18, 27-28],UniProt登录号为P39135[19]。
以质粒pCIMt002为模板进行PCR扩增idgS-sfp基因,经电泳检测扩增片段条带约为4 581 bp,符合预期(图 3A),测序结果与pCIMt002的idgS-sfp基因序列匹配度为100%。抗性平板上单菌落变为蓝色的转化子初步判断为阳性转化子。双酶切验证电泳表明,重组质粒p28s经Hind Ⅲ与Nhe Ⅰ双酶切后呈现约为7 040 bp和4 575 bp的2条条带,符合预期(图 3B)。经测序比对,4 575 bp片段与pCIMt002的idgS-sfp基因序列匹配度为100%,而且重组菌落为蓝色,说明表达载体p28s和基因工程菌株E. coli DH5α/p28s均已构建成功。
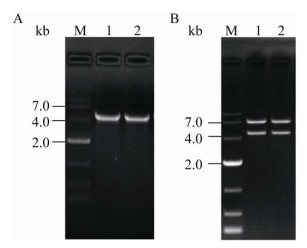
|
| 图 3 idgS-sfp基因PCR扩增(A)和p28s质粒双酶切验证(B) Figure 3 PCR amplification of idgS-sfp gene (A) and verification of expression vector p28s by double restriction enzyme digestion with Hind Ⅲ and Nhe I (B) 注:M:DL10000 DNA marker;A:1-2:idgS-sfp基因PCR产物;B:1-2:表达载体p28s的双酶切产物 Note: M: DL10000 DNA marker; A: 1-2: PCR product of idgS-sfp gene; B: 1-2: Double enzyme digestion product of expression vector p28s |
|
|
图 4表明,Indigoidine色素溶液在590 nm处有最大吸收峰λmax,与文献[18]报道一致。

|
| 图 4 Indigoidine色素全波长扫描光谱图 Figure 4 A full-wavelength scanning spectrogram of indigoidine |
|
|
如图 5所示,紫外线对2种色素都具有显著的破坏作用。两种色素在紫外环境下褪色明显,稳定性不佳,30 min后色素降解率都接近50%。

|
| 图 5 紫外线对色素的影响 Figure 5 The effect of ultraviolet light on the stability of indigoidine and indigo |
|
|
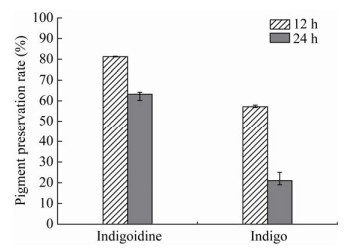
如图 6所示,2种色素在可见光光照条件下褪色明显,光稳定性不佳,但Indigoidine的光稳定性明显优于靛蓝。
|
| 图 6 可见光对色素的影响 Figure 6 The effect of visible light on the stability of indigoidine and indigo |
|
|
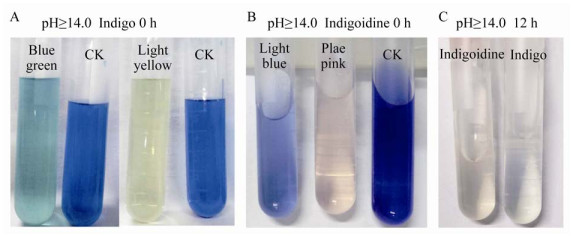
如图 7所示,以DMF为色素溶剂时,2种色素都在pH 1.0-11.0时稳定,一直呈现为初始的蓝色;在pH≥13.0时不稳定,发生明显的褪色现象,说明强碱性pH对2种色素都具有显著的破坏作用。Indigoidine在pH 13.0时为浅蓝色,但pH≥14.0时溶液先变为浅蓝色再变为淡粉色,12 h后溶液变为淡黄色。靛蓝在pH 13.0时为浅蓝色,但pH≥14.0时溶液先变为浅蓝绿色再变为浅黄色,12 h后溶液变为无色。两种色素溶液颜色变化如图 8所示。对于以上现象,酸性条件下DMF对2种色素的结构可能有保护作用,致使它们在pH 1.0-5.0时可保持原始的蓝色;对于Indigoidine在强碱性pH下褪色,是由于NaOH可致其发生分解[15]。

|
| 图 7 pH对色素的影响 Figure 7 The effect of different pH on the stability of indigoidine and indigo |
|
|
|
| 图 8 pH≥14.0时2种色素溶液颜色的变化 Figure 8 Color changes of the two pigment solutions at pH≥14.0 注:A:pH≥14.0,0 h时靛蓝色素溶液颜色变化;B:pH≥14.0,0 h时Indigoidine色素溶液颜色变化;C:pH≥14.0,12 h后2种色素溶液颜色变化 Note: A: Color change of indigo solution at pH≥14.0 at 0 h; B: Color change of indigoidine solution at pH≥14.0 at 0 h; C: Color change of the two pigment solutions at pH≥14.0 after 12 h |
|
|
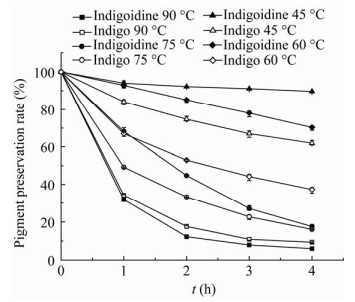
高温对2种色素均有较大程度的破坏,温度越高对色素的破坏程度越大。90、75 ℃保温4 h后,2种色素保存率分别低于10%、20%;60、45 ℃保温4 h后,Indigoidine的色素保存率(70.36%、89.72%)明显高于靛蓝的色素保存率(37.27%、61.93%),即2种色素热稳定性不佳,但在75 ℃以下时Indigoidine稳定性显著优于靛蓝(图 9)。
|
| 图 9 高温对色素的影响 Figure 9 The effect of high temperature on the stability of indigoidine and indigo |
|
|
常温组中,2种色素的保存率随着温度和时间的增加而降低,但Indigoidine在28 ℃恒温84 h的色素保存率(80.23%)远高于靛蓝在16、28 ℃恒温84 h的色素保存率(52.19%、38.84%)。说明在常温条件下Indigoidine的色素稳定性明显优于靛蓝(图 10)。

|
| 图 10 常温对色素的影响 Figure 10 The effect of ordinary temperature on the stability of indigoidine and indigo |
|
|
低温组中,2种色素在-80、-20 ℃保存84 h时,色素保存率都在95%以上。但4 ℃保存84 h时Indigoidine保存率为94.09%,明显高于靛蓝保存率的77.56%,即低温时色素稳定性Indigoidine显著优于靛蓝(图 11)。

|
| 图 11 低温对色素的影响 Figure 11 The effect of low temperature on the stability of indigoidine and indigo |
|
|
综上所述,Indigoidine色素溶液在75-90 ℃时热稳定性不佳,但在4-60 ℃的稳定性较好且优于靛蓝。
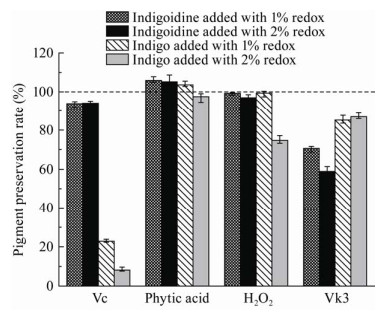
2.7 氧化还原剂对色素稳定性的影响如图 12所示,1%-2% Vc对Indigoidine有一定破坏作用但不显著。1% Vc对靛蓝影响极大,发生明显的褪色现象,3 h后色素保存率为22.82%;当Vc浓度增加到2%时,3 h后色素保存率仅为8.14%,溶液最终为浅黄色。Indigoidine与靛蓝相比,抗Vc还原能力更强。
|
| 图 12 氧化还原剂对色素的影响 Figure 12 The effect of oxidant and reductants on the stability of indigoidine and indigo |
|
|
1%-2%植酸对Indigoidine有较弱的护色效果。1%植酸对靛蓝有较弱的护色效果,但2%植酸使其色素保存率稍微降低,可能是植酸具有还原性,随着植酸浓度的增加,靛蓝色素被部分还原。
两种色素保存率都随H2O2和Vk3的浓度增大而降低,添加2% H2O2时,与Indigoidine相比,靛蓝的色素保存率降低显著,说明Indigoidine抗双氧水氧化作用强于靛蓝;而在添加1%-2% Vk3时,靛蓝的色素保存率明显大于Indigoidine,说明靛蓝抗Vk3氧化作用比Indigoidine更强。可能是双氧水和Vk3氧化机理不同,Indigoidine和靛蓝化学结构不同,导致两者表现出抵抗不同氧化剂的能力差异。
2.8 食品添加剂对色素稳定性的影响如图 13所示,总体上,甘油、山梨醇、甘露醇和蔗糖对2种色素没有显著的破坏作用,添加甘露醇7 d后对靛蓝具有较明显的护色效果,但添加葡萄糖7 d后2种色素溶液吸光度较对照均有所下降。如图 13和14A所示,苯甲酸对Indigoidine有明显的破坏作用,24 h后色素溶液变为淡粉紫色,但其对靛蓝有显著的护色效果,添加7 d后靛蓝的色素保存率为对照的3.26倍。如图 13和14B所示,柠檬酸对靛蓝有明显的破坏作用,24 h后色素溶液变为浅黄色,但其对Indigoidine有显著的护色效果,添加7 d后Indigoidine的色素保存率为对照的2.28倍。

|
| 图 13 食品添加剂对色素的影响 Figure 13 The effect of food additives on the stability of indigoidine and indigo |
|
|
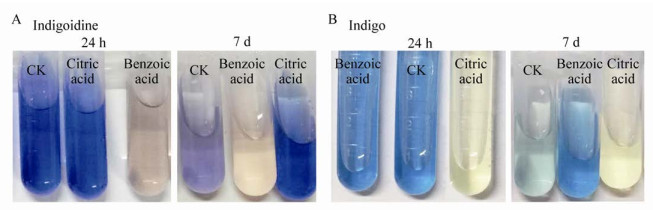
|
| 图 14 添加柠檬酸和苯甲酸24 h和7 d后Indigoidine (A)和靛蓝(B)溶液颜色的变化 Figure 14 Color changes of indigoidine (A) and indigo (B) solutions after adding citric acid or benzoic acid for 24 h and 7 d |
|
|
如图 15所示,对于这2种色素,Ca2+、Mg2+具有不同程度的护色效果,Na+、K+对Indigoidine没有破坏作用,但对靛蓝有较弱的护色效果。Mn2+处理4 h对Indigoidine具有较弱的护色效果,而处理24 h却有明显的破坏作用,但总体上对靛蓝具有微弱的护色效果。
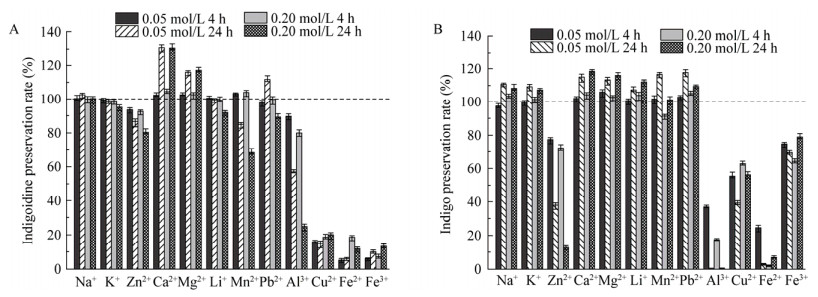
|
| 图 15 金属离子对Indigoidine (A)和靛蓝(B)的影响 Figure 15 The effect of metal ions on the stability of indigoidine (A) and indigo (B) |
|
|
Zn2+、Al3+、Cu2+、Fe2+、Fe3+对2种色素均具有明显的破坏作用。Zn2+、Al3+使色素褪色,最大吸收波长不移动,对靛蓝的破坏作用比Indigoidine更强。Cu2+、Fe2+、Fe3+使色素褪色,并伴随最大吸收波长的移动。Cu2+使2种色素溶液变为不同程度的蓝绿色,λmax移至770 nm。添加Fe2+则使2种色素溶液变为不同程度的橘黄色并产生橘黄色沉淀,λmax移至420 nm。添加Fe3+对Indigoidine的破坏作用比靛蓝更大,靛蓝溶液变为草绿色,是由于处理后的溶液λmax移至420 nm (黄色)处且λ=610 nm处仍有部分吸光度值,色素并未完全被破坏,所以2种颜色混合后溶液显示绿色,而Indigoidine色素溶液变为黄色,处理后的溶液λmax移至420 nm处且λ=590 nm处的吸光度值很低,色素几乎完全被破坏,所以溶液显示黄色。分别添加以上5种金属离子24 h后,2种色素溶液的颜色变化如图 16所示。

|
| 图 16 添加不同浓度Zn2+、Al3+、Cu2+、Fe2+、Fe3+离子24 h后Indigoidine (A)和靛蓝(B)色素溶液颜色的变化 Figure 16 Color changes of indigoidine (A) and indigo (B) solutions after adding different concentrations of Zn2+, Al3+, Cu2+, Fe2+, Fe3+ ions for 24 h, respectively |
|
|
Li+对Indigoidine几乎没有影响,但对靛蓝却具有较弱的护色效果。Pb2+使2种色素溶液都产生白色沉淀,离心后的上清色素溶液中,随Pb2+浓度增大和处理时间的增加,Indigoidine色素保存率明显下降,但靛蓝色素保存率略有增加。
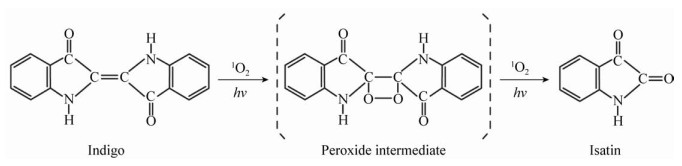
3 讨论可见光、紫外线、氧化剂(H2O2)、高温对Indigoidine和靛蓝2种色素均有不同程度的破坏,即色素最大吸收波长处的吸光值下降,色素部分或全部损失,说明色素的发色体(图 1)结构改变或被破坏。Galindo等[29]发现在紫外线和H2O2的联合作用下,生成具有强氧化作用的羟基自由基,导致靛蓝胭脂红发色体中间的C=C双键断裂,生成靛红磺酸,其继续被氧化成其他无色物质;Takeuchi等[30]发现臭氧导致靛蓝发色体中间的C=C双键断裂,生成靛红。光还原与光氧化是染料光褪色的2个重要途径[31],Kuramoto等[32]发现单线态氧所致的光氧化反应使靛蓝产生光褪色现象。靛蓝先生成过氧化中间体(Peroxide Intermediate),而后发色体中间的C=C双键断裂,生成靛红(Isatin),反应过程见图 17。靛红可继续被氧化为邻氨基苯甲酸和二氧化碳。马超群等[33]认为高温致使靛蓝发色体中间的C=C双键断裂,生成芳香胺类化合物。由靛蓝褪色机理推测,Indigoidine分别在可见光、紫外线、氧化剂(H2O2)、高温的条件下褪色,可能是上述条件导致其发色体中间的C=C双键断裂,发色体共轭结构被破坏,最终生成其他物质。
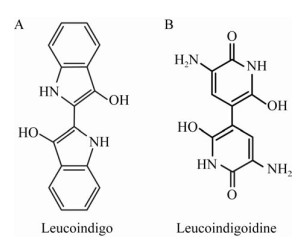
添加还原剂Vc使2种色素在其对应的λmax处吸光值下降,而且靛蓝对Vc敏感,吸光度大幅下降,最终溶液蓝色消失变为浅黄色。推测原因可能是,2种色素在还原剂Vc的作用下被还原为对应的隐色体(Leuco-)形式,原发色体结构改变,导致吸光度下降,即靛蓝还原为隐色靛蓝(也称靛白,Leucoindigo),其结构见图 18A,Indigoidine被还原为Leucoindigoidine,其结构见图 18B。靛蓝可被连二亚硫酸钠还原为隐色靛蓝[7],Indigoidine也可被连二亚硫酸钠还原为其隐色体形式Leucoindigoidine[13-15]。
实验结果表明,在以N, N-二甲基甲酰胺为溶剂时,可见光、紫外线对2种色素有显著的破坏作用;pH 1.0-11.0时2种色素稳定,颜色呈蓝色,在强碱性pH条件下2种色素都不稳定,褪色明显;Indigoidine抗Vc还原能力强于靛蓝,并对Vc有一定的耐受作用,靛蓝则对Vc敏感;植酸对Indigoidine有微弱的护色效果;氧化剂对2种色素都有不同程度的破坏作用,Indigoidine抗双氧水氧化作用比靛蓝更强,但抗Vk3氧化作用明显弱于靛蓝;2种色素热稳定性不佳,在低于75 ℃时,Indigoidine的色素稳定性优于靛蓝;食品添加剂中的柠檬酸对Indigoidine有显著的护色效果,但对靛蓝有明显的破坏作用,而苯甲酸对Indigoidine有明显的破坏作用却对靛蓝有显著的护色效果;对这2种色素,Ca2+、Mg2+具有护色效果,Na+、K+对Indigoidine未见破坏作用,但对靛蓝均有较弱的护色效果,Zn2+、Al3+、Cu2+、Fe2+、Fe3+具有明显的破坏作用;Mn2+可使Indigoidine色素稳定性下降,但在低浓度时对靛蓝有较弱的护色效果,Li+在总体上对Indigoidine没有明显的影响,但对靛蓝有较弱的护色效果,Pb2+使2种色素溶液都产生白色沉淀。因此,对Indigoidine色素的利用及加工工艺中应注意在避光、常温或低温的条件下进行和保存,尽量避免接触Zn2+、Al3+、Cu2+、Fe2+、Fe3+、Mn2+、Pb2+金属离子、强碱性物质和苯甲酸,但可与具有弱氧化还原性的物质适当混合。
总而言之,在可见光、紫外线、温度(高温,常温,低温)、pH、柠檬酸、特定的氧化还原剂与金属离子的影响因素下,Indigoidine的色素稳定性总体上优于现今市场上常用的靛蓝,因此具有良好的开发应用和市场前景。
致谢: 感谢中国科学院微生物研究所陈义华研究员惠赠含有idgS和sfp基因的pCIMt002质粒。感谢天津科技大学生物工程学院谢周杰副研究员对Indigoidine相关研究经验的指导,以及本实验室唐巧巧同学在质粒构建方面的指导和帮助。| [1] |
Xie Y, Xu W, Wang YJ, Sun SQ, Liu XX. Study on the stability of blue pigment from Streptomyces lividans[J]. Journal of Jiaxing University, 2013, 25(6): 41-45. (in Chinese) 谢勇, 徐微, 王玉洁, 孙诗清, 刘晓侠. 浅青紫链霉菌蓝色素的稳定性研究[J]. 嘉兴学院学报, 2013, 25(6): 41-45. DOI:10.3969/i.issn.1008-6781.2013.06.008 |
| [2] |
Mao DJ, Zhu YL. Review of research situations of natural blue edible pigments in China[J]. China Food Additives, 2011(4): 149-155. (in Chinese) 毛得奖, 朱亚玲. 我国食用天然蓝色素研究进展[J]. 中国食品添加剂, 2011(4): 149-155. DOI:10.3969/j.issn.1006-2513.2011.04.023 |
| [3] |
Cude WN, Mooney J, Tavanaei AA, Hadden MK, Frank AM, Gulvik CA, May AL, Buchan A. Production of the antimicrobial secondary metabolite indigoidine contributes to competitive surface colonization by the marine roseobacter Phaeobacter sp. strain Y4I[J]. Applied and Environmental Microbiology, 2012, 78(14): 4771-4780. DOI:10.1128/AEM.00297-12 |
| [4] |
Ma Q, Qu YY, Zhang XW, Xu BW, Zhou JT. Recent advances in microbial synthesis of indigo[J]. Chinese Journal of Applied and Environmental Biology, 2012, 18(2): 344-350. (in Chinese) 马桥, 曲媛媛, 张旭旺, 许炳雯, 周集体. 靛蓝的微生物合成研究新进展[J]. 应用与环境生物学报, 2012, 18(2): 344-350. |
| [5] |
Han XH, Wang W, Xiao XG. Microbial biosynthesis and biotransformation of indigo and indigo-like pigments[J]. Chinese Journal of Biotechnology, 2008, 24(6): 921-926. (in Chinese) 韩晓红, 王伟, 肖兴国. 靛蓝及其同类色素的微生物生产与转化[J]. 生物工程学报, 2008, 24(6): 921-926. DOI:10.3321/j.issn:1000-3061.2008.06.003 |
| [6] |
Du LY, Zhang C, Che YX, Liu WX, Wang MF, Yin S, Wang CT. Construction of gene engineered Escherichia coli strain for high-yield production of indigo and its stability[J]. Science and Technology of Food Industry, 2017, 38(16): 229-233. (in Chinese) 杜灵燕, 张策, 车逸心, 刘雯娴, 王孟菲, 尹胜, 王成涛. 高产靛蓝色素大肠杆菌工程菌的构建及靛蓝色素稳定性[J]. 食品工业科技, 2017, 38(16): 229-233. |
| [7] |
Yuan X. Research progress of cotton indigo dyeing mechanism[J]. Shanghai Textile Science and Technology, 2013, 41(6): 1-4. (in Chinese) 袁霞. 靛蓝对棉染色机理的研究进展[J]. 上海纺织科技, 2013, 41(6): 1-4. DOI:10.3969/j.issn.1001-2044.2013.06.001 |
| [8] |
Ma GH. Electrochemical and spectroelectrochemical studies of vat dye indigo[D]. Hefei: Master's Thesis of Hefei University of Technology, 2010 (in Chinese) 马光和.还原染料靛蓝的电化学与光谱电化学研究[D].合肥: 合肥工业大学硕士学位论文, 2010 |
| [9] |
Takahashi H, Kumagai T, Kitani K, Mori M, Matoba Y, Sugiyama M. Cloning and characterization of a Streptomyces single module type non-ribosomal peptide synthetase catalyzing a blue pigment synthesis[J]. Journal of Biological Chemistry, 2007, 282(12): 9073-9081. DOI:10.1074/jbc.M611319200 |
| [10] |
Yu DY, Xu FC, Valiente J, Wang SY, Zhan JX. An indigoidine biosynthetic gene cluster from Streptomyces chromofuscus ATCC 49982 contains an unusual IndB homologue[J]. Journal of Industrial Microbiology and Biotechnology, 2013, 40(1): 159-168. DOI:10.1007/s10295-012-1207-9 |
| [11] |
Li PW, Li J, Guo ZY, Tang W, Han JS, Meng XX, Hao TT, Zhu YX, Zhang LX, Chen YH. An efficient blue-white screening based gene inactivation system for Streptomyces[J]. Applied Microbiology and Biotechnology, 2015, 99(4): 1923-1933. DOI:10.1007/s00253-014-6369-0 |
| [12] |
Kong LY, Xu GD, Liu XQ, Wang JW, Tang ZL, Cai YS, Shen K, Tao WX, Zheng Y, Deng ZX, et al. Divergent biosynthesis of C-nucleoside minimycin and indigoidine in bacteria[J]. iScience, 2019, 22: 430-440. DOI:10.1016/j.isci.2019.11.037 |
| [13] |
Müller M, Ausländer S, Ausländer D, Kemmer C, Fussenegger M. A novel reporter system for bacterial and mammalian cells based on the non-ribosomal peptide indigoidine[J]. Metabolic Engineering, 2012, 14(4): 325-335. DOI:10.1016/j.ymben.2012.04.002 |
| [14] |
Heumann W, Young D, Gottlich C. Leucoindigoidine formation by an Arthrobacter species and its oxidation to indigoidine by other micro-organisms[J]. Biochimica et Biophysica Acta, 1968, 156(2): 429-431. DOI:10.1016/0304-4165(68)90280-8 |
| [15] |
Kuhn R, Starr MP, Kuhn DA, Bauer H, Knackmuss HJ. Indigoidine and other bacterial pigments related to 3, 3'-bipyridyl[J]. Archiv Für Mikrobiologie, 1965, 51(1): 71-84. DOI:10.1007/BF00406851 |
| [16] |
Reverchon S, Rouanet C, Expert D, Nasser W. Characterization of indigoidine biosynthetic genes in Erwinia chrysanthemi and role of this blue pigment in pathogenicity[J]. Journal of Bacteriology, 2002, 184(3): 654-665. DOI:10.1128/JB.184.3.654-665.2002 |
| [17] |
Yang YD, Tian L, Chen CJ, Qian Z, Zhong CF. Method for dyeing protein fiber fabric with natural blue pigment indigoidine after color matching: CN, 108894014A[P]. 2018-11-27 (in Chinese) 杨叶东, 田丽, 陈灿军, 钱政, 钟成芳.拼色后的天然蓝色素indigoidine对蛋白质纤维织物染色的方法: 中国, 108894014A[P]. 2018-11-27 |
| [18] |
Xie ZJ, Zhang Z, Cao ZJ, Chen M, Li PW, Liu WF, Qin H, Zhao XJ, Tao Y, Chen YH. An external substrate-free blue/white screening system in Escherichia coli[J]. Applied Microbiology & Biotechnology, 2017, 101(9): 3811-3820. |
| [19] |
Nanjaraj Urs AN, Hu YL, Li PW, Yuchi AG, Chen YH, Zhang Y. Cloning and expression of a nonribosomal peptide synthetase to generate blue rose[J]. ACS Synthetic Biology, 2019, 8(8): 1698-1704. DOI:10.1021/acssynbio.8b00187 |
| [20] |
Yumusak C, Prochazkova AJ, Apaydin DH, Seelajaroen H, Sariciftci NS, Weiter M, Krajcovic J, Qin Y, Zhang W, Zhan JX, et al. Indigoidine: Biosynthesized organic semiconductor[J]. Dyes and Pigments, 2019, 171: 107768. DOI:10.1016/j.dyepig.2019.107768 |
| [21] |
Xu FC, Gage D, Zhan JX. Efficient production of indigoidine in Escherichia coli[J]. Journal of Industrial Microbiology and Biotechnology, 2015, 42(8): 1149-1155. DOI:10.1007/s10295-015-1642-5 |
| [22] |
Xu J. The method and condition optimization of production indigoidine with L-glutamine strain[D]. Hohhot: Master's Thesis of Inner Mongolia Agricultural University, 2017 (in Chinese) 徐捷.利用L-谷氨酰胺高产菌株产新型靛蓝色素的方法及条件优化[D].呼和浩特: 内蒙古农业大学硕士学位论文, 2017 |
| [23] |
Wehrs M, Prahl JP, Moon J, Li YC, Tanjore D, Keasling JD, Pray T, Mukhopadhyay A. Production efficiency of the bacterial non-ribosomal peptide indigoidine relies on the respiratory metabolic state in S. cerevisiae[J]. Microbial Cell Factories, 2018, 17(1): 193. DOI:10.1186/s12934-018-1045-1 |
| [24] |
Wehrs M, Gladden JM, Liu YZ, Platz L, Prahl JP, Moon J, Papa G, Sundstrom E, Geiselman GM, Tanjore D, et al. Sustainable bioproduction of the blue pigment indigoidine: Expanding the range of heterologous products in R. toruloides to include non-ribosomal peptides[J]. Green Chemistry, 2019, 21(12): 3394-3406. DOI:10.1039/C9GC00920E |
| [25] |
Xu BY, Cheng YB, Wang L, Zhou H, Huang L, Tang XY, Gao Q. Construction of Eschericha coli-Staphylococcus shuttle vector for EGFP expression and potential secretion via tat pathway[A]//Zhang TC, Nakajima M. Advances in Applied Biotechnology[M]. Berlin, Heidelberg: Springer, 2015, 333: 171-180
|
| [26] |
Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual[M]. 3rd ed. Beijing: Science Press, 2005: 91-92. (in Chinese) 萨姆布鲁克 J, 拉塞尔 DW. 分子克隆实验指南[M]. 3版. 北京: 科学出版社, 2005: 91-92. |
| [27] |
Nakano MM, Corbell N, Besson J, Zuber P. Isolation and characterization of sfp: a gene that functions in the production of the lipopeptide biosurfactant, surfactin, in Bacillus subtilis[J]. Molecular and General Genetics, 1992, 232(2): 313-321. DOI:10.1007/BF00280011 |
| [28] |
Lambalot RH, Gehring AM, Flugel RS, Zuber P, LaCelle M, Marahiel MA, Reid R, Khosla C, Walsh CT. A new enzyme superfamily-the phosphopantetheinyl transferases[J]. Chemistry & Biology, 1996, 3(11): 923-936. |
| [29] |
Galindo C, Jacques P, Kalt A. Photochemical and photocatalytic degradation of an indigoid dye: A case study of acid blue 74 (AB74)[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2001, 141(1): 47-56. DOI:10.1016/S1010-6030(01)00435-X |
| [30] |
Takeuchi K, Ibusuki T. Quantitative determination of aqueous-phase ozone by chemiluminescence using indigo-5, 5'-disulfonate[J]. Analytical Chemistry, 1989, 61(6): 619-623. DOI:10.1021/ac00181a025 |
| [31] |
Li JC. Mechanism of photooxidation fading of dyes: the effect of singlet oxygen on photofading of dyes[J]. Dyestuff Industry, 1987(3): 21-27, 30. (in Chinese) 李金诚. 染料的光氧化褪色机理:单线态氧对染料光褪色的作用[J]. 染料工业, 1987(3): 21-27, 30. |
| [32] |
Kuramoto N, Kitao T. Contribution of singlet oxygen to the photofading of indigo[J]. Journal of the Society of Dyers and Colourists, 1979, 95(7): 257-261. |
| [33] |
Ma CQ, Chen GQ, Gao SM, Shi YP, Gu L, Chen C. Study on thermal stability of indigotine based on fluorescence spectrometry[EB/OL]. Beijing: Sciencepaper Online[2011-06-07] (in Chinese) 马超群, 陈国庆, 高淑梅, 史院平, 谷玲, 陈超.基于荧光光谱法的靛蓝热稳定性研究[EB/OL].北京: 中国科技论文在线[2011-06-07] |
 2021, Vol. 48
2021, Vol. 48