扩展功能
文章信息
- 刘倩钰, 吴丽雯, 牛建军, 赵西林
- LIU Qian-Yu, WU Li-Wen, NIU Jian-Jun, ZHAO Xi-Lin
- 细菌磷酸转移酶系统(PTS)的组成与功能研究进展
- Research progress of the composition and function of bacterial phosphotransferase system
- 微生物学通报, 2020, 47(7): 2266-2277
- Microbiology China, 2020, 47(7): 2266-2277
- DOI: 10.13344/j.microbiol.china.200134
-
文章历史
- 收稿日期: 2020-02-22
- 网络首发日期: 2020-05-09
2. 厦门大学附属中山医院 福建 厦门 361004
2. Zhongshan Hospital, School of Medicine, Xiamen University, Xiamen, Fujian 361004, China
尽管DNA是生物信息的最终存储库,但其合成受到细胞代谢和生理状态的限制。为此,细菌已经进化出复杂的装置,该装置将外源信号(如营养物、物理化学条件等)与内源条件(如代谢通量、生化网络)相连接,所述内源条件的协调变化则会影响大量细胞功能的表达。磷酸烯醇丙酮酸(phosphoenolpyruvate,PEP)-磷酸转移酶系统(phosphotransferase system,PTS)则是细菌中存在的一种复杂装置,这条多蛋白质磷酸化链可识别细胞外信号(如糖)和细胞内信号(如磷酸烯醇丙酮酸、氮)并将其通过蛋白质-蛋白质相互作用转化为对靶标活性的调节[1]。
大约在60年前,PTS被Saul Roseman实验室所发现,第一篇描述大肠杆菌PTS组分-HPr及其在己糖磷酸化中作用的文章于1964年发表[2]。在大肠杆菌中发现PTS后不久,人们陆续在许多其他细菌中也发现了PTS,它们主要负责能源运输过程中大量碳水化合物(如己糖、6-脱氧己糖、氨基糖、N-乙酰基氨基糖、葡萄糖酸、戊糖醇、抗坏血酸和二糖等)的吸收并催化其转化为各自的磷酸酯[3]。在之后长期的研究中,人们逐渐意识到PTS不仅是一个糖运输系统,介导碳水化合物的摄取和磷酸化,还具有十分强大的调节能力,参与调控中心碳、氮代谢,调节金属离子稳态,调节细菌毒力,而且越来越多的研究表明其与应激反应之间也存在着密不可分的联系。
1 PTS的组成及各组分功能 1.1 酶Ⅰ (EI)和HPr细菌中发现的磷酸烯醇丙酮酸(PEP)-磷酸转移酶系统(PTS)存在于细菌、真菌和一些古细菌中,但不存在于动植物中。截至目前,已研究物种中PTS的基本组成都相似,几乎所有PTS都包含两个胞质磷酸转移酶[酶I(EI)和组氨酸磷酸载体蛋白(HPr)]以及依赖于物种的数目可变的糖特异性酶II复合物(EIIA,EIIB,EIIC,EIID)。
编码EI和HPr蛋白的基因通常在同一个操纵子上,即ptsHI操纵子。EI由ptsI基因编码,序列比较分析结果显示,来自各种革兰氏阳性和革兰氏阴性细菌的EI (约570个残基,63 kD)表现出显著的同源性[4]。大肠杆菌中,EI不仅是糖酵解过程中磷酸烯醇丙酮酸(phosphoenolpyruvate,PEP)转化为丙酮酸(pyruvate,PYR)的末端磷酸转移酶,也是促进糖原异生(PYR转化为PEP)过程的反向通路[5]。HPr (约90个残基,9−10 kD)由ptsH基因编码[4]。除了几种放线菌如意大利农杆菌、黄单胞菌或土生放线菌拥有一个常规的HPr和由一个HPr样结构域与一个EIIAMan样结构域组成的DhaM蛋白外,革兰氏阳性细菌通常仅包含一种EI和一种HPr;与此相反,肠杆菌科通常会产生几种EI和HPr同源物或旁系同源物,例如与氮有关的EINtr和NPr以及果糖特异FPr[6]。
1.2 酶Ⅱ复合物每个酶II复合物由一个或两个疏水性整体膜结构域(结构域C和D)和两个亲水性结构域(结构域A和B)组成。结构域C和D (EIICD)是碳水化合物转运的跨膜通道,膜结构域B (EIIB)负责碳水化合物磷酸化,而结构域A (EIIA)是HPr (H15-P)与EIIB之间的介体[7]。PTS的碳水化合物特异性位于EII中,因此细菌通常包含许多不同的EII。比如,大肠杆菌包含20多种不同的EII复合物,这些酶的存在和性质已通过遗传、生化和生理研究确定[8]。其中葡萄糖PTS和甘露糖PTS是主要的葡萄糖转运系统,且前者对葡萄糖的亲和力高于后者;当上述两种PTS和葡萄糖激酶均缺乏时,N-乙酰氨基葡萄糖PTS比麦芽糖PTS和β-葡萄糖苷PTS更能有效促进葡萄糖的运输和利用[9]。葡萄糖-PTS使用典型的PTS磷酸化级联反应来磷酸化和转运葡萄糖,其所有组分都与大量非PTS蛋白相互作用,以调节细菌细胞中的碳水化合物通量[8]。根据EII的系统发育不同,将PTS分为4个具有不同进化起源的(超)家族(表 1)[10]。
| EII分类 Classification of EII |
代表菌株及蛋白 Representative strains and proteins |
|
| 葡萄糖-果糖-乳糖超家族Glucose-fructose-lactose superfamily | 葡萄糖家族Glucose family | 大肠杆菌E. coli: EIIAGlc/EIICBGlc 枯草芽孢杆菌B. subtilis: EIICBAGlc |
| 果糖-甘露醇家族Fructose-mannitol family | 大肠杆菌E. coli: EIICBAMtl | |
| 乳糖家族Lactose family | 干酪乳杆菌L. casei: EIIALac/EIICBLac | |
| 抗坏血酸-半乳糖醇超家族Ascorbate-galactitol superfamily | 抗坏血酸家族Ascorbate family | 大肠杆菌E. coli: SgaA/SgaB/SgaT |
| 半乳糖醇家族Galactitol family | 大肠杆菌E. coli: EIIAGat/EIIBGat/EIICGat | |
| 甘露糖家族Mannose family | 大肠杆菌E. coli: EIIABMan/EIICMan/EIIDMan枯草芽孢杆菌B. subtilis: EIIALev/EIIBLev/EIICLev/EIIDLev | |
| 二羟基丙酮家族Dihydroxyacetone family | 大肠杆菌E. coli: EIIA-HPr-EIDha [DhaM] 厚壁菌门Firmicutes: EIIADha |
|
| 注:为了表明其底物特异性,使用了3个字母的代码作为上标添加到相应的蛋白质名称后. EIIAGlc:葡萄糖特定的EIIA;EIICBAMtl:甘露醇特定的EIICBA;EIIALac:乳糖特定的EIIA;EIIAGat:半乳糖特定的EIIA;EIIDMan:甘露糖特定的EIID;EIIALev:果糖特定的EIIA;EIIADha:二羟基丙酮特定的EIIA. Note: To indicate substrate specificity, a three-letter code was used as a superscript added to the corresponding protein name. e.g. EIIAGlc: Glucose-specific EIIA; EIICBAMtl: Mannitol-specific EIICBA; EIIALac: Lactose-specific EIIA; EIIAGat: Galactose-specific EIIA; EIIDMan: Mannose-specific EIID; EIIALev: Fructose-specific EIIA and EIIADha: Dihydroxyacetone-specific EIIA. |
||
PTS蛋白通常彼此融合,从而形成由两个或多个结构域组成的多功能复合物。通常,一种或两种可溶性PTS组分与跨膜转运蛋白的N末端或C末端融合,因此位于膜的胞质侧。例如,枯草芽孢杆菌的寡糖-β-葡萄糖苷特异性PTS由3种不同的蛋白质组成,而在同一生物体的甘露醇特异性PTS通透酶中,EIIB成分融合到跨膜EIIC的C末端,只有EIIAMtl是单独的蛋白质;甘露糖型PTS是一个例外,因为其具有两个跨膜蛋白,大多数厚壁菌门的甘露糖/葡萄糖特异的PTS以及枯草芽孢杆菌的低效率果糖特异性PTS就是这种情况(图 1)[3]。
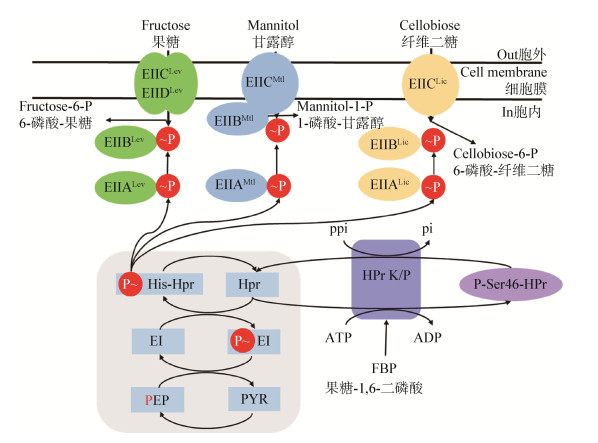
|
| 图 1 G+菌枯草芽孢杆菌PTS组分形成的磷酸化级联的示意图 Figure 1 Schematic diagram of PTS phosphorylation cascade in G+ bacterium B. subtilis |
|
|
除了上述大多数细菌中存在的典型PTS,还存在一些特殊的PTS。广泛的基因组分析揭示了许多变形杆菌中糖磷酸转移酶系统(PTSSugar)的旁系同源物——氮磷酸转移酶系统(PTSNtr)。与PTSSugar相似,PTSNtr具有EINtr (由ptsP编码的EI旁系同源物)和NPr (由ptsO编码的HPr旁系同源物),它们催化P-EI衍生的磷酸基团对EIIANtr (由ptsN编码的EIIANtr旁系同源物)进行磷酸化,但是缺乏底物特异性的EIIB和EIIC膜结合蛋白,所以这种不完整PTS通过与非PTS底物相互作用而非吸收糖来发挥调节功能[11]。在嗜肺军团菌以及许多其他军团菌中,缺失EIIANtr成分的不完全PTSNtr是功能性的,并且参与了受PmrA调控的效应子编码基因的表达[12]。然而病原菌布鲁氏菌属拥有4种PTS蛋白(EINtr、NPr、EIIANtr和甘露糖家族的EIIA),但没有PTS渗透酶,表明该PTS可能仅起到调节作用[13]。有人提议将第2个磷酸转移酶系统(PTSNtr)与氮代谢联系起来,但这种联系很难被描述[6]。后来在大肠杆菌和苜蓿链球菌[14]以及新月形梭菌[15]中观察到谷氨酰胺直接抑制EINtr自磷酸化作用,说明氮构成了PTSNtr的信号。结合谷氨酰胺的所有EINtr蛋白中都存在高度保守的GAF域这一事实,表明谷氨酰胺依赖性的EINtr磷酸化控制可能是PTSNtr的共同特征。
目前有研究表明PTSSugar和PTSNtr并非各自独自运行,两者之间存在串扰。大肠杆菌同时存在这两种PTS,HPr和NPr具有相似的折叠,EINtr不仅可以与配偶体NPr耦合,也可与HPr短暂耦合;HPr占据EINtr上的瞬时位点,但无法形成立体特异性复合物,反而促进NPr与EINtr的瞬时相互作用,从而促进了二者之间特异性复合物的形成[16]。耦合这两种系统的磷酸转移酶能量都可促进EIIANtr的磷酸化,表明两个PTS存在串扰[17]。此外,恶臭假单胞菌的分解代谢阻遏物/激活物Cra (FruR)依赖果糖-1-磷酸(F1P)内源性浓度来抑制PTSFru的表达,在允许fruBKA操纵子高或低转录的代谢机制下,FruB (即EI-HPr-EIIAFru多蛋白)可以向PTSNtr分支的EIIANtr (PtsN)传递高能磷酸盐,也证明了两个系统之间存在串扰的情况[18]。
2 PTS的功能 2.1 PTS介导糖转运和磷酸化磷酸烯醇丙酮酸(PEP)作为吸收PTS能源的底物,也用作磷酸化的磷酰基供体。可溶性PTS组分形成以EI为起点的磷酸化级联反应,该反应以PEP为底物,在其保守的组氨酸残基处自磷酸化(图 1),磷酸化的EI将磷酸基团转移到HPr上,随后磷酸化的HPr将磷酸基团传递到细菌中的几种糖特异性EIIAs的其中之一[6]。磷酸化的EIIA将磷酸基团转移到它们的同源EIIB上,后者将其磷酰基转移至同源的膜结构域EIIC (果糖特异性PTS是转移至EIICD整体膜蛋白复合物)上的碳水化合物中[19]。碳水化合物的磷酸化被认为会降低其对EIIC的亲和力,因此磷酸化的碳水化合物会释放到细胞质中[20]。迄今为止,只有一种碳水化合物岩藻糖基-β-1, 3-N乙酰氨基葡糖可以通过干酪乳杆菌的PTS转运而没有被磷酸化[21]。所有其他碳水化合物在其运输过程中均被磷酸化,随后转化为糖酵解途径、磷酸戊糖途径或酮糖酸途径的磷酸化中间体;除最后一个步骤(即碳水化合物底物的磷酸化)外,所有磷酸基转移步骤都是可逆的,这使PTS成为了高效的传感器和快速的信号转导系统[6]。
PTS对于G+菌枯草芽孢杆菌摄取果糖(PTSLev)、甘露醇(PTSMtl)和纤维二糖(PTSLic)而言是必需的。枯草芽孢杆菌中有16种PTS转运蛋白,其中有6种,即NagP、MalP、MurP、TreP、SacP和SacX不包含EIIA域[7]。如图 1所示,纤维二糖和果糖的PTS磷酸化级联反应是由EI、HPr和两种截然不同的EIIA和EIIB蛋白形成的,而甘露醇PTSMtl的EIIB成分融合到EIIC结构域的C末端,因此附着在膜的细胞质侧;HPr在ATP供应和果糖1, 6-二磷酸(FBP)刺激下,在Ser-46处发生磷酸化;P-Ser46-HPr发生了去磷酸化,其中P-Ser-HPr和Pi为底物,HPr和焦磷酸盐(PPi)为产物;HPr的ATP依赖性磷酸化发生在厚壁菌中,但在许多含有HprK/P和HPr旁系同源物NPr蛋白的细菌中也发生[22]。
由于所有细胞质PTS蛋白或与膜相关的亲水性PTS结构域均发生瞬时磷酸化,因此PTS的众多调节功能都通过磷酸基团转移至靶蛋白而介导[6]。PTS通过使靶蛋白磷酸化或通过与其靶蛋白直接相互作用来实现调节作用:包含特定PTS可识别的磷酸化结构域的蛋白质会被PTS组分所磷酸化并调节其活性,可磷酸化的靶蛋白包括多种非PTS转运蛋白和转录调节剂[11];在后一种情况下,PTS蛋白的磷酸化或非磷酸化形式直接与靶蛋白相互作用,导致其功能的激活或抑制[23-24]。截至目前,据报道有几个主要因素影响肠杆菌科和其他大多数细菌中PTS蛋白的磷酸化状态:(1)摄取有效代谢的PTS糖(例如葡萄糖)会导致PTS组分的去磷酸化[6];(2)磷酸烯醇丙酮酸(PEP)与丙酮酸(PYR)比率的变化(这两种化合物是EI自身磷酸化的底物和产物)是PTS蛋白磷酸化的驱动力,决定了EIIAGlc的磷酸化状态[25];PEP与PYR的比例随细胞代谢状态的变化而变化:饥饿的细胞具有较高的PEP/PYR比率,而在具有代谢活性的细胞中,PEP/PYR比率很低[6];(3)对PTS碳水化合物摄取的抑制是由氮限制条件下发生的α-酮戊二酸(α-ketoglutarate英文缩写为2-OG或α-KG,下文统一用2-OG进行表述)积累引起的,积累的2-OG抑制了EI的自磷酸化活性[26]。实际上,分子对接模型表明2-OG可以占据EI C末端结构域上的PEP结合位点[27-28],因此EI以及PTS级联中所有后续蛋白质磷酸化的状态也受2-OG/PEP比值的控制。
2.2 PTS介导碳代谢调节在每个生物体中存在着碳源利用的优先层次结构,某种碳源会对其他碳源分解代谢所涉及的酶活性和/或基因表达产生抑制作用。EIIAGlc (大肠杆菌中也称为Crr,对分解代谢抑制具有抗性)被发现是肠杆菌中碳代谢的中央处理单位,但在低(G+C)mol%含量的革兰氏阳性细菌中,此功能由HPr执行[3]。
2.2.1 碳分解代谢抑制作用(carbon catabolite repression,CCR)在复杂环境中,微生物为适应生存而在进化过程中获得了一种自身调节机制,可以更高效地利用碳源。科学家们发现优选碳源,例如葡萄糖、果糖或蔗糖只要在生长培养基中大量存在,就会抑制非优选碳源运输和代谢所必需的酶的合成,这种现象被称为碳分解代谢抑制(carbon catabolite repression,CCR)[29]。当首选的碳源用尽时,细菌首先需要合成非优选碳源(滞后相)运输和代谢所必需的酶,然后才能恢复生长,因此会出现二次生长(diauxie)的现象[30]。PTS催化许多碳水化合物的吸收和磷酸化,在细菌CCR中起主要作用。但是,革兰氏阴性菌和革兰氏阳性菌进化出了完全不同的机制,涉及不同的PTS蛋白。有研究表明在大多数(G+C)mol%含量低的革兰氏阳性菌中,P-Ser46-HPr/CcpA介导了CCR机制[31]。然而在大肠杆菌等革兰氏阴性菌中,Crp/cAMP的转录调控和磷酸化的EIIAGlc导致了CCR现象[3]。在某些细菌中,CCR还可能由其他机制介导。例如,根瘤菌属[32]和假单胞菌属[33]的β-变形杆菌属更喜欢乙酸盐或三羧酸循环(tricarboxylic acid cycle,TAC)中间体(如琥珀酸盐),而非葡萄糖、果糖或乳糖作为优选碳源。虽然其潜在机制尚未阐明,但在假单胞菌中涉及分解代谢抑制控制蛋白Crc[34],而根瘤细菌则涉及诱导物积累[32]。
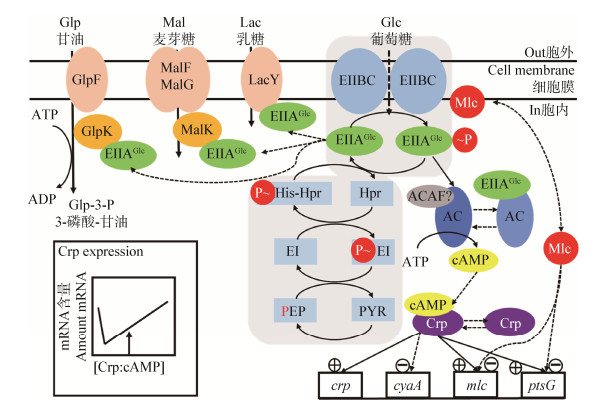
2.2.2 诱导物阻遏(inducer exclusion)当一种优选碳源(如PTS碳源)进行运输代谢时会抑制其他非优选碳源的吸收利用,这就是诱导物阻遏现象[35]。在大肠杆菌中引起这种现象的主要机制是EIIAGlc的去磷酸化。以G−菌大肠杆菌经典模型为例(图 2),当培养基中同时存在葡萄糖和其他碳源(如乳糖、麦芽糖、甘油等)时,葡萄糖被优先利用,导致磷酸基团在PTSGlc转运蛋白之间级联传递,PTS蛋白去磷酸化增加。未磷酸化的EIIAGlc蛋白通过结合至各自的转运蛋白或激酶(如LacY、MalK、GlpK),从而抑制了乳糖、麦芽糖和甘油等碳源的运输以及磷酸化。胞外的其他碳源无法被转运进入胞内,因而无法被吸收和利用。当葡萄糖被耗尽,如果存在磷酸烯醇丙酮酸(PEP),则PTS蛋白主要处于磷酸化状态。因此对LacY、MalK、GlpK的阻遏作用解除,其他糖类就能够被转运进入细胞内。此外,EIIAGlc的去磷酸化不仅可以由PTS碳源的运输引起,一些未被PTS转运的碳水化合物(比如6-磷酸-葡萄糖)在生长过程中也会引起去磷酸化[36]。
细菌信号转导系统负责感测环境提示,并响应这些提示调整细胞新陈代谢。在肠细菌中,控制大量基因/操纵子表达的Crp蛋白、化学感受器PTS膜成分(如EIIAGlc)以及某些环磷酸腺苷(cAMP)等磷酸二酯酶就是其中非常重要的传感器蛋白。在肠细菌中,Crp是为数不多的真正的全局调节因子之一,因为其控制着大量基因/操纵子的表达。Crp与cAMP形成复合物才能有效地结合到目标基因启动子的操纵序列上。cAMP是由cyaA编码的腺苷酸环化酶(adenylate cyclase,AC)催化产生,而腺苷酸环化酶(AC)的活性依赖于磷酸化形式的EIIAGlc (P-EIIAGlc)[37]。
虽然很难量化Crp、AC、cAMP以及EIIAGlc各自的贡献,然而调节机制的一般性质是清楚的。PTS碳源的转运和磷酸化可降低葡萄糖PTS (包括EIIAGlc)的磷酸化程度,从而降低了AC的活性,因而cAMP和Crp/cAMP的浓度均降低;AC活性降低导致crp表达降低,Crp/cAMP的浓度进一步下降;而在正常的cAMP和Crp生理水平下,Crp/cAMP负调控cyaA基因,因此较低的Crp/cAMP浓度导致cyaA的表达增加,产生更多cAMP,从而抵消了AC活性的降低并提高了Crp/cAMP的浓度[3]。然而在非PTS碳源(尤其是碳酸盐,如乳酸和琥珀酸)上的生长会导致PTS蛋白完全磷酸化并激活AC,但是,该模型无法解释在非PTS碳源(例如6-磷酸葡萄糖或葡萄糖酸)上的生长如何导致细胞内cAMP水平有时甚至低于在葡萄糖上生长的细胞中观察到的水平[38]。
葡萄糖和其他PTS碳水化合物的输入导致PTS蛋白(包括EIIAGlc和EIIBCGlc的B结构域)去磷酸化,从而导致诱导物阻遏和转录调节子Mlc募集到膜上。图 2左上角显示未磷酸化的EIIAGlc通过结合至各自的转运蛋白或激酶而阻止了乳糖、麦芽糖和甘油的磷酸化及运输[6]。图 2的右上部分显示了未磷酸化的EIIBCGlc将转录阻遏物Mlc募集到细胞膜上,这阻止了调节剂与DNA上的靶位点结合,从而影响参与碳水化合物代谢的基因的表达。另一方面,当葡萄糖受限时,如果存在磷酸烯醇丙酮酸(PEP),则PTS蛋白主要处于磷酸化状态。图 2的中心部分显示磷酸化的EIIAGlc激活腺苷酸环化酶(AC),但可能仅在未知的腺苷酸环化酶激活因子(ACAF)存在下激活。AC结合磷酸化的EIIAGlc导致cAMP的积累,cAMP与分解代谢阻遏蛋白(cAMP receptor protein,CRP)结合激活碳分解代谢途径,从而满足增加的碳和能量需求[39]。图 2底部显示了活化的转录因子(游离的Mlc和Crp/cAMP)分别对编码Crp、AC、Mlc和EIIBCGlc的基因转录的影响(“+”代表激活,“−”代表抑制)。插图显示crp转录的Crp与其产生的cAMP之间存在浓度依赖性,箭头表示在不存在PTS碳水化合物的情况下,细胞中活化Crp的生理浓度[40]。
2.3 PTS介导氮代谢调节氮对包括细菌在内的每个生物都是必不可少的,其可被同化为氨基酸,再同化为蛋白质,这些蛋白质构成了进行生物学活动的细胞成分。因此,对于细菌来说,感知细胞氮源的可用性并根据情况进行分配至关重要。氮代谢磷酸转移酶系统PTSNtr由ptsP、ptsO和ptsN编码的EINtr、NPr和EIIANtr组成。在许多变形杆菌中编码EIIANtr的ptsN基因位于rpoN的下游,而rpoN编码的另一个σ54因子参与氮代谢相关的多种基因和操纵子的表达[41]。包含rpoN操纵子的基因与氮利用在细胞壁构建上的功能相关性已得到证明。ptsO编码的NPr通过抑制LpxD活性并阻断脂多糖(lipopolysaccharide,LPS)的活性,从而降低了LPS层中脂质A的生物合成[11]。进一步的研究揭示了PTSNtr与氮代谢之间的相关性。谷氨酰胺的氮部分通过D-氨基葡萄糖-6-磷酸合酶(GlmS)转化为细菌细胞壁中肽聚糖和LPS的重要结构组分——氨基糖(UDP-GlcNAc);磷酸化形式的EIIANtr会与GlmS结合并抑制其活性,但当EIIANtr响应过多的氮源则被去磷酸化,并在氨基糖耗尽后被Lon蛋白酶迅速降解;EIIANtr对GlmS活性的调节和RapZ (包含rpoN操纵子的一个基因)对glmS翻译的调节表明,包含rpoN操纵子的基因在维持氮糖稳态和响应细菌细胞质中的氮糖含量方面起着关键作用[11]。还有一些研究证实了PTSNtr响应的两个效应子谷氨酰胺(glutamine,Gln)和α-酮戊二酸(α-ketoglutarate,2-OG)对EINtr的自磷酸化活性的作用。氮过多的细胞将α-酮戊二酸(2-OG)转化为谷氨酸(Glu),进而转化为谷氨酰胺(Gln)[26]。在氮限制条件下,谷氨酰胺(Gln)被用作氮源[42]。因此,Gln/2-OG的比例通常用于预测氮和碳丰度之间的细胞平衡:富氮条件下的Gln/2-OG值较高,而贫氮条件下的Gln/2-OG值较低。EINtr通过两者的比值来感知氮的有效性,并借此调节EIIANtr的磷酸化状态[41, 43]。
2.4 PTS协调碳和氮的代谢平衡生命有机体所需的两种主要营养素是碳和氮,这些营养成分的可用性会受到环境波动的影响。有研究发现细菌可以通过PTS协调氮和碳的代谢,以最大程度地利用养分促进细胞生长。前文提及的D-氨基葡萄糖-6-磷酸合酶(GlmS)是维持细胞壁完整性的限速酶,其消耗一分子谷氨酰胺(Gln)来合成等量的氨基糖GlcN6P,EIIANtr通过评估氮和氨基糖的丰度来微调GlmS活性揭示了一种复杂的调节通路,可平衡碳、氮和氨基糖之间的代谢物通量[11]。实际上,PTSSugar和PTSNtr也通过磷酸化对应成分进行串扰。
在大肠杆菌、枯草芽孢杆菌和鼠伤寒沙门氏菌中,人们广泛研究了碳利用和氮利用途径之间的调控。整合碳和氮代谢状态的一个非常合适的结构即大肠杆菌PTSNtr,因为其磷酸级联反应受α-酮戊二酸(2-OG)和谷氨酰胺(Gln)的调节[14]。2-OG被确定为平衡碳和氮同化并控制EIIANtr调节活性的关键分子[11]。近几年有研究者观察到氮利用率的突然增加导致葡萄糖摄取的立即增加,而在氮限制条件下积累的2-OG直接抑制了PTSSugar的EI的自磷酸化并阻止了葡萄糖的进入,从而使碳摄取同步氮供应,却不会干扰糖酵解中间体[26]。在氮限制条件下积累的2-OG与NifA的GAF结构域(固氮基因nif的转录激活因子)结合,触发氮吸收进入细胞;当氮供应充足,细胞则将2-OG转化为Glu,进一步转化为Gln,随后2-OG对EI的抑制作用解除,恢复葡萄糖摄取;有趣的是,PTSNtr的EINtr也可以结合2-OG的GAF结构域,氮缺乏时直接传递给EIIANtr,这会抑制GlmS活性,从而阻止氮向氨基糖的流入[11]。因此,可以推测2-OG是整合细胞生理状态并协调碳氮同化的关键信号。还有人观察到恶臭假单胞菌KT2440具有PTSNtr的变体,该变体与糖运输无关,其非磷酸化形式参与了碳代谢的节点,通过与丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)复合物直接的蛋白质-蛋白质相互作用反映了从碳水化合物到三羧酸循环的碳通量,这也体现了PTS协调碳氮代谢平衡[44]。
2.5 PTS调节铁、钾稳态响应环境变化而维持离子稳态对于所有活细胞都是必不可少的。铁是重要的金属离子,其促进了各种生物过程,包括代谢酶的催化作用和DNA形成。铁摄取调节剂Fur蛋白可控制各种细菌中的铁稳态,Fur蛋白通过与铁结合调节编码铁转运蛋白的基因来响应铁浓度,从而控制铁吸收;低铁条件下,病原体沙门氏菌的PTSNtr组分EIIANtr直接阻碍Fur与DNA的结合,增加铁转运蛋白编码基因的表达,从而促进沙门氏菌在这种条件下生长[45]。
除了铁离子,细菌的胞质钾离子对于各种过程也是必需的。在大肠杆菌中,PTSNtr最典型的功能涉及调节钾转运蛋白的表达和活性[23, 46],豆蔻根瘤菌(Rhizobium leguminosarum)也保持这种功能[47]。Trk和Kdp被认为是大肠杆菌吸收K+的主要途径。未磷酸化的EIIANtr对钾的积累有两个影响:(1)未磷酸化的EIIANtr与低亲和力的钾转运蛋白Trk结合并抑制高细胞内K+水平的积累[23]。(2) PTSNtr也通过转录激活高亲和力的ATP依赖的钾转运蛋白KdpABC来调节K+稳态,这涉及双组分传感器调节子KdpDE与EIIANtr的直接相互作用,而这种相互作用取决于EIIANtr的磷酸化状态以及外部K+浓度[48-49]。另一项大肠杆菌中的研究显示,ΔptsN突变体中的钾敏感性是由于YcgO介导的K+外排激活而导致的钾限制引起的,暗示去磷酸化形式的PtsN可能是YcgO活性的抑制剂[50]。
2.6 PTS介导毒力的调节一个相关的研究领域是PTS与某些病原菌致病性之间的关系。研究者观察到某些毒力基因是一种CCR的基础,表明了PTS与某些病原体的毒力之间有着密切的联系。在炭疽芽孢杆菌中,无论是在HPr和EI缺失还是磷酸转移活性发生突变的突变体中,编码主要毒力基因调节剂AtxA的atxA转录均会下降,这些变化影响炭疽毒素的产生,且在炭疽小鼠模型中,HPr-EI突变体的毒力有所减弱[51]。在单核细胞增生李斯特菌中,利用有效的碳源,例如纤维二糖、葡萄糖、果糖、甘露糖等会抑制毒力基因激活剂PrfA,从而强烈抑制了毒力基因的表达[52]。在肺炎克雷伯菌中,果糖PTS中的frwC基因编码蛋白EIIC也影响细菌的生成、超黏表型及毒力[53]。在沙门氏菌中,研究者通过转录组分析发现测试的PTS突变体中与群体感应、沙门氏菌毒力岛、鞭毛和PhoPQ调节剂相关的差异表达基因(differentially expressed genes,DEG)降低,该研究提出了PTS介导毒力决定因素调节的可能性,表明沙门氏菌可以根据环境中碳水化合物的可用性不同来调控毒力[54]。此外,SsrA/SsrB双组分系统介导沙门氏菌在宿主细胞内的存活和复制,激活后,SsrB反应调节剂直接促进沙门氏菌毒力岛2 (SPI-2)中多个基因的转录。研究发现沙门氏菌可以通过使用ptsN编码的EIIANtr直接与SsrB相互作用,从而阻止了SsrB蛋白与其目标启动子结合导致SPI-2基因的过度激活;缺少ptsN基因或过表达EIIANtr的沙门氏菌菌株无法在巨噬细胞内复制,且ΔptsN缺失突变体的毒性降低了,这些结果表明,由EIIANtr-SsrB相互作用维持的正常SPI-2基因表达是沙门氏菌毒力的另一个决定因素[24]。还有研究发现,EIIANtr通过1, 2-丙二醇或丙酸酯分解代谢调节鼠伤寒沙门氏菌的侵袭性[55]。甚至有研究人员发现删除磷酸转移酶系统组成基因ptsI和crr的沙门氏菌具有成为有效减毒粘膜活体疫苗的潜能[56]。
2.7 PTS介导应激反应细菌多生于动态多变的环境中,它们已开发出整合刺激和压力的复杂调节网络来快速适应这些挑战性环境。一旦激活,这些信号传导途径就会迅速调节基本的细胞过程,例如DNA复制、细胞分裂或细胞生长。细菌通常使用警报蛋白四磷酸和五磷酸鸟苷[通常称为(p)ppGpp]迅速适应营养胁迫[57]。双功能(p)ppGpp合成酶/水解酶SpoT是严谨反应的关键酶,可应对多种营养压力[58],例如碳、磷酸盐或脂肪酸饥饿。在新月形芽孢杆菌中,细胞内谷氨酰胺浓度降低(氮饥饿)会触发EINtr及其下游成分HPr和EIIANtr的磷酸化;P-HPr和P-EIIANtr都会通过调节SpoT活性来刺激(p)ppGpp积累进而控制细胞周期进程,影响细胞生长[15]。磷酸饥饿时,大肠杆菌中非磷酸化形式的EIIANtr通过与组氨酸激酶PhoR相互作用激活了包含30多个基因的磷酸盐调节子,从而调节磷酸饥饿反应[59]。严格的饥饿蛋白SspA是EIIANtr磷酸化的调节剂,也表明PTSNtr代表大肠杆菌中与压力相关的系统[60]。
除了营养胁迫,在其他理化因素刺激的环境中,细菌也通过PTS改变对外界的抵抗力和适应性。先前的研究发现胞内cAMP含量降低会使大肠杆菌对氧化压力(H2O2,HClO)具有很强的耐受性[61],而PTS中的EllAGlc能够影响腺苷酸环化酶(AC)的活性,因此PTS也可能通过影响cAMP的合成调控大肠杆菌对氧化压力的耐受能力。还有证据表明,去磷酸化NPr水平升高的大肠杆菌对包膜胁迫(如渗透压、乙醇和SDS胁迫)敏感[62]。单核细胞增生李斯特菌在用乳链菌肽致死性处理后,与热休克相关的应激反应、细胞壁合成、ATP结合盒(ATP-binding cassette,ABC)转运系统、磷酸转移酶系统(PTS)和SOS/DNA修复等多种系统的功能基因与对照组存在差异表达,这项研究指出了暴露于致死性乳链菌肽浓度下持留菌的遗传调控,即PTS可能帮助细菌躲避外界的致死性刺激,从而造成持留现象[63]。还有人探索了更极端的环境如长期太空飞行(> 1个月)对细菌的影响,与短期航天相比,长期航天提高了华氏链球菌的生物膜形成能力和细胞壁对外部环境胁迫的抵抗力,但降低了对化学刺激的敏感性,这些变化可能也与PTS基因表达的显著上调有关[64]。
3 总结与展望细菌磷酸转移酶系统(PTS)不仅可以运输和磷酸化碳水化合物,而且还可以执行与碳代谢有关的调节功能,例如分解代谢抑制和诱导物阻遏。PTS成分除了控制氮代谢、调控铁、钾稳态、调节某些病原体的毒力,还介导了营养胁迫、理化因素刺激等压力条件下的应激反应。虽然革兰氏阳性和革兰氏阴性细菌的调节功能非常相似,但是调控机制本身存在差异,每种机制可能最佳地适应了不同细菌物种的需求。尽管已经发现了许多由PTS介导的控制机制,但新的与PTS相关的调节功能仍在不断涌现。最近几年,PTSNtr在不同模型细菌中的几种功能已有报道,但PTSNtr与特定代谢途径的调节之间的直接联系尚不清楚。人们对细菌如何通过PTS平衡碳和氮代谢的机制了解有限,表明PTSNtr和PTSSugar两种系统之间存在串扰的证据不多,且α-酮戊二酸和谷氨酰胺在控制大肠杆菌PTSNtr活性中的生理作用也尚不明晰。此外,虽然大量研究表明PTS在各种环境压力下具有调控作用,但整体研究系统性较差,而且在压力作用下PTS对全局代谢变化的影响也知之甚少。
众所周知,耐药性是困扰临床治疗感染性疾病的难题之一。通过深入研究细菌耐药机制,找出关键靶点,采取新策略降低细菌的药物耐受力,大幅提高药物杀菌活性,就能有效遏制耐药性产生。目前我们进行的大量研究发现,不断积累的ROS可导致细菌被抗生素和其他类型的致死性压力杀死[65-69]。因此,ROS毒性可能是压力应激介导的细胞死亡所涉及的共同机制。研究清楚调节碳氮中心代谢等复杂调节功能的PTS与ROS产生之间的关系对于深入探究细菌的抗生素耐受机制大有裨益。因此,下一步我们可以对PTS所影响的调控网络和代谢通路以及这些调控网络和代谢通路对细菌压力应激能力的影响进行深入研究,这可能会在细菌的抗压能力方面有新的发现;而且,PTS并不存在于动植物中,因此,PTS也有可能作为细菌特异性药物靶标用于新药物的研发,相关研究可为降低临床耐药和促进新药研发提供指导。
致谢: 感谢厦门大学公共卫生学院病原微生物与抗感染治疗课题组的博士生曾洁、朱伟伟在文献撰写方面提供的宝贵意见和建议。| [1] |
Pflüger-Grau K, de Lorenzo V. From the phosphoenolpyruvate phosphotransferase system to selfish metabolism: a story retraced in Pseudomonas putida[J]. FEMS Microbiology Letters, 2014, 356(2): 144-153. DOI:10.1111/1574-6968.12459 |
| [2] |
Kundig W, Ghosh S, Roseman S. Phosphate bound to histidine in a protein as an intermediate in a novel phospho-transferase system[J]. Proceedings of the National Academy of Sciences of the United States of America, 1964, 52(4): 1067-1074. DOI:10.1073/pnas.52.4.1067 |
| [3] |
Deutscher J, Francke C, Postma PW. How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria[J]. Microbiology and Molecular Biology Reviews, 2006, 70(4): 939-1031. |
| [4] |
Postma PW, Lengeler JW. Phosphoenolpyruvate: carbohydrate phosphotransferase system of bacteria[J]. Microbiological Reviews, 1985, 49(3): 232-269. DOI:10.1128/MMBR.49.3.232-269.1985 |
| [5] |
Long CP, Au J, Sandoval NR, et al. Enzyme I facilitates reverse flux from pyruvate to phosphoenolpyruvate in Escherichia coli[J]. Nature Communications, 2017, 8(1): 14316. DOI:10.1038/ncomms14316 |
| [6] |
Deutscher J, Aké FMD, Derkaoui M, et al. The bacterial phosphoenolpyruvate: carbohydrate phosphotransferase system: regulation by protein phosphorylation and phosphorylation-dependent protein-protein interactions[J]. Microbiology and Molecular Biology Reviews, 2014, 78(2): 231-256. |
| [7] |
Heravi KM, Altenbuchner J. Cross talk among transporters of the phosphoenolpyruvate-dependent phosphotransferase system in Bacillus subtilis[J]. Journal of Bacteriology, 2018, 200(19): e00213-18. |
| [8] |
Gabor E, Göhler AK, Kosfeld A, et al. The phosphoenol pyruvate-dependent glucose-phosphotransferase system from Escherichia coli K-12 as the center of a network regulating carbohydrate flux in the cell[J]. European Journal of Cell Biology, 2011, 90(9): 711-720. DOI:10.1016/j.ejcb.2011.04.002 |
| [9] |
Crigler J, Bannerman-Akwei L, Cole AE, et al. Glucose can be transported and utilized in Escherichia coli by an altered or overproduced N-acetylglucosamine phosphotransferase system (PTS)[J]. Microbiology, 2018, 164(2): 163-172. |
| [10] |
Saier Jr MH, Hvorup RN, Barabote RD. Evolution of the bacterial phosphotransferase system: From carriers and enzymes to group translocators[J]. Biochemical Society Transactions, 2005, 33(1): 220-224. |
| [11] |
Yoo W, Yoon H, Seok YJ, et al. Fine-tuning of amino sugar homeostasis by EⅡANtr in Salmonella typhimurium[J]. Scientific Reports, 2016, 6: 33055. DOI:10.1038/srep33055 |
| [12] |
Speiser Y, Zusman T, Pasechnek A, et al. The Legionella pneumophila incomplete phosphotransferase system is required for optimal intracellular growth and maximal expression of PmrA-regulated effectors[J]. Infection and Immunity, 2017, 85(6): e00121-17. |
| [13] |
Dozot M, Poncet S, Nicolas C, et al. Functional characterization of the incomplete phosphotransferase system (PTS) of the intracellular pathogen Brucella melitensis[J]. PLoS One, 2010, 5(9): e12679. DOI:10.1371/journal.pone.0012679 |
| [14] |
Lee CR, Park YH, Kim M, et al. Reciprocal regulation of the autophosphorylation of enzyme INtr by glutamine and α-ketoglutarate in Escherichia coli[J]. Molecular Microbiology, 2013, 88(3): 473-485. DOI:10.1111/mmi.12196 |
| [15] |
Ronneau S, Petit K, de Bolle X, et al. Phosphotransferase-dependent accumulation of (p)ppGpp in response to glutamine deprivation in Caulobacter crescentus[J]. Nature Communications, 2016, 7(1): 11423. DOI:10.1038/ncomms11423 |
| [16] |
Strickland M, Kale S, Strub MP, et al. Potential regulatory role of competitive encounter complexes in paralogous phosphotransferase systems[J]. Journal of Molecular Biology, 2019, 431(12): 2331-2342. DOI:10.1016/j.jmb.2019.04.040 |
| [17] |
Zimmer B, Hillmann A, Görke B. Requirements for the phosphorylation of the Escherichia coli EⅡANtr protein in vivo[J]. FEMS Microbiology Letters, 2008, 286(1): 96-102. DOI:10.1111/j.1574-6968.2008.01262.x |
| [18] |
Chavarría M, Fuhrer T, Sauer U, et al. Cra regulates the cross-talk between the two branches of the phosphoenolpyruvate: phosphotransferase system of Pseudomonas putida[J]. Environmental Microbiology, 2013, 15(1): 121-132. DOI:10.1111/j.1462-2920.2012.02808.x |
| [19] |
Zhang X. The effects of single gene deletion in the phosphoenolpyruvate-dependent glucose-specific phosphotransferase system on Escherichia coli hysiological characters[D]. Jinan: Master's Thesis of Shandong University, 2014 (in Chinese) 张旭.葡萄糖专一性磷酸转移酶系统单基因缺失对大肠杆菌生理特性的影响[D].济南: 山东大学硕士学位论文, 2014 http://d.wanfangdata.com.cn/thesis/Y2594526 |
| [20] |
Jeckelmann JM, Erni B. Carbohydrate transport by group translocation: the bacterial phosphoenolpyruvate: sugar phosphotransferase system[A]//Kuhn A. Bacterial Cell Walls and Membranes[M]. Cham: Springer, 2019: 223-274
|
| [21] |
Rodríguez-Díaz J, Rubio-del-Campo A, Yebra MJ. Lactobacillus casei ferments the N-acetylglucosamine moiety of fucosyl-α-1, 3-n-acetylglucosamine and excretes L-fucose[J]. Applied and Environmental Microbiology, 2012, 78(13): 4613-4619. DOI:10.1128/AEM.00474-12 |
| [22] |
Mijakovic I, Poncet S, Galinier A, et al. Pyrophosphate-producing protein dephosphorylation by HPr kinase/phosphorylase: a relic of early life?[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(21): 13442-13447. DOI:10.1073/pnas.212410399 |
| [23] |
Lee CR, Cho SH, Yoon MJ, et al. Escherichia coli enzyme ⅡANtr regulates the K+ transporter TrkA[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(10): 4124-4129. DOI:10.1073/pnas.0609897104 |
| [24] |
Choi J, Shin D, Yoon H, et al. Salmonella pathogenicity island 2 expression negatively controlled by EⅡANtr-SsrB interaction is required for Salmonella virulence[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(47): 20506-20511. DOI:10.1073/pnas.1000759107 |
| [25] |
Hogema BM, Arents JC, Bader R, et al. Inducer exclusion in Escherichia coli by non-PTS substrates: the role of the PEP to pyruvate ratio in determining the phosphorylation state of enzyme ⅡAGlc[J]. Molecular Microbiology, 1998, 30(3): 487-498. |
| [26] |
Doucette CD, Schwab DJ, Wingreen NS, et al. α-ketoglutarate coordinates carbon and nitrogen utilization via enzyme I inhibition[J]. Nature Chemical Biology, 2011, 7(12): 894-901. DOI:10.1038/nchembio.685 |
| [27] |
Venditti V, Ghirlando R, Clore GM. Structural basis for enzyme I inhibition by α-ketoglutarate[J]. ACS Chemical Biology, 2013, 8(6): 1232-1240. DOI:10.1021/cb400027q |
| [28] |
Venditti V, Tugarinov V, Schwieters CD, et al. Large interdomain rearrangement triggered by suppression of micro- to millisecond dynamics in bacterial enzyme I[J]. Nature Communications, 2015, 6(1): 5960. DOI:10.1038/ncomms6960 |
| [29] |
Deutscher J. The mechanisms of carbon catabolite repression in bacteria[J]. Current Opinion in Microbiology, 2008, 11(2): 87-93. DOI:10.1016/j.mib.2008.02.007 |
| [30] |
Wang X, Xia K, Yang XJ, et al. Growth strategy of microbes on mixed carbon sources[J]. Nature Communications, 2019, 10(1): 1279. DOI:10.1038/s41467-019-09261-3 |
| [31] |
Viana R, Monedero V, Dossonnet V, et al. Enzyme I and HPr from Lactobacillus casei: their role in sugar transport, carbon catabolite repression and inducer exclusion[J]. Molecular Microbiology, 2000, 36(3): 570-584. |
| [32] |
Bringhurst RM, Gage DJ. Control of inducer accumulation plays a key role in succinate-mediated catabolite repression in Sinorhizobium meliloti[J]. Journal of Bacteriology, 2002, 184(19): 5385-5392. DOI:10.1128/JB.184.19.5385-5392.2002 |
| [33] |
Collier DN, Hager PW, Phibbs Jr PV. Catabolite repression control in the Pseudomonads[J]. Research in Microbiology, 1996, 147(6/7): 551-561. |
| [34] |
Aranda-Olmedo I, Ramos JL, Marqués S. Integration of signals through Crc and ptsN in catabolite repression of Pseudomonas putida TOL plasmid pww0[J]. Applied and Environmental Microbiology, 2005, 71(8): 4191-4198. DOI:10.1128/AEM.71.8.4191-4198.2005 |
| [35] |
Santillán S, Mackey MC. Influence of catabolite repression and inducer exclusion on the bistable behavior of the lac operon[J]. Biophysical Journal, 2004, 86(3): 1282-1292. |
| [36] |
Hogema BM, Arents JC, Bader R, et al. Inducer exclusion by glucose 6-phosphate in Escherichia coli[J]. Molecular Microbiology, 1998, 28(4): 755-765. |
| [37] |
Harman JG. Allosteric regulation of the cAMP receptor protein[J]. Biochimica et Biophysica Acta (BBA) (BBA) - Protein Structure and Molecular Enzymology, 2001, 1547(1): 1-17. DOI:10.1016/S0167-4838(01)00187-X |
| [38] |
Hogema BM, Arents JC, Inada T, et al. Catabolite repression by glucose 6-phosphate, gluconate and lactose in Escherichia coli[J]. Molecular Microbiology, 1997, 24(4): 857-867. |
| [39] |
Huergo LF, Dixon R. The emergence of 2-oxoglutarate as a master regulator metabolite[J]. Microbiology and Molecular Biology Reviews, 2015, 79(4): 419-435. |
| [40] |
Park YH, Lee BR, Seok YJ. In vitro reconstitution of catabolite repression in Escherichia coli[J]. Journal of Biological Chemistry, 2006, 281(10): 6448-6454. DOI:10.1074/jbc.M512672200 |
| [41] |
Reitzer L, Schneider BL. Metabolic context and possible physiological themes of σ54-dependent genes in Escherichia coli[J]. Microbiology and Molecular Biology Reviews, 2001, 65(3): 422-444. |
| [42] |
Magasanik B. The regulation of nitrogen utilization in enteric bacteria[J]. Journal of Cellular Biochemistry, 1993, 51(1): 34-40. DOI:10.1002/jcb.240510108 |
| [43] |
Ninfa AJ, Jiang P. PⅡ signal transduction proteins: Sensors of α-ketoglutarate that regulate nitrogen metabolism[J]. Current Opinion in Microbiology, 2005, 8(2): 168-173. DOI:10.1016/j.mib.2005.02.011 |
| [44] |
Pflüger-Grau K, Chavarría M, de Lorenzo V. The interplay of the EⅡANtr component of the nitrogen-related phosphotransferase system (PTSNtr) of Pseudomonas putida with pyruvate dehydrogenase[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2011, 1810(10): 995-1005. DOI:10.1016/j.bbagen.2011.01.002 |
| [45] |
Choi J, Ryu S. Regulation of iron uptake by fine-tuning the iron responsiveness of the iron sensor fur[J]. Applied and Environmental Microbiology, 2019, 85(9): e03026-18. |
| [46] |
Lüttmann D, Heermann R, Zimmer B, et al. Stimulation of the potassium sensor KdpD kinase activity by interaction with the phosphotransferase protein ⅡANtr in Escherichia coli[J]. Molecular Microbiology, 2009, 72(4): 978-994. |
| [47] |
Prell J, Mulley G, Haufe F, et al. The PTSNtr system globally regulates ATP-dependent transporters in Rhizobium leguminosarum[J]. Molecular Microbiology, 2012, 84(1): 117-129. |
| [48] |
Wolf S, Pflüger-Grau K, Kremling A. Modeling the interplay of Pseudomonas putida EⅡANtr with the potassium transporter KdpFABC[J]. Journal of Molecular Microbiology and Biotechnology, 2015, 25(2/3): 178-194. |
| [49] |
Deuschle M, Limbrunner S, Rother D, et al. Interplay of the PtsN (EⅡANtr) protein of Pseudomonas putida with its target sensor kinase KdpD[J]. Environmental Microbiology Reports, 2015, 7(6): 899-907. DOI:10.1111/1758-2229.12323 |
| [50] |
Sharma R, Shimada T, Mishra VK, et al. Growth inhibition by external potassium of Escherichia coli lacking PtsN (EⅡANtr) is caused by potassium limitation mediated by YcgO[J]. Journal of Bacteriology, 2016, 198(13): 1868-1882. DOI:10.1128/JB.01029-15 |
| [51] |
Bier N, Hammerstrom TG, Koehler TM. Influence of the phosphoenolpyruvate: carbohydrate phosphotransferase system on toxin gene expression and virulence in Bacillus anthracis[J]. Molecular Microbiology, 2020, 113(1): 237-252. |
| [52] |
Cao TN, Joyet P, Aké FMD, et al. Studies of the Listeria monocytogenes cellobiose transport components and their impact on virulence gene repression[J]. Journal of Molecular Microbiology and Biotechnology, 2019. DOI:10.1159/000500090 |
| [53] |
Lin DS, Xu L, Li FY, et al. Construction of mutant strain of Klebsiella pneumoniae fructose-specific phosphotransferase systemsubunit ⅡC encoded by frwC gene and analysis of its phenotypes[J]. Journal of Xi'an Jiaotong University (Medical Sciences), 2018, 39(6): 788-792. (in Chinese) 林迪斯, 徐丽, 李飞雨, 等. 肺炎克雷伯菌果糖磷酸转移酶系统EⅡC编码基因frwC缺失株的构建及表型分析[J]. 西安交通大学学报:医学版, 2018, 39(6): 788-792. |
| [54] |
Lim S, Seo HS, Jeong J, et al. Understanding the multifaceted roles of the phosphoenolpyruvate: phosphotransferase system in regulation of Salmonella virulence using a mutant defective in ptsI and crr expression[J]. Microbiological Research, 2019, 223-225: 63-71. DOI:10.1016/j.micres.2019.04.002 |
| [55] |
Yoo W, Kim D, Yoon H, et al. Enzyme ⅡANtr regulates Salmonella invasion via 1, 2-propanediol and propionate catabolism[J]. Scientific Reports, 2017, 7(1): 44827. DOI:10.1038/srep44827 |
| [56] |
Zhi Y, Lin SM, Jang AY, et al. Effective mucosal live attenuated Salmonella vaccine by deleting phosphotransferase system component genes ptsI and crr[J]. Journal of Microbiology, 2019, 57(1): 64-73. |
| [57] |
Dalebroux ZD, Swanson MS. ppGpp: magic beyond RNA polymerase[J]. Nature Reviews Microbiology, 2012, 10(3): 203-212. DOI:10.1038/nrmicro2720 |
| [58] |
Karstens K, Zschiedrich CP, Bowien B, et al. Phosphotransferase protein EⅡANtr interacts with SpoT, a key enzyme of the stringent response, in Ralstonia eutropha H16[J]. Microbiology, 2014, 160(4): 711-722. |
| [59] |
Lüttmann D, Göpel Y, Görke B. The phosphotransferase protein EⅡANtr modulates the phosphate starvation response through interaction with histidine kinase phor in Escherichia coli[J]. Molecular Microbiology, 2012, 86(1): 96-110. |
| [60] |
Bahr T, Lüttmann D, März W, et al. Insight into bacterial phosphotransferase system-mediated signaling by interspecies transplantation of a transcriptional regulator[J]. Journal of Bacteriology, 2011, 193(8): 2013-2026. DOI:10.1128/JB.01459-10 |
| [61] |
Barth E, Gora KV, Gebendorfer KM, et al. Interplay of cellular cAMP levels, σs activity and oxidative stress resistance in Escherichia coli[J]. Microbiology, 2009, 155(5): 1680-1689. |
| [62] |
Lee J, Park YH, Kim YR, et al. Dephosphorylated Npr is involved in an envelope stress response of Escherichia coli[J]. Microbiology, 2015, 161(5): 1113-1123. |
| [63] |
Wu SY, Yu PL, Wheeler D, et al. Transcriptomic study on persistence and survival of Listeria monocytogenes following lethal treatment with nisin[J]. Journal of Global Antimicrobial Resistance, 2018, 15: 25-31. DOI:10.1016/j.jgar.2018.06.003 |
| [64] |
Bai P, Zhang B, Zhao X, et al. Decreased metabolism and increased tolerance to extreme environments in Staphylococcus warneri during long-term spaceflight[J]. MicrobiologyOpen, 2019, 8(12): e917. |
| [65] |
Zhao XL, Drlica K. Reactive oxygen species and the bacterial response to lethal stress[J]. Current Opinion in Microbiology, 2014, 21: 1-6. DOI:10.1016/j.mib.2014.06.008 |
| [66] |
Zhao XL, Hong YZ, Drlica K. Moving forward with reactive oxygen species involvement in antimicrobial lethality[J]. Journal of Antimicrobial Chemotherapy, 2015, 70(3): 639-642. DOI:10.1093/jac/dku463 |
| [67] |
Hong YZ, Li LP, Luan G, et al. Contribution of reactive oxygen species to thymineless death in Escherichia coli[J]. Nature Microbiology, 2017, 2(12): 1667-1675. DOI:10.1038/s41564-017-0037-y |
| [68] |
Hong YZ, Zeng J, Wang XH, et al. Post-stress bacterial cell death mediated by reactive oxygen species[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(20): 10064-10071. DOI:10.1073/pnas.1901730116 |
| [69] |
Hong YZ, Li QM, Gao Q, et al. Reactive oxygen species play a dominant role in all pathways of rapid quinolone-mediated killing[J]. Journal of Antimicrobial Chemotherapy, 2020, 75(3): 576-585. DOI:10.1093/jac/dkz485 |
 2020, Vol. 47
2020, Vol. 47