扩展功能
文章信息
- 林标声, 范锦琳, 宋昭昭, 张丽丽, 张煜隆, 林占熺
- LIN Biao-Sheng, FAN Jin-Lin, SONG Zhao-Zhao, ZHANG Li-Li, ZHANG Yu-Long, LIN Zhan-Xi
- 巨菌草不同生长时期的内生固氮菌群组成分析
- Endophytic diazotrophs composition of Pennisetum sp. at different growth stages
- 微生物学通报, 2018, 45(7): 1479-1490
- Microbiology China, 2018, 45(7): 1479-1490
- DOI: 10.13344/j.microbiol.china.170730
-
文章历史
- 收稿日期: 2017-09-15
- 接受日期: 2017-12-05
- 网络首发日期(www.cnki.net): 2018-02-11
2. 龙岩学院生命科学学院 福建 龙岩 364012;
3. 国家菌草工程技术研究中心 福建 福州 350002
2. College of Life Science, Longyan University, Longyan, Fujian 364012, China;
3. National Engineering Research Center of Juncao, Fuzhou, Fujian 350002, China
巨菌草(Pennisetum sp.)为多年生禾本科直立丛生型植物,隶属于狼尾草属,多年生,直立,丛生,根系发达,抗逆性强,产草量高。巨菌草是2005-2007年间由福建农林大学菌草研究所在南非引进的品种,因其在当地生长时植株特别高大,因此将其暂命名为巨菌草,后经鉴定其与国内其他狼尾草略有差别,现正在申报新品种认定[1]。巨菌草目前已经在福建农林大学改良培育而成,为典型的四碳植物,宜在热带、亚热带、温带生长[2]。巨菌草营养丰富,糖分、蛋白质含量高,适口性好,用途广泛,既可作为食(药)用菌的生产原料,又可加工成牛、羊、鹿等动物饲料,还具有较强防风固沙的生态治理功能,是一种具有良好应用潜力的能源草和生态草[3-4]。
巨菌草能在中国的西藏、内蒙古、青海、宁夏等土地贫瘠的沙漠、流动沙丘等地种植生长,其种植后沙地有机质、酶活性及微生物数量有明显增加,固沙效果明显[5]。经测定,种植后菌草的总氮含量超过了其从土壤和肥料中摄取的总氮量,这其中很可能是巨菌草内生固氮菌起了很大的作用[6]。内生固氮菌可以在根际或植物体内进行联合固氮,为植物生长提供氮素或促生长物质,可为植物(如甘蔗)生长提供高达60%的氮素,同时内生固氮菌还可通过分泌植物生长激素等多种生理活性物质与病原菌竞争营养和空间,从多方面促进植物生长,在农业生产实践中具有广阔的应用前景[7]。多年来,许多研究者对甘蔗、玉米、水稻等禾本科植物中发现的多种具有固氮功能内生细菌进行了广泛的研究,已成为联合固氮研究领域的热点[8-10]。因此,巨菌草植物内生固氮菌资源的发掘与利用,可在增强植物的抗逆性、建立高效的固氮体系、促进植物生长、提高植物对土壤中营养物质的利用率、改善荒漠生态环境等方面提供科学基础和技术支持,为将来大力推广荒坡地发展巨菌草、提高菌草生物质产量、开拓内生菌生物肥料应用的新思路、新途径提供科学依据[11]。
植物内生菌的传统研究均是通过纯培养分离的方法,但受培养条件的限制,未可培养菌通常占很大的比例,因而传统的纯培养分析结果往往不能完全反映样本中微生物种类组成的真实情况。近年来,随着科学技术的进步,Illumina、Roche、Ion torrent等高通量测序技术得到了迅猛发展,可一次性对几十万甚至上百万条DNA分子序列进行测定,不仅突破了微生物学基于传统纯培养的限制,而且还可以同时对样本中的优势菌群和微量菌群进行测定,可以更加全面、准确地反映样本中的微生物群落结构关系[12-13]。目前,高通量测序技术在禾本科植物内生菌的研究中应用较少。因此,本研究通过采用Illumina MiSeq第二代测序技术对不同生长时期巨菌草根、茎、叶内生固氮菌的种类分布及其变化规律进行研究,寻找巨菌草可能蕴藏的内生固氮菌,丰富、完善其内生固氮菌的菌种资源库,以期为将来巨菌草内生固氮菌的资源开发及其菌肥研制提供理论支持。
1 材料与方法 1.1 样本的采集及处理在福建农林大学旗山校区菌草研究所试验基地从2017年2-6月同一试验地采集了5个不同生长时间的巨菌草根、茎、叶,样本采集后立即清洗干净,每个生长时期各样本采用不同分布多位点采集,混合均匀后装入无菌封口塑料袋,带回实验室处理,共15个样本。在整个试验期间,共取样3批次,试验重复了3次。各样本采样时的环境因素(空气相对湿度、温度和土壤pH)如表 1所示。
| 样本序号及生长时期 Sample number and growth period |
空气相对湿度 Humidity (% RH) |
温度 Temperature (℃) |
土壤pH Soil pH |
| 苗期(序号1-3) Seedling (serial number 1-3) | 48 | 22.3 | 7.2 |
| 分蘖期(序号4-6) Tillering (serial number 4-6) | 52 | 25.4 | 7.1 |
| 拔节期(序号7-9) Jointing (serial number 7-9) | 58 | 26.3 | 7.2 |
| 成熟期(序号10-12) Mature (serial number 10-12) | 54 | 26.7 | 7.3 |
| 衰亡期(序号13-15) Decay (serial number 13-15) | 46 | 30.4 | 7.1 |
样本DNA提取试剂盒,Omega公司;Q5® High-Fidelity DNA polymerase,New England Biolabs公司。PCR扩增仪,美国应用生物系统公司;电泳仪,北京六一生物科技有限公司;生物分析仪,安捷伦科技有限公司。
LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0,琼脂2.0。
1.3 样本的表面消毒挑选各样本中无病变、品相良好的巨菌草根、茎、叶部位3-5 g,先用流水冲洗1-2 h,再采用75%乙醇、2%次氯酸钠、无菌水依次洗涤。其中75%乙醇浸泡60 s,2% NaClO分别处理根、茎、叶20 min、9 min、90 s进行表面灭菌,无菌水冲洗4次。确认待分离材料是否消毒彻底可采用稀释涂布法,将最后一次的无菌水洗涤液涂布于LB培养基中,30 ℃培养1-2 d,以在LB培养基上无菌生长为消毒合格。
1.4 消毒样本细菌DNA提取、固氮功能基因nifH可变区扩增和高通量测序DNA的提取采用Omega试剂盒,具体方法参照试剂盒说明书。PCR扩增选择长度约为360 bp作为固氮功能基因nifH的扩增片段,进行后续高通量测序。引物序列为:引物F:5′-TGCGAY CCSAARGCBGACTC-3′;引物R:5′-ATSGCCA TCATYTCRCCGGA-3′[14]。PCR反应体系(25 μL):5×Reaction buffer 5 μL,5×GC buffer 5 μL,dNTPs (2.5 mmol/L) 2 μL,引物F (10 μmol/L) 1 μL,引物R (10 μmol/L) 1 μL,DNA模板2 μL,ddH2O 8.75 μL,Q5 DNA polymerase (2 U/μL) 0.25 μL。PCR反应条件:98 ℃ 2 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃ 30 s,25-30个循环;72 ℃ 5 min。扩增产物进行2%琼脂糖凝胶电泳,切取目的片段用Axygen凝胶回收试剂盒回收目的片段,随后交由上海派森诺生物科技股份有限公司使用Illumina MiSeq高通量测序平台进行序列测定和分析。
1.5 测序结果的生物信息学处理由Illumina MiSeq测序所得Raw reads,取得MiSeq raw data后对原始双端测序数据进行去杂并拼接,然后对拼接后的Paired end数据进行精准去杂,去除低质量的碱基序列及模糊碱基序列。随后对去杂后的数据进行去嵌合体序列处理,最终得到较优质的序列进行下游分析。操作分类单元(Operational taxonomic unit,OTU)是在系统发生学或者群体遗传学研究中,为了便于分析,人为给某一分类单元(品系、属、种、分组等)设置的同一标志。本研究中采用CD-HIT分类方法。将所有序列以97%的相似度进行OTU分类,序列相似度大于或等于97%被归为一个OTU单元,随后以OTU分类中丰度最大的序列为代表序列[15]。
1.6 巨菌草植物样本的固氮酶活性测定各样本的全氮含量采用凯氏定氮法测定[16]。
固氮酶活性采用植物固氮酶和细菌固氮酶ELISA试剂盒[17]、瑞士帝肯Tecan Sunrise F50酶标仪测定。试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。往预先包被固氮酶(Nitrogenase)抗体的包被微孔中依次加入标本、标准品、HRP (Horseradish peroxidase)标记的检测抗体,经过37 ℃温育并彻底洗涤。用底物TMB (3, 3′, 5, 5′-Tetramethyl-benzidine)显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色深浅和样品中的固氮酶(Nitrogenase)呈正相关。用酶标仪在450 nm波长下测定吸光度(OD450值),计算样品浓度。
2 结果与分析 2.1 巨菌草植物样本的固氮酶活性测定不同生长时期巨菌草根、茎、叶的固氮酶活性测定结果如图 1所示:不同生长时期的固氮酶活性均是先升高后降低,且在同一生长时期内均为根 > 叶 > 茎,根的固氮酶活性在成熟期达到最高,茎、叶的固氮酶活性在拔节期达到最高。
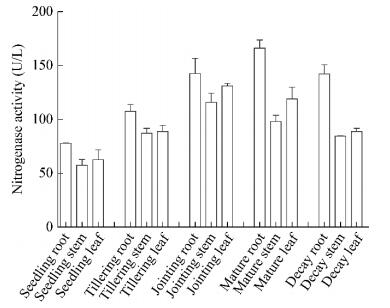
|
| 图 1 不同生长时期巨菌草的固氮酶活性 Figure 1 The nitrogenase activity of Pennisetum sp. in different growth periods |
|
|
从各样本中提取的基因组DNA电泳结果见图 2,提取样本细菌nifH可变区扩增结果如图 3所示,结果表明其PCR产物目标条带大小正确,浓度满足建库需要。
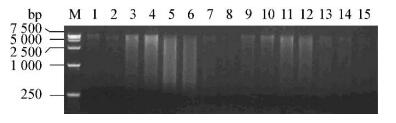
|
| 图 2 各样本DNA的电泳结果 Figure 2 The results of DNA electrophoresin each sample 注:1-3:苗期根、茎、叶;4-6:分蘖期根、茎、叶;7-9:拔节期根、茎、叶;10-12:成熟期根、茎、叶;13-15:衰亡期根、茎、叶. M:DL15000 marker. Note: 1-3: Roots, stems, leaves in seedling stage; 4-6: Roots, stems, leaves in tillering stage; 7-9: Roots, stems, leaves in jointing stage; 10-12: Roots, stems, leaves in mature stage; 13-15: Roots, stems, leaves in decay stage, same as below. M: DL15000 marker. |
|
|
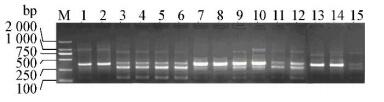
|
| 图 3 各样本nifH可变区扩增结果图 Figure 3 The amplification results of nifH variable range in each sample 注:1-3:苗期根、茎、叶;4-6:分蘖期根、茎、叶;7-9:拔节期根、茎、叶;10-12:成熟期根、茎、叶;13-15:衰亡期根、茎、叶. M:DL2000 marker. Note: 1-3: Roots, stems, leaves in seedling stage; 4-6: Roots, stems, leaves in tillering stage; 7-9: Roots, stems, leaves in jointing stage; 10-12: Roots, stems, leaves in mature stage; 13-15: Roots, stems, leaves in decay stage. M: DL2000 marker. |
|
|
通过对测序所得序列进行预处理,去除低质量序列和模糊序列,不同生长时期巨菌草根、茎、叶15个样本分别得到4-6万条Index完全匹配的有效序列量(表 2),在不同生长时期OTU数量均为根 > 叶 > 茎,菌群微生物多样性指数ACE、Chao1、Shannon、Simpson均为根 > 叶 > 茎,且整体变化趋势均是先升高再降低,表明巨菌草在不同生长时期的内生固氮菌群丰度和多样性变化趋势均为先逐步升高再降低,同一生长时期内均是根 > 叶 > 茎,其变化趋势与植物样本的固氮酶活性变化趋势一致。
| 对象 Targets |
样本编号 Samples |
测序量 Numbers of valid sequences |
OTUs | 多样性指数Diversity indexes | |||
| ACE | Chao1 | Shannon | Simpson | ||||
| 苗期 Seedling |
根1 (Root sample 1) | 48 321 | 1 242 | 598.65 | 598.72 | 6.90 | 0.95 |
| 茎2 (Root sample 2) | 57 960 | 308 | 222.76 | 207.50 | 1.37 | 0.90 | |
| 叶3 (Root sample 3) | 54 653 | 466 | 372.66 | 367.82 | 5.61 | 0.91 | |
| 分蘖期 Tillering |
根4 (Root sample 4) | 40 693 | 1 286 | 686.29 | 693.52 | 6.85 | 0.96 |
| 茎5 (Root sample 5) | 48 389 | 424 | 294.03 | 283.52 | 4.00 | 0.92 | |
| 叶6 (Root sample 6) | 58 398 | 495 | 393.56 | 388.51 | 5.18 | 0.94 | |
| 拔节期 Jointing |
根7 (Root sample 7) | 41 431 | 1 339 | 732.00 | 732.00 | 6.85 | 0.98 |
| 茎8 (Root sample 8) | 64 079 | 535 | 364.33 | 357.90 | 4.82 | 0.95 | |
| 叶9 (Root sample 9) | 66 024 | 540 | 480.78 | 477.82 | 4.98 | 0.98 | |
| 成熟期 Mature |
根10 (Root sample 10) | 46 865 | 1 397 | 739.99 | 759.88 | 7.73 | 0.99 |
| 茎11 (Root sample 11) | 66 203 | 447 | 359.11 | 358.64 | 6.64 | 0.94 | |
| 叶12 (Root sample 12) | 58 159 | 483 | 439.82 | 432.97 | 5.48 | 0.96 | |
| 衰亡期 Decay |
根13 (Root sample 13) | 52 098 | 1 071 | 628.98 | 625.24 | 6.45 | 0.97 |
| 茎14 (Root sample 14) | 62 424 | 436 | 278.57 | 273.95 | 5.53 | 0.93 | |
| 叶15 (Root sample 15) | 62 592 | 469 | 403.08 | 401.65 | 5.16 | 0.95 | |
从细菌的有效序列长度图(图 4)可以看出,细菌序列主要分布在360 bp左右。利用Mothur软件做稀释性曲线分析,从各样本中细菌的Rarefaction曲线(图 5)可以看出,15条曲线均趋向平坦,不同生长时期的根、茎、叶曲线均较为集中地聚类在一起,表明所测序数据量合理,大多数细菌类群包括在各样本文库中,能够比较真实地反映样本的微生物群落多样性[18]。
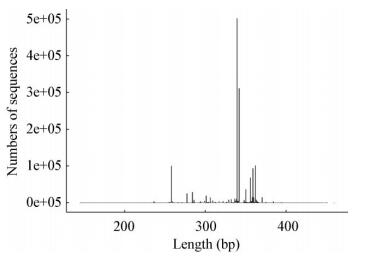
|
| 图 4 各样本序列长度分布图 Figure 4 Length distribution in each sample |
|
|
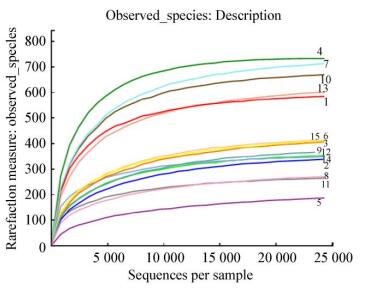
|
| 图 5 15个样本的稀释度曲线 Figure 5 Rarefaction curves of 15 samples |
|
|
从门的分类水平来看(图 6),不同生长时期巨菌草根、茎、叶的内生细菌中有大量不可分类的门类,丰度为5.9%-92.3%;在可定义的门类中,各样本均以变形菌门(Proteobacteria)和蓝藻菌门(Cyanobacteria)为主,始终存在于各个生长时期,其丰度分别为0.9%-42.8%和0.1%-6.8%。在各生长时期,各样本中菌群分布较多、丰度较高的种类还包括放线菌门(Actinobacteria)和厚壁菌门(Firmicutes),丰度分别为0.045%-1.2%和0.021%-0.3%;还有少量的螺旋体门(Spirochaetes)和拟杆菌门(Bacteroidetes),丰度分别为0.03%-0.5%和0.02%-0.1%。此外,在成熟期,根部还具有特有的微量的栖热链球菌门(Deinococcus- Thermus)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi),丰度均小于0.01%;在拔节期,茎、叶部具有特有的微量的浮霉菌门(Planctomycetes),丰度也均小于0.01%。
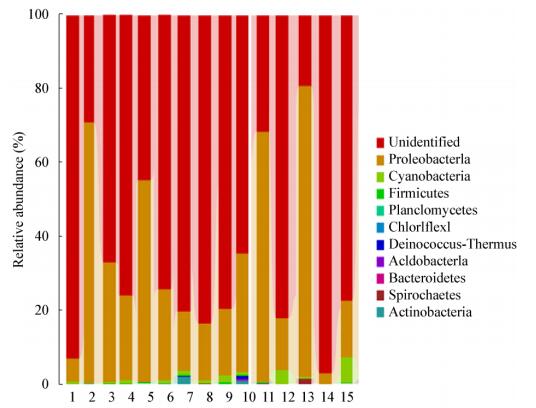
|
| 图 6 各样本在门分类水平上的主要细菌类群比较 Figure 6 Comparison of the major bacterial class in each sample on phylum level |
|
|
在属的水平上,取所有样本中平均相对丰度前20位的菌群,剩余所有分类单元都归为“Other”后再作图,观察巨菌草在不同生长时期的内生固氮菌群分布变化情况(图 7)。结果表明,各样本菌群丰度和种类的变化趋势也均是先升高后降低;在同一生长时期,根中的微生物菌群种类和丰度均要明显多于茎和叶,且根 > 叶 > 茎。在各个样本中,未知种类占很大的比例,丰度在3.9%-89.1%。在已知菌属中,克雷伯氏菌属(Klebsiella)、草螺菌属(Herbaspirillum)和慢生根瘤菌(Bradyrhizobium)为核心属,始终存在于各个样本中,其丰度也最高,分别为0.13%-10.2%、0.11%-24.8%和0.09%-9.0%。在各生长时期,各样本中菌群分布较多、丰度较高的种类为红假单胞菌属(Rhodopseudomonas)、产腥藻属(Anabaena)、丛毛单胞菌属(Comamonas)、鞘氨醇单胞菌属(Sphingomonas)、根瘤菌属(Rhizobium)和阿菲菌属(Afipia),其丰度分别为0.03%-3.1%、0.02%-05%、0.02%-0.6%、0.02%-0.1%、0.01%-0.3%和0.02%-7.4%。其他相对丰度的菌群还有食酸菌属(Acidovora)、Kosakonia、鞘氨醇菌属(Sphingobium)、双歧杆菌属(Bifidobacteriu)、考克菌属(Kocuria)、Rubinisphaera、中慢生根瘤菌属(Mesorhizobium)、产氢细菌属(Ethanoligenens)、极地单胞菌属(Polaromonas)和分枝杆菌属(Mycobacterium),它们为变形菌门、放线菌门和拟杆菌门的细菌,其丰度均小于0.01%。此外,各个样本中还存在着大量“Other”菌属,其丰度比例在0.5%-23.8%之间不等,衰亡期(序号13-15)中“Others”菌属的丰度较其他时期略高,原因可能是巨菌草生长时期延长,内生侵入菌群增多;另外,可能因为植物生长末期抗性降低,大量外部微生物菌群更易侵染植物,导致其内生菌群种类增多[19],如禾本科植物的白叶枯黄致病菌黄单胞菌属(Xanthomonas)在衰亡期根、茎、叶中出现,但在其他时期未发现。
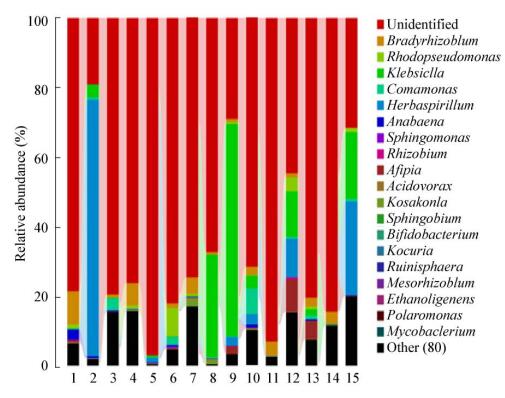
|
| 图 7 各样本在属分类水平上主要细菌类群比较 Figure 7 Comparison of the major bacterial class in each sample on genus level |
|
|
基于GraPhlAn的样本总体分类绘制等级树图,相对丰度前20位的分类单元已在图 8中显示。图 8结果表明:门水平上丰度较高的是变形菌门(Proteobacteria)和蓝藻菌门(Cyanobacteria),而且主要以变形菌门(Proteobacteria)为主;属水平上丰度较高的是克雷伯氏菌属(Klebsiella)、草螺菌属(Herbaspirillum)、慢生根瘤菌(Bradyrhizobium)和阿菲菌属(Afipia),所得结果与上述分类统计结果一致。此外,克雷伯氏菌属(Klebsiella)是禾本科植物主要的固氮菌属[20],图 8中节点大小表明,克雷伯氏菌属(Klebsiella)的丰度明显高于其他菌属。从图 8中还可看出拉乌尔菌属(Raoultella)和固氮螺菌属(Azospirillum)丰度也较高,特别是固氮螺菌属(Azospirillum)的发现拓宽了巨菌草中分离特定固氮菌群的种类[21]。根据本实验所测定各样本物种丰度及群落结构分析的数据,发现固氮螺菌属(Azospirillum)在巨菌草中主要分布在各生长时期的根部,丰度为0.3%-1.8%,且在成熟期丰度最高;另外,成熟期的茎部也有少量分布,丰度为0.14%。
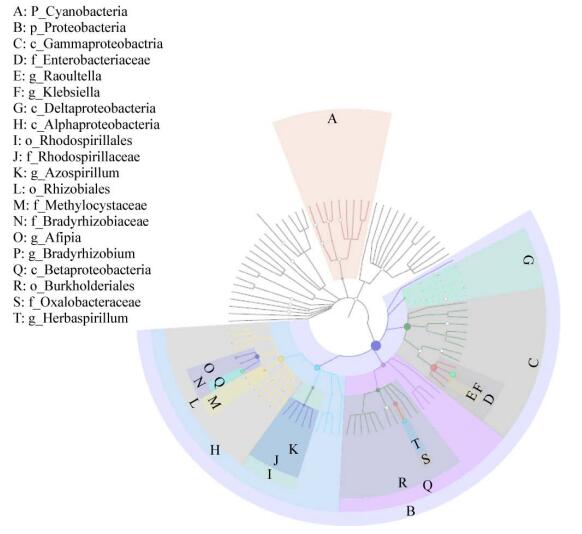
|
| 图 8 基于GraPhlAn的样本总体分类等级树图 Figure 8 The classification hierarchy tree of entire samples based on the GraPhlAn |
|
|
使用R软件,对丰度前50位的属进行聚类分析到Heatmap (图 9),结果表明:同一部位来源的样本,如来自根部(序号1、4、7、10、13)和叶部(序号3、6、9、12、15)的样本可以较好地聚类在一起,相互之间没有交叉;但茎部样本(序号2、5、8、11、14)较为分散,其内部之间与根部、叶部样本之间交叉聚类,表明根部和叶部的内生固氮菌群可能通过特定的运输途径转移到茎部。图 9中颜色梯度的变化结果表明,根部内生菌群样本的颜色要明显深于茎、叶部样本,表明根部各类菌群的丰度及表达量均明显高于茎、叶部。不同生长时期各样本的菌群组成不同,变化较为复杂;其中序号10为根部成熟期样本,其表达的颜色最深,表明其菌群种类和丰富表达量最高。此外,克雷伯氏菌属(Klebsiella)在各个样本中均有较高表达,在序号7、10样本中表达量最高;伯克氏菌属(Burkholderia)、固氮菌属(Azotobacte)、阴沟肠杆菌属(Enterobacter)、固氮根瘤菌属(Azorhizobium)、固氮螺菌属(Azospirillum)等其他几种禾本科植物最主要的联合固氮菌属[22]均在序号10样本中表达量较高。
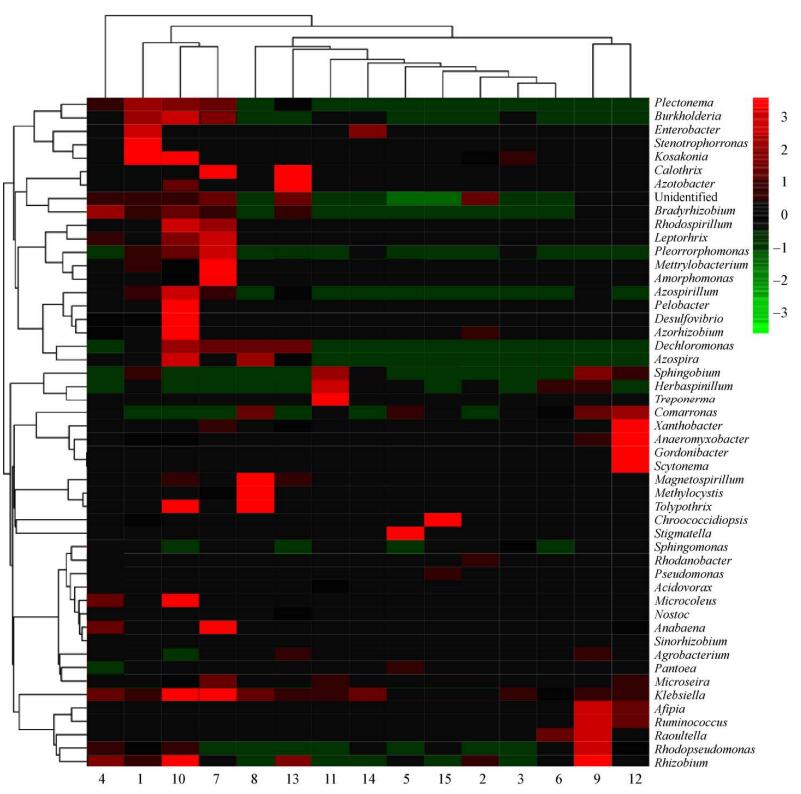
|
| 图 9 各样本中属水平微生物菌群Heatmap分析 Figure 9 Heatmap analysis of microbial community under the genus level in each sample |
|
|
通过R软件,对属水平的群落组成结构进行主成分分析(图 10),其第1主成分和第2主成分的贡献率分别为88.21%和8.31%,根部(序号1、4、7、10、13)和叶部(序号3、6、9、12、15)样本可以较好地聚类在一起,茎部样本(序号2、5、8、11、14)较为分散,所得结果基本与Heatmap结果相吻合。
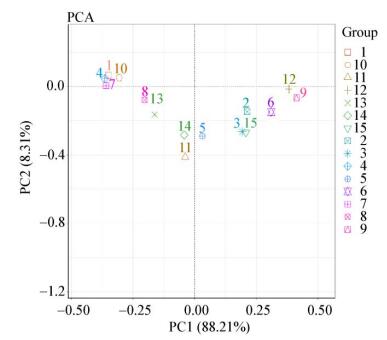
|
| 图 10 各样本中属水平微生物菌群主成分分析 Figure 10 Principal component analysis (PCA) of microbial community under the genus level in each sample |
|
|
采用Canoco for Windows 4.5软件对属水平丰度最高的前20个属进行典范对应分析(Canonical correspondence analysis,CCA),研究土壤水分、温度和pH等环境因素对样本微生物菌属的改变情况(图 11)。结果表明:Axis1和Axis2排序轴对各样本细菌属的变化分别解释了38.4%和29.8%的变异,即所有的环境因素对总变异共有68.2%的解释度。图 11中,丰度前20位的主要细菌属的变化与温度有关,依次是湿度和pH。湿度和pH变量箭头之间的夹角较小,可能它们之间对细菌属的变化具有协同效应[23]。20个属中有11个属与温度呈正相关,其中包括克雷伯氏菌属(Klebsiella),表明较高的温度条件下巨菌草内生固氮菌群增多,联合固氮作用增强,有利于植物的生长。

|
| 图 11 环境因素对各样本微生物菌群组成影响的典范对应分析 Figure 11 Canonical correspondence analysis (CCA) on the environmental factors influence of microbial community composition in each sample |
|
|
本文首次采用了高通量测序技术研究了巨菌草微生物内生固氮菌群的变化情况,结果表明不同生长时期巨菌草根、茎、叶菌群组成及丰度存在着较大的差异,其15个样本分别得到4-6万条有效序列,主要分布在360 bp左右。从门到属的水平上看,根部巨菌草内生固氮菌群组成在成熟期最高,茎部和叶部均为拔节期较高,在同一生长时期则为根 > 叶 > 茎,其变化趋势与巨菌草植物样本的固氮酶活性变化趋势一致;变形菌门(Proteobacteria)和蓝藻菌门(Cyanobacteria)是巨菌草内生固氮菌群的主要门类,其他丰度较高的种类还包括放线菌门(Actinobacteria)和厚壁菌门(Firmicutes);属水平上,克雷伯氏菌属(Klebsiella)、草螺菌属(Herbaspirillum)和慢生根瘤菌(Bradyrhizobium)为核心属,均始终存在于巨菌草不同生长时期的根、茎、叶中,其他较高丰度的属还包括红假单胞菌属(Rhodopseudomonas)、产腥藻属(Anabaena)、丛毛单胞菌属(Comamonas)、鞘氨醇单胞菌属(Sphingomonas)、根瘤菌属(Rhizobium)和阿菲菌属(Afipia)等。
本研究中,巨菌草不同生长时期根、叶部来源的各自微生物固氮菌群组成较为接近,但茎部来源菌群与根、叶部有交叉,表明其菌群组成可能有部分来源于根和叶部。巨菌草不同生长时期根、茎、叶样本之间微生物菌群组成及丰度差异较大,呈现出不同的变化情况,推测巨菌草从苗期到衰亡期内生菌群的组成可能受到空气湿度、温度、土壤等环境因素的影响。CCA分析表明,温度是影响巨菌草内生固氮菌群变化的主要因素,其次是湿度和pH,且其中丰度最高的20个属中有11个属与温度影响呈正相关,其中包括禾本科植物主要的固氮菌群克雷伯氏菌属(Klebsiella),表明较高的温度条件下巨菌草内生固氮菌群增多,联合固氮作用增强,有利于植物的生长。此外,热图分析表明,巨菌草成熟期根部样本中含有较丰富的固氮菌群种类和丰度,且克雷伯氏菌属(Klebsiella)、伯克氏菌属(Burkholderia)、固氮菌属(Azotobacte)、阴沟肠杆菌属(Enterobacter)、固氮根瘤菌属(Azorhizobium)、固氮螺菌属(Azospirillum)等几种禾本科植物最主要的联合固氮菌属均表达量较高,表明此样本将是主要挖掘巨菌草内生固氮菌群的资源。本文通过对各样本固氮基因nifH的扩增测序,已从相对丰度上表明了巨菌草不同生长时期根、茎、叶中具有nifH的功能菌群间的组成关系,如需进一步探讨这些功能菌群的nifH在各样本中的绝对表达量,将来可采用转录组测序技术再深入分析固氮基因nifH的mRNA在各样本中的差异表达情况。
综上所述,巨菌草茎、叶部的固氮菌群种类和丰度在拔节期最高,根部的在成熟期最高。较高温度条件下,巨菌草各部位内生固氮菌群种类较多且丰度较高,有利于对其进行固氮菌群种质资源的挖掘与开发;其中成熟期根部将是最主要的资源,其含有的禾本科植物最主要几种联合固氮菌群的种类较多且丰度最高,而这些固氮菌群在生物进化理论的探讨、微生物固氮菌肥的研制与生产和农业生物基因工程的应用等方面均具有重要的应用价值[24]。因此,本研究的结果可为进一步挖掘巨菌草可培养、具有应用潜力的内生固氮菌群资源指明方向,并为将来建立巨菌草固氮菌的种质资源库,开发和利用固氮菌生产农用微生物菌剂提供基础依据[25]。
| [1] |
Peng L, Yang YF, Hou YM, et al. The biosafety assessment of introduced Pennisetum sp. in Fujian province, China[J]. Fujian Journal of Agricultural Sciences, 2014, 29(11): 1132-1137. 彭露, 杨一帆, 侯有明, 等. 福建省引种巨菌草Pennisetum sp.的生物安全性评价[J]. 福建农业学报, 2014, 29(11): 1132-1137. DOI:10.3969/j.issn.1008-0384.2014.11.018 |
| [2] |
Lin ZX, Lin DM, Sun HY, et al. Juncao-soybean mixed cropping decreased soybean production but enhanced economic benefits — with China-Rwanda agriculture technology demonstration project as example[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2015, 44(6): 624-628. 林占熺, 林冬梅, 孙红英, 等. 菌草与大豆混种降低大豆产量但提高系统经济效益——以中国援卢旺达农业技术示范项目为例[J]. 福建农林大学学报:自然科学版, 2015, 44(6): 624-628. |
| [3] |
Ding M, Wang LQ, Zhang X, et al. Comparative analysis of nutrient composition in the Pennisetum sp. (Giant juncao) with other forages[J]. Journal of Anhui Agricultural Sciences, 2015, 43(35): 172-173. 丁铭, 王龙清, 张旭, 等. 巨菌草与其他饲草的营养成分比较[J]. 安徽农业科学, 2015, 43(35): 172-173. DOI:10.3969/j.issn.0517-6611.2015.35.062 |
| [4] |
Chen BC, Lin JR, Luo ZZ, et al. Determination of routine nutritional ingredients and amino acid contents of Jujuncao during different growth stages[J]. Guizhou Agricultural Sciences, 2016, 44(1): 101-103, 109. 陈碧成, 林洁荣, 罗宗志, 等. 巨菌草不同生长时间的常规营养成分及氨基酸含量测定[J]. 贵州农业科学, 2016, 44(1): 101-103, 109. |
| [5] |
Liu FS, Lin H, Lin XS, et al. Review on control and remediation of ecologically vulnerable area with Pennisetum giganteum sp.[J]. Guizhou Agricultural Sciences, 2017, 45(7): 111-113. 刘凤山, 林辉, 林兴生, 等. 巨菌草对生态脆弱区治理与修复的研究进展[J]. 贵州农业科学, 2017, 45(7): 111-113. |
| [6] |
Lin XS, Lin ZX, Lin DM, et al. Effects of planting Pennisetum sp. (Giant juncao) on soil microbial functional diversity and fertility in the barren hillside[J]. Acta Ecologica Sinica, 2014, 34(15): 4304-4312. 林兴生, 林占熺, 林冬梅, 等. 荒坡地种植巨菌草对土壤微生物群落功能多样性及土壤肥力的影响[J]. 生态学报, 2014, 34(15): 4304-4312. |
| [7] |
Banik A, Mukhopadhaya SK, Dangar TK. Characterization of N2-fixing plant growth promoting endophytic and epiphytic bacterial community of Indian cultivated and wild rice (Oryza spp.) genotypes[J]. Planta, 2016, 243(3): 799-812. DOI:10.1007/s00425-015-2444-8 |
| [8] |
Govindarajan M, Kwon SW, Weon HY. Isolation, molecular characterization and growth-promoting activities of endophytic sugarcane diazotroph Klebsiella sp. GR9[J]. World Journal of Microbiology and Biotechnology, 2006, 23(7): 997-1006. |
| [9] |
Chaudhary HJ, Peng GX, Hu M, et al. Genetic diversity of endophytic diazotrophs of the wild rice, Oryza alta and identification of the new diazotroph, Acinetobacter oryzae sp. nov.[J]. Microbial Ecology, 2012, 63(4): 813-821. DOI:10.1007/s00248-011-9978-5 |
| [10] |
Sarathambal C, Ilamurugu K, Balachandar D, et al. Characterization and crop production efficiency of diazotrophic isolates from the rhizosphere of semi-arid tropical grasses of India[J]. Applied Soil Ecology, 2015, 87: 1-10. DOI:10.1016/j.apsoil.2014.11.004 |
| [11] |
Li ZW. Characteristics of Pennisetum sp. (Giant juncao) as bioenergy grass[J]. Agriculture Engineering Technology, 2013(6): 12-15. 李志文. 巨菌草作为能源草的特性研究[J]. 农业工程技术(新能源产业), 2013(6): 12-15. |
| [12] |
Zhao S, Zhou N, Zhao ZY, et al. Endophytic bacterial diversity and dynamics in root of Salicornia europaea estimated via high throughput sequencing[J]. Acta Microbiologica Sinica, 2016, 56(6): 1000-1008. 赵帅, 周娜, 赵振勇, 等. 基于高通量测序分析盐角草根部内生细菌多样性及动态规律[J]. 微生物学报, 2016, 56(6): 1000-1008. |
| [13] |
Rau A, Maugis-Rabusseau C, Martin-Magniette ML, et al. Co-expression analysis of high-throughput transcriptome sequencing data with Poisson mixture models[J]. Bioinformatics, 2015, 31(9): 1420-1427. DOI:10.1093/bioinformatics/btu845 |
| [14] |
Poly F, Monrozier LJ, Bally R. Improvement in the RFLP procedure for studying the diversity of nifH genes in communities of nitrogen fixers in soil[J]. Research in Microbiology, 2001, 152(1): 95-103. DOI:10.1016/S0923-2508(00)01172-4 |
| [15] |
Cao R, Liu Q, Zhao L, et al. Microbial flora analysis of oyster during refrigerated storage by high throughput sequencing technology[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(20): 275-280. 曹荣, 刘淇, 赵玲, 等. 基于高通量测序的牡蛎冷藏过程中微生物群落分析[J]. 农业工程学报, 2016, 32(20): 275-280. DOI:10.11975/j.issn.1002-6819.2016.20.036 |
| [16] |
Gao FM, Wu J. Comparison of determining the plant total nitrogen with two methods[J]. Modern Agricultural Science and Technology, 2012(14): 204-205. 高凤梅, 武际. 2种植株全氮测定方法比较[J]. 现代农业科技, 2012(14): 204-205. DOI:10.3969/j.issn.1007-5739.2012.14.141 |
| [17] |
Yang CJ, Fang C, Zhang PD, et al. Analysis on suitability of seawater iron concentration for Plocamium telfairiae[J]. Chinese Journal of Ecology, 2016, 35(8): 2196-2201. 杨超杰, 方超, 张沛东, 等. 海头红的海水铁含量适宜性[J]. 生态学杂志, 2016, 35(8): 2196-2201. |
| [18] |
Chen ZB, Li B, Wang DK, et al. Study on the diversity of endophytic bacteria in maize using Illumina MiSeq High-throughput sequencing system[J]. Modern Food Science and Technology, 2016, 32(2): 113-120. 陈泽斌, 李冰, 王定康, 等. 应用Illumina MiSeq高通量测序技术分析玉米内生细菌多样性[J]. 现代食品科技, 2016, 32(2): 113-120. |
| [19] |
Lin DM, Lin ZX, Sun DW, et al. Effect of planting Juncao on nutrients, enzyme activities and microorganisms of desertified soils[J]. Journal of Henan Agricultural Sciences, 2017, 46(5): 61-65. 林冬梅, 林占熺, 苏德伟, 等. 种植菌草对沙质荒漠化土壤养分、酶活性及微生物的影响[J]. 河南农业科学, 2017, 46(5): 61-65. |
| [20] |
Li MJ, Peng S, Xu SZ, et al. Application of Klebsiella spp. in agriculture and environmental management[J]. Current Biotechnology, 2014, 4(6): 415-420. 李梦娇, 彭晟, 徐绍忠, 等. 克雷伯氏菌在农业与环境治理上的应用[J]. 生物技术进展, 2014, 4(6): 415-420. |
| [21] |
Li SC, Nie YF. Study on nodulation and nitrogen fixation of Azospirillum brasilense induced by 2, 4-D in the roots of maize[J]. Shandong Agricultural Sciences, 2001(4): 12-14. 李素翠, 聂延富. 2, 4-D诱导固氮螺菌在玉米根部结瘤及固氮效果的研究[J]. 山东农业科学, 2001(4): 12-14. |
| [22] |
Sun MM, Diao ZM, Wang HS. Research status and application prospect on the endophytic nitrogen-fixing of gramineae grass[J]. Qinghai Prataculture, 2013, 22(1): 35-41. 孙苗苗, 刁治民, 王恒生. 禾草内生固氮菌的研究现状及应用前景[J]. 青海草业, 2013, 22(1): 35-41. |
| [23] |
Zheng HY, Li ZK, Li C, et al. Analysis of the bacterial diversity and dominant population in Akesu Saline-alkali in Xinjian[J]. Microbiology China, 2012, 39(7): 1031-1043. 郑贺云, 黎志坤, 李超, 等. 新疆阿克苏地区盐碱地细菌类群多样性及优势菌群分析[J]. 微生物学通报, 2012, 39(7): 1031-1043. |
| [24] |
Yang YD, Feng XM, Hu YG, et al. Effects of legume-oat intercropping on abundance and community structure of soil N2-fixing bacteria[J]. Chinese Journal of Applied Ecology, 2017, 28(3): 957-965. 杨亚东, 冯晓敏, 胡跃高, 等. 豆科作物间作燕麦对土壤固氮微生物丰度和群落结构的影响[J]. 应用生态学报, 2017, 28(3): 957-965. |
| [25] |
Liu ZD, Wang B, Xu B, et al. High throughput analysis of the endophytic bacterial community structure in roots and rhizosphere of highland barley of Tibetan Plateau[J]. Crops, 2016(6): 49-52. 刘振东, 王波, 薛蓓, 等. 高原作物青稞根及根际内生细菌群落结构的高通量分析[J]. 作物杂志, 2016(6): 49-52. |
 2018, Vol. 45
2018, Vol. 45




