扩展功能
文章信息
- 刘潮, 韩利红, 褚洪龙, 王海波, 高永, 唐利洲
- LIU Chao, HAN Li-Hong, CHU Hong-Long, WANG Hai-Bo, GAO Yong, TANG Li-Zhou
- 植物与病原菌互作的分子机制研究进展
- Research advances in molecular mechanism between plant and pathogen interaction
- 微生物学通报, 2018, 45(10): 2271-2279
- Microbiology China, 2018, 45(10): 2271-2279
- DOI: 10.13344/j.microbiol.china.170969
-
文章历史
- 收稿日期: 2017-11-20
- 接受日期: 2018-02-01
- 网络首发日期(www.cnki.net): 2018-02-13
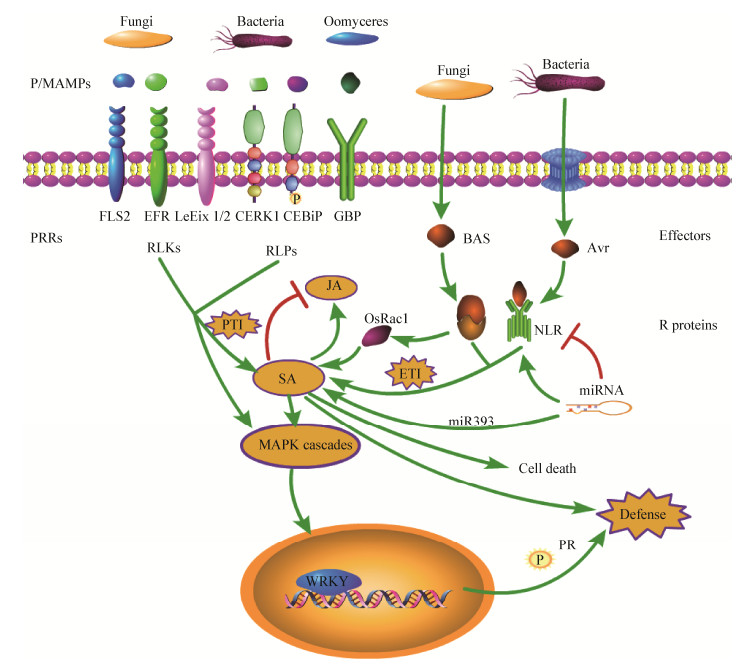
植物在整个生命周期中会经受多种微生物病原的侵袭,作物约30%的产量损失是由病原体造成的,病害是农业可持续发展面临的主要问题[1]。虽然植物缺少哺乳动物的适应性免疫系统,却能利用自身细胞的先天免疫,使整个植株产生系统获得抗性或诱导系统抗性[2]。植物对病原的感知、识别和响应是通过对非自我、损坏的自我及改变的自我分子的监视而实现的,植物通过这一机制实现了对大多数病原(或潜在病原)的抗性[3]。植物先天免疫包括两层防御系统(图 1)[4]:第一层是植物通过细胞表面的模式识别受体(Pattern recognition receptors,PRRs)对保守的病原/微生物相关分子模式(Pathogen/microbe associated molecular pattern,P/MAMP)的识别,对大多数潜在病原作出预警,并激活植物防御系统,称为病原相关分子模式引发的免疫(PAMP-triggered immunity,PTI)[3-6]。第二层的防御主要依靠抗病基因(Resistance gene,R gene)编码的多态性抗病蛋白——识别效应蛋白(Effectors)而实现,这些抗病蛋白多数是胞内富亮氨酸重复核苷酸结合(Nucleotide binding leucine- rich repeat,NB-LRR)蛋白,能直接或间接识别病原特异性效应蛋白而激发相似的防御反应,称为效应子引发的免疫(Effector-triggered immunity,ETI)[4-5],识别多为特异性,很少具有广谱抗性。在植物与病原数百万年的协同进化中,植物与病原的互作经历了多个阶段,Jones和Dangl[5]将其归纳为包含4阶段的“拉链”模型。为掌握植物与病原互作中的重要信号分子,深入了解植物免疫分子机制,本文综述了植物与病原互作中信号分子研究的最新进展,以期为植物抗病研究和作物品种改良提供借鉴。
|
| 图 1 植物与病原互作中的免疫反应 Figure 1 Immune responses on plant-pathogen interactions 注:植物通过包括RLKs或RLPs在内的PRRs识别P/MAMPs,实现PTI,通过R蛋白识别Effectors,实现ETI.随后激活SA信号通路、MAPK级联反应以及转录因子翻译等一系列的下游反应. RLK:类受体激酶;RLP:类受体蛋白;NLR:核苷酸结合富含亮氨酸重复包含蛋白;PR:病程相关蛋白. Note: The recognition of pathogens is mediated by the interaction between conserved pathogen/microbe associated molecular patterns or effectors and a limited number of pattern recognition receptors (PRRs) or resistance (R) proteins, which activate the P/MAMPs-triggered immunity and effector-triggered immunity. Then a series of downstream responses, such as the activation of the SA signaling pathway, the MAPK cascade reaction, and the translation of the transcription factors, are activated. RLK: Receptor-like kinase; RLP: Receptor-like protein; NLR: Nucleotide-binding domain leucine-rich repeat containing proteins; PR: Pathogenesis-related protein. |
|
|
基础抗性是植物的先天免疫反应,保护植物免受大多数病原的侵袭,在非寄主免疫中发挥主要作用。根据“拉链”模型,植物细胞质膜上的PRRs通过感知和识别PAMPs引发PTI (图 1),构成了植物抗病的第一道防线[5]。
1.1 PAMPsPAMPs是病原微生物表面存在的、为多数相关微生物所共有的保守分子,其结构恒定且进化保守,通常是病原体生存必需的分子结构。PAMP也可能存在于非病原的微生物中,因此也称之为MAMP[6]。PAMPs分子是跨物种的保守的信号分子,而效应蛋白却是唯一或少数物种特异性的信号分子[5],有些效应蛋白发生的范围较广,也被归为PAMPs。大部分PAMPs可分为多肽和糖类两种。多肽类PAMPs主要包括来自细菌的鞭毛蛋白、冷休克蛋白、延伸因子、超敏蛋白、Ax21、卵菌的脂转移蛋白、谷氨酰胺转氨酶等;糖类PAMPs主要包括细菌的脂多糖(Lipopolysaccharides,LPS)、肽聚糖(Peptidoglycan,PGN)和真菌的几丁质、葡聚糖、脑苷脂、木聚糖酶及卵菌的β-葡聚糖等[4]。PAMPs对微生物的适应性和生存活力有重要的作用,有些具有毒力功能[7]。如云南烟草野火病病原细菌(Pseudomonas syringae pv tabaci)鞭毛蛋白突变影响其生存活力,同时因运动性减弱导致其毒力下降[8],在其他多种病原细菌中也有类似报道。
1.2 PRRsPRRs属于细胞表面受体,可识别PAMPs,在植物抗病的第一道防线中发挥主要作用。植物已进化出大量能识别PAMPs或改变自我分子的潜在免疫受体[3]。迄今已经证实的PRRs均是受体类蛋白激酶(Receptor protein kinases,RPKs),具有高度灵敏性与专化性,根据功能域特异性(络氨酸、丝氨酸/苏氨酸或组氨酸)分为不同的类型。植物中,PRRs主要为类受体激酶(Receptor-like kinases,RLKs),分为跨膜类受体激酶和胞内类受体激酶[9]。激酶中带有精氨酸(Arg,R)和具催化活性的天冬氨酸(Asp,D)称作RD激酶,半胱氨酸和甘氨酸替代天冬氨酸的称作non-RD激酶。non-RD激酶与动植物免疫早期信号有关,而与发育有关的LRR激酶属于RD亚组[10]。RLKs构成植物最大和最多样的蛋白超家族,在植物发育、自我不亲和、感受病原和响应多种环境胁迫中发挥重要功能[9]。一类RLKs是含有胞外受体功能域和胞内激酶功能域的跨膜受体激酶,既能感知胞外信号,又参与信号转导[11];另一类是缺少胞外功能域的类受体胞内激酶(Receptor-like cytoplasmic kinases,RLCKs)[9]。不同于典型的RLKs,类受体蛋白(Receptor-like proteins,RLPs)缺少胞内活性功能域,其通过配合分子或RLCKs完成信号转导。从水稻细胞质膜分离到的CEBiP是几丁质的高亲和受体分子[12]。CEBiP是含有胞外LysM功能域的类受体蛋白,缺少胞内的激酶功能域,其功能需要与LysM受体激酶CERK1共同起作用,OsCERK1为CEBiP发挥功能所必需[13]。除CEBiP外,水稻中发现LYP4和LYP6也是含有LysM功能域的RLPs,二者既能感知细菌的PGN,也能感知真菌的几丁质信号[14]。除此之外,也发现一些非RLK/RLP蛋白,如甘氨酸葡聚糖激发子结合蛋白(Glycine max-glucan elicitor binding protein,GmGBP)和番茄乙烯诱导木聚糖酶(Lycopersicon esculentum ethylene-inducing xylanase,LeEIX2)能感知葡聚糖和木聚糖酶等,诱发植物的免疫反应[3]。
1.3 PAMP信号的识别与应答目前已鉴定了多个几丁质植物免疫受体分子[12, 14]。CEBiP敲除导致几丁质引发的免疫反应减弱,造成植株对稻瘟菌侵染敏感,说明CEBiP在几丁质信号传导中发挥必不可少的作用[12]。LysM功能域包含蛋白(LysM-containing proteins,LYPs)能结合到原核生物的PGN和植物PGN相关的几丁质或Nod因子上[15]。LYP4或LYP6的沉默转基因系特异性降低了PGN或几丁质诱导的防御反应,包括ROS产生、防御基因表达和胼胝质产生等,导致植株对白叶枯病菌和稻瘟菌抗性减弱,说明水稻中LYP4和LYP6是PGN和几丁质双重信号的PRRs,也进一步证明LYP4和LYP6与CEBiP均为水稻几丁质受体[14]。番茄叶霉病原菌(Cladosporium fulvum)能分泌一种效应蛋白Ecp6,该蛋白类似CEBiP也包含LysM功能域,能与植物几丁质受体竞争性结合几丁质,从而避免几丁质被寄主识别和随后引发的免疫反应[16]。稻瘟菌中Ecp6同源物被称作Slp1 (Secreted LysM Protein 1),包含2个LysM功能域[17],能直接与真菌细胞壁释放的几丁质寡聚物结合,从而避免水稻CEBiP对几丁质的识别。Slp1剔除导致稻瘟菌致病力丧失,水稻CEBiP沉默使得Slp1突变体恢复致病力[17],说明Slp1是毒力决定子,能够与CEBiP竞争性结合几丁质,从而抑制几丁质诱发的植物免疫反应。大豆疫霉菌(Phytophthora sojae)通过分泌木葡聚糖特异性内切葡聚糖酶(Xyloglucan-specific endoglucanase,XEG1)引发PTI,诱导细胞死亡[18]。RLKs、RLPs和胞外结合蛋白往往会以多组分复合体的形式起作用。目前鉴定的PAMP表面受体很少直接与寄主同源亚基发生作用。
在PRRs识别PAMPs分子后,植物在短时间内可作出快速的防御应答,包括丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPKs)级联反应的激活,活性氧(Reactive oxygen species,ROS)水平的升高,启动水杨酸(Salicylic acid,SA)、茉莉酸(Jasmonic acid,JA)信号传导途径,胼胝质沉积,气孔关闭和基因沉默等[19-20]。
2 ETI的发生与信号传导根据“拉链”模型,适应性病原通过分泌效应蛋白到寄主体内抑制或作用于PTI,导致效应蛋白引发的敏感(Effector-triggered susceptibility,ETS)发生。比较典型的是病原细菌通过Ⅲ型分泌系统直接将效应蛋白释放到植物细胞中。协同进化过程中,植物进化出R基因能够感知或识别效应蛋白,从而引发ETI (图 1)[5]。R基因介导的抗性通过识别病原效应蛋白诱发寄主抗性。
2.1 效应蛋白效应蛋白是病原分泌到植物细胞中能作用于植物防御系统的一类特殊蛋白。而无毒蛋白(Avr effectors)是能直接或间接被植物R蛋白所识别的一类蛋白,能引发过敏反应(Hypersensitive response,HR)。大豆疫霉菌P. sojae能分泌RXLR、PsXEG1及其同源诱饵PsXLP1等效应蛋白[21]。截至目前已定位了24个稻瘟菌无毒基因,其中12个已被克隆(PWL1、PWL2、AVR1-CO39、AVRPita、ACE1、AVR-Pia、AVRPii、AVR-Pik/km/kp、AvrPiz-t、AVRPi9、AVRPib和AVR-Pi54)[22]。
2.2 R蛋白R基因编码的R蛋白能够直接或间接特异性识别病原编码的无毒蛋白。R蛋白属于胞内受体,许多R基因编码核苷酸结合富含亮氨酸重复包含蛋白(Nucleotide-binding domain leucine-rich repeat containing proteins,NLRs),作为免疫受体起作用[1]。与PRRs相比,R蛋白在进化上出现相对较晚,在植物与病原协同进化中持续出现了大量新成员。最普遍的R蛋白包含一个能感受微生物信号的碳端LRR功能域和核苷酸结合功能域,核苷酸结合功能域的氮端包含CC (Coiled coil)或TIR (TOLL/ interleukin-1 receptor)功能域[3]。R基因与RLKs类似,在进化中表现了以串联重复形式的迅速扩张,在免疫反应中实现了快速进化[23]。目前,已报道了至少69个抗稻瘟病位点共84个主效基因,38个水稻白叶枯病抗性基因,35个水稻飞虱抗性基因(国家水稻数据库中心,http://www.ricedata.cn/index.htm)。
2.3 效应蛋白信号的识别与应答在植物与病原的协同进化过程中,适应性病原进化出多种效应蛋白攻击植物,而植物也合成了多种拮抗化合物抵御病原入侵。王源超团队报道了大豆疫霉菌的“诱饵模式”,大豆通过质外体葡聚糖酶抑制蛋白(Glucanase inhibitor protein,GmGIP1)结合到PsXEG1上,抑制其活性,大豆疫霉菌分泌的PsXEG1同源失活诱饵PsXLP1具有更强的GmGIP1结合活性,从而保证了PsXEG1的毒力作用,大豆疫霉菌同时分泌的RXLR也能干扰植物PTI过程[21]。植物通过识别病原无毒蛋白启动防御反应,AvrPib编码的无毒蛋白包含75个氨基酸,具有信号肽,对60株来自5个不同地理分布的稻瘟病菌(Magnaporthe oryzae)表型和基因型分析表明,AvrPib基因存在寄主驱动的选择效应[24]。在R蛋白识别无毒蛋白后,R蛋白被激活并启动下游信号传导,从而引发ETI。通过对抗病基因Pi9近等基因系水稻抗病性分析发现,抗病系中激酶、WRKY、MYB、ERF转录因子、茉莉酸-乙烯激素、几丁质酶、糖基水解酶、脂肪的生物合成、病程及次级代谢相关基因的转录活性更高[25]。与PTI相比,ETI过程发展较快,较持久而且更强烈,ETI是PTI的升级强化过程[5]。病原株系或小种专化性病原引发ETI,随后导致细胞程序性死亡(Programmed cell death,PCD)。选择压力下,病原丢失或改变了效应蛋白基因的组成,或获得新的效应蛋白基因,从而抑制ETI反应,随后植物又进化出新的受体,又出现ETI反应,这一协同进化过程周而复始[5, 7]。
鉴于病原和其效应蛋白的多样性,植物不可能存在足够的R基因作用于所有潜在的毒力因子。目前关于R基因介导的先天免疫机制主要有“基因对基因”遗传模型和“监视假说”两种理论。“基因对基因”遗传模型认为一种R蛋白对应一种无毒蛋白,R蛋白直接识别Avr。“监视假说”中,典型的R基因作为“监视者”监视病原的效应蛋白所引起的寄主变化,R蛋白不是直接识别,而更多的是间接被病原编码的效应蛋白所活化[26],从而能识别多个效应蛋白,这就解释了植物如何利用有限的病原受体而识别多种类型的特异性病原分子[3]。
3 免疫反应下游信号传导 3.1 丝裂原活化蛋白激酶信号丝裂原活化蛋白激酶是一组能被不同的细胞外刺激激活的丝氨酸-苏氨酸蛋白激酶,其参与的信号调节是应答响应中最重要的组成部分(图 1)。MAPK信号级联反应将胞外受体接收的信号转为胞内信号,通过磷酸化级联反应,引发一系列下游反应[24]。MAPK级联反应除了参与植物的生长和发育之外,在植物抗病过程中也发挥了重要作用。MAPKs保守的T-E-Y或T-D-Y氨基酸基序被上游MAPKKs磷酸化而被活化[27]。水稻中发现17个MAPKs[28],只有少数被鉴定,MAPK12能被Magnaporthe grisea所诱导[29],并能正调控对Xanthomonas oryzae pv. oryzae(Xoo)的抗性[30],MAPK5在M. oryzae和Xoo抗病过程中发挥了负调控的作用[30-31]。MAPK6负调控水稻对Xoo的抗性[32],BIMK1参与了Pi9和Pit介导的水稻抗病[33],这些结果表明,MAPKs调控了植物对多种病原的先天免疫反应,在水稻的PTI和ETI过程中发挥了重要作用。
3.2 转录因子转录调控是胞内调控的重要方式之一,转录由转录因子控制,因此转录因子在植物的生长、发育及胁迫响应中发挥了重要作用。植物中,多个转录因子家族的多个成员参与了植物对生物、非生物胁迫的响应,如AP2/ERF、bZIP、Zn-finger、NAC、MYB和WRKY等[34]。水稻中有超过100个WRKY转录因子[35],其中很多参与了水稻的先天免疫反应,WRKY转录因子基因与部分病程相关(Pathogenesis-related,PR)基因表达存在显著相关关系,说明这些基因之间存在较强的协同或调控关系[33]。OsWRKY28定位在细胞核,具有W-box结合活性和转录抑制活性,参与了水稻建立完全的稻瘟病抗性过程[36]。OsWRKY13能结合到SA和JA依赖的信号通路基因和自身基因启动子上,通过直接或间接调控一系列基因而活化SA通路,抑制JA通路[37]。桑树全基因组中含有55个WRKY转录因子基因,其启动子区含有多个胁迫相关转录因子(如bZIP、ERF、MYB和WRKY等)的结合序列,说明该家族基因与逆境胁迫有关,但该家族基因在桑树中的表达潜力较弱,这可能与桑树在进化过程中受到相对较小的环境胁迫压力有关[38]。
3.3 病程相关基因伴随着病原的识别和信号转导,植物下游防御反应被活化,包括细胞壁的强化、抗菌次级代谢物质积累以及PR基因的表达[39]。PR蛋白参与了植物生长发育和应对胁迫的多种生命进程。van Loon等[39]将PR蛋白归为17个家族。多个家族共同作用,限制了病原活性、生长和蔓延,如PR-2家族具有β-1, 3-内葡聚糖酶活性,PR-3、4、8和11具有内几丁质酶活性,这些酶均具有抗真菌活性。几丁质酶以及蛋白酶抑制剂(PR-6)能够抑制线虫和植食性昆虫。PR-8家族成员也具有溶解酵素活性,可能具有直接作用于细菌的活性。而防御素(PR-12)和抗菌肽(PR-13)都有广谱抗细菌和抗真菌活性。部分脂质转移蛋白(PR-14)具有抗真菌和抗细菌活性。PR-1和类甜蛋白(PR-5)均具有抗卵菌活性。水稻PR基因在植物与病原的非亲和互作早期上调表达,在亲和互作的晚期上调表达,说明PR基因在PTI和ETI中均参与了水稻的防御反应,但其作用的时间存在差异[33]。12个水稻PR-1基因在水稻与稻瘟病菌的亲和与非亲和互作中均表现为上调表达,部分基因响应了白叶枯病菌的诱导,而在拟南芥22个PR-1基因中仅有1个响应了病原的诱导,说明不同物种中PR-1家族基因在植物与病原互作中发挥作用的程度不同[40]。通过对拟南芥、水稻、绿豆、胡萝卜、桑树等PR-5家族基因的研究发现,双子叶植物基因具有较低的表达潜力,而单子叶植物基因主要受自然选择压力影响,部分聚类组基因扩张明显,对病原或环境胁迫的响应较强[33, 41-43]。
3.4 其他的信号分子研究表明,SA、JA、乙烯(Ethylene,ET)、赤霉素(Gibberellin,GA)和脱落酸(Abscisic acid,ABA)等激素在植物对病原的防御中起作用[19]。SA主要介导植物对活体营养型病原的抗病性,而JA和ET主要介导对腐生型和昆虫病原的抗病性,SA与JA信号通路之间存在交叉对话和拮抗作用(图 1)[19]。P/MAMP和效应蛋白引发的防御过程均与SA通路有关,SA通路在植物抗病中发挥重要作用[44]。SA通过诱导细胞氧化还原电位改变、JA相关转录因子的降解、JA负调控因子表达,介导核内的阻遏蛋白、DNA水平上组蛋白修饰等方式抑制JA依赖的基因活性,而一些病原通过效应蛋白干扰正常的激素交叉对话机制,为自身生存创造有利的条件[45]。ETI过程中,本来存在拮抗作用的SA和JA,均呈现了较高的积累水平,SA受体NPR3和NPR4通过促进JA转录阻遏物JAZs的降解,激活了JA的合成并诱导了JA响应基因的表达,使得植物能同时抵御活体营养型和腐生型病原体[46]。病原也会通过控制植物激素通路来抑制植物免疫反应,多数植物病原通过合成激素来控制寄主的激素合成,水稻恶苗病病原Fusarium fujikuroi合成类GA激素,通过调节激素平衡抑制寄主防御[47]。
Rac GTPase也称作Rop GTPase,参与植物发育、细胞分裂和生物及非生物胁迫[48]。OsRac1能被几丁质、鞘脂类等PAMPs所诱导,并参与水稻PTI信号过程[49-50]。OsRac1直接与NBS-LRR蛋白Pit作用,Pit通过活化OsRac1介导了对M. grisea的先天免疫[51]。OsRac1进一步活化MAPK级联反应中的MAPK6,导致PCD、ROS、植物抗毒素产生及PR基因表达等一系列反应[51]。
钙依赖的蛋白激酶(Calcium-dependent protein kinases,CDPKs)能被钙离子激活,并调控下游钙信号有关目标基因[52]。拟南芥中有34个CDPK基因,水稻中有31个[53-54]。OsCPK21过表达植株耐盐性提高,但对ABA和稻瘟菌表现更敏感[55]。CDPKs在植物对多种生物和非生物胁迫的响应中发挥作用。
MicroRNA (miRNA)是一类非编码小分子RNA,在调控真核生物基因表达过程中发挥作用。拟南芥以及茄科和豆科植物miRNAs可调控R基因表达[56-57],说明miRNAs在调控植物PTI或ETI过程中起作用。水稻中miR160a、miR398b和miR7695参与了对稻瘟病的抗病过程,过表达miR160a、miR398b或miR7695的水稻植株表现出对稻瘟病菌的抗性增强[58-59]。转录组数据表明,miRNAs参与了水稻对病原的响应[60]。大量稻瘟病菌激发子调控的miRNAs参与了小RNA转录相关通路,显示miRNAs参与了病原响应的自身调控过程[60]。miR393通过调节SA-Auxin激素平衡向SA偏移、改变次级代谢流、调节病程相关基因的胞吐作用等方式,增强了植物的抗病性[61]。然而,多数miRNAs参与抗病的具体机制还知之甚少。
4 问题与展望近期研究加深了我们对微生物与宿主免疫模式协同调节植物免疫应答的了解,但很多重要的问题仍有待解决。模式识别受体的活化及去活化调控的分子机制还不清楚;R基因的下游作用分子及其抗性介导机制还有待深入研究;病原菌效应蛋白及其模式识别受体的分离和鉴定将是植物免疫研究的重要内容;对PR蛋白在植物抵御胁迫过程中的具体功能及其调控机制的了解还远远不够;PR蛋白可受多种不同因素的诱导,这些不同因素的诱导途径之间是怎么交互的,是否通过同一个转录因子起作用等问题也有待深入研究。事实上,不同物种植物的重要抗病基因及其抗病机制具有很大的相似性,随着高通量测序技术的发展,大量物种基因组、转录组和代谢组数据被公布,多组学的综合研究为病原菌致病机理的揭示和植物抗病基因的开发与利用提供了有利条件[62]。今后在继续加强模式植物抗病基础性研究的基础上,需进一步加大农作物抗病性研究,以实现基础性研究向应用性研究的过渡。
| [1] |
Jones JDG, Vance RE, Dangl JL. Intracellular innate immune surveillance devices in plants and animals[J]. Science, 2016, 354(6316): aaf6395. DOI:10.1126/science.aaf6395 |
| [2] |
Chisholm ST, Coaker G, Day B, et al. Host-microbe interactions: shaping the evolution of the plant immune response[J]. Cell, 2006, 124(4): 803-814. DOI:10.1016/j.cell.2006.02.008 |
| [3] |
Sanabria NM, Huang JC, Dubery IA. Self/non-self perception in plants in innate immunity and defense[J]. Self/Nonself, 2010, 1(1): 40-54. DOI:10.4161/self.1.1.10442 |
| [4] |
Dai JC, Huang JG, Wang CL, et al. Pathogen conservation molecules and PAMP-triggered innate immunity in plants[J]. Microbiology China, 2012, 39(4): 553-565. (in Chinese) 戴景程, 黄建国, 王春连, 等. 病原菌保守性特征分子及其介导的植物抗病性[J]. 微生物学通报, 2012, 39(4): 553-565. |
| [5] |
Jones JDG, Dangl JL. The plant immune system[J]. Nature, 2006, 444(7117): 323-329. DOI:10.1038/nature05286 |
| [6] |
Boller T, He SY. Innate immunity in plants: an arms race between pattern recognition receptors in plants and effectors in microbial pathogens[J]. Science, 2009, 324(5928): 742-744. DOI:10.1126/science.1171647 |
| [7] |
Thomma BPHJ, Nürnberger T, Joosten MHAJ. Of PAMPs and effectors: the blurred PTI-ETI dichotomy[J]. The Plant Cell, 2011, 23(1): 4-15. DOI:10.1105/tpc.110.082602 |
| [8] |
Taguchi F, Ogawa Y, Takeuchi K, et al. A homologue of the 3-oxoacyl-(acyl carrier protein) synthase Ⅲ gene located in the glycosylation island of Pseudomonas syringae pv. tabaci regulates virulence factors via N-acyl homoserine lactone and fatty acid synthesis[J]. Journal of Bacteriology, 2006, 188(24): 8376-8384. DOI:10.1128/JB.00763-06 |
| [9] |
Shiu SH, Bleecker AB. Expansion of the receptor-like kinase/Pelle gene family and receptor-like proteins in Arabidopsis[J]. Plant Physiology, 2003, 132(2): 530-543. DOI:10.1104/pp.103.021964 |
| [10] |
Dardick C, Ronald P. Plant and animal pathogen recognition receptors signal through non-RD kinases[J]. PLoS Pathogens, 2006, 2(1): e2. DOI:10.1371/journal.ppat.0020002 |
| [11] |
Shiu SH, Bleecker AB. Receptor-like kinases from Arabidopsis form a monophyletic gene family related to animal receptor kinases[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(19): 10763-10768. DOI:10.1073/pnas.181141598 |
| [12] |
Kaku H, Nishizawa Y, Ishii-Minami N, et al. Plant cells recognize chitin fragments for defense signaling through a plasma membrane receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(29): 11086-11091. DOI:10.1073/pnas.0508882103 |
| [13] |
Shimizu T, Nakano T, Takamizawa D, et al. Two LysM receptor molecules, CEBiP and OsCERK1, cooperatively regulate chitin elicitor signaling in rice[J]. The Plant Journal, 2010, 64(2): 204-214. DOI:10.1111/tpj.2010.64.issue-2 |
| [14] |
Liu B, Li JF, Ao Y, et al. Lysin motif-containing proteins LYP4 and LYP6 play dual roles in peptidoglycan and chitin perception in rice innate immunity[J]. The Plant Cell, 2012, 24(8): 3406-3419. DOI:10.1105/tpc.112.102475 |
| [15] |
Silipo A, Erbs G, Shinya T, et al. Glyco-conjugates as elicitors or suppressors of plant innate immunity[J]. Glycobiology, 2010, 20(4): 406-419. DOI:10.1093/glycob/cwp201 |
| [16] |
de Jonge R, van Esse HP, Kombrink A, et al. Conserved fungal LysM effector Ecp6 prevents chitin-triggered immunity in plants[J]. Science, 2010, 329(5994): 953-955. DOI:10.1126/science.1190859 |
| [17] |
Mentlak TA, Kombrink A, Shinya T, et al. Effector-mediated suppression of chitin-triggered immunity by Magnaporthe oryzae is necessary for rice blast disease[J]. The Plant Cell, 2012, 24(1): 322-335. DOI:10.1105/tpc.111.092957 |
| [18] |
Ma ZC, Song TQ, Zhu L, et al. A Phytophthora sojae glycoside hydrolase 12 protein is a major virulence factor during soybean infection and is recognized as a PAMP[J]. The Plant Cell, 2015, 27(7): 2057-2072. DOI:10.1105/tpc.15.00390 |
| [19] |
Pieterse CMJ, van der Does D, Zamioudis C, et al. Hormonal modulation of plant immunity[J]. Annual Review of Cell And Developmental Biology, 2012, 28(1): 489-521. DOI:10.1146/annurev-cellbio-092910-154055 |
| [20] |
Wang B, Zhang JZ, Liu X, et al. Recent advances in the study of signal substances in plants induced by Arbuscular Mycorrhizal fungi[J]. Microbiology China, 2010, 37(2): 263-268. (in Chinese) 王彬, 张金政, 刘新, 等. 丛枝菌根真菌诱导植物信号物质研究进展[J]. 微生物学通报, 2010, 37(2): 263-268. |
| [21] |
Ma ZC, Zhu L, Song TQ, et al. A paralogous decoy protects Phytophthora sojae apoplastic effector PsXEG1 from a host inhibitor[J]. Science, 2017, 355(6326): 710-714. DOI:10.1126/science.aai7919 |
| [22] |
Wang B, Ebbole DJ, Wang Z. The arms race between Magnaporthe oryzae and rice: Diversity and interaction of Avr and R genes[J]. Journal of Integrative Agriculture, 2017, 16(12): 2746-2760. DOI:10.1016/S2095-3119(17)61746-5 |
| [23] |
Bent AF, Mackey D. Elicitors, effectors, and R genes: the new paradigm and a lifetime supply of questions[J]. Annual Review of Phytopathology, 2007, 45: 399-436. DOI:10.1146/annurev.phyto.45.062806.094427 |
| [24] |
Zhang SQ, Klessig DF. MAPK cascades in plant defense signaling[J]. Trends in Plant Science, 2001, 6(11): 520-527. DOI:10.1016/S1360-1385(01)02103-3 |
| [25] |
Jain P, Singh PK, Kapoor R, et al. Understanding host-pathogen interactions with expression profiling of NILs carrying rice-blast resistance Pi9 gene[J]. Frontiers in Plant Science, 2017, 8: 93. |
| [26] |
Dangl JL, Jones JDG. Plant pathogens and integrated defence responses to infection[J]. Nature, 2001, 411(6839): 826-833. DOI:10.1038/35081161 |
| [27] |
Sinha AK, Jaggi M, Raghuram B, et al. Mitogen-activated protein kinase signaling in plants under abiotic stress[J]. Plant Signaling & Behavior, 2011, 6(2): 196-203. |
| [28] |
Reyna NS, Yang YN. Molecular analysis of the rice MAP kinase gene family in relation to Magnaporthe grisea infection[J]. Molecular Plant-Microbe Interactions, 2006, 19(5): 530-540. DOI:10.1094/MPMI-19-0530 |
| [29] |
He CZ, Fong SHT, Yang DC, et al. BWMK1, a novel MAP kinase induced by fungal infection and mechanical wounding in rice[J]. Molecular Plant-Microbe Interactions, 1999, 12(12): 1064-1073. DOI:10.1094/MPMI.1999.12.12.1064 |
| [30] |
Seo YS, Chern M, Bartley LE, et al. Towards establishment of a rice stress response interactome[J]. PLoS Genetics, 2011, 7(4): e1002020. DOI:10.1371/journal.pgen.1002020 |
| [31] |
Xiong LZ, Yang YN. Disease resistance and abiotic stress tolerance in rice are inversely modulated by an abscisic acid–inducible mitogen-activated protein kinase[J]. The Plant Cell, 2003, 15(3): 745-759. DOI:10.1105/tpc.008714 |
| [32] |
Lieberherr D, Thao NP, Nakashima A, et al. A sphingolipid elicitor-inducible mitogen-activated protein kinase is regulated by the small GTPase OsRac1 and heterotrimeric G-protein in rice[J]. Plant Physiology, 2005, 138(3): 1644-1652. DOI:10.1104/pp.104.057414 |
| [33] |
Liu C, Wang H, Liu L, et al. Response of rice defense-related genes to blast fungus[J]. Chinese Journal of Biological Control, 2017, 33(4): 504-511. (in Chinese) 刘潮, 王慧, 刘林, 等. 水稻防御反应相关基因对稻瘟病菌的响应[J]. 中国生物防治学报, 2017, 33(4): 504-511. |
| [34] |
Ramamoorthy R, Jiang SY, Kumar N, et al. A comprehensive transcriptional profiling of the WRKY gene family in rice under various abiotic and phytohormone treatments[J]. Plant and Cell Physiology, 2008, 49(6): 865-879. DOI:10.1093/pcp/pcn061 |
| [35] |
Wu KL, Guo ZJ, Wang HH, et al. The WRKY family of transcription factors in rice and Arabidopsis and their origins[J]. DNA Research, 2005, 12(1): 9-26. DOI:10.1093/dnares/12.1.9 |
| [36] |
Chujo T, Miyamoto K, Shimogawa T, et al. OsWRKY28, a PAMP-responsive transrepressor, negatively regulates innate immune responses in rice against rice blast fungus[J]. Plant Molecular Biology, 2013, 82(1/2): 23-37. |
| [37] |
Qiu DY, Xiao J, Ding XH, et al. OsWRKY13 mediates rice disease resistance by regulating defense-related genes in salicylate- and jasmonate-dependent signaling[J]. Molecular Plant-Microbe Interactions, 2007, 20(5): 492-499. DOI:10.1094/MPMI-20-5-0492 |
| [38] |
Liu C, Han LH, Song PB, et al. Genome-wide identification and bioinformatics analysis for mulberry WRKY transcription factors[J]. Journal of Southern Agriculture, 2017, 48(9): 1691-1699. (in Chinese) 刘潮, 韩利红, 宋培兵, 等. 桑树WRKY转录因子的全基因组鉴定及生物信息学分析[J]. 南方农业学报, 2017, 48(9): 1691-1699. DOI:10.3969/j.issn.2095-1191.2017.09.25 |
| [39] |
van Loon LC, Rep M, Pieterse CMJ. Significance of inducible defense-related proteins in infected plants[J]. Annual Review of Phytopathology, 2006, 44: 135-162. DOI:10.1146/annurev.phyto.44.070505.143425 |
| [40] |
Mitsuhara I, Iwai T, Seo S, et al. Characteristic expression of twelve rice PR1 family genes in response to pathogen infection, wounding, and defense-related signal compounds (121/180)[J]. Molecular Genetics and Genomics, 2008, 279(4): 415-427. DOI:10.1007/s00438-008-0322-9 |
| [41] |
Liu C, Han LH, Wang HB, et al. Identification and bioinformatics analysis of thaumatin-like protein family in Vigna radiata[J]. Northern Horticulture, 2017, 41(20): 31-39. (in Chinese) 刘潮, 韩利红, 王海波, 等. 绿豆类甜蛋白家族鉴定与生物信息学分析[J]. 北方园艺, 2017, 41(20): 31-39. |
| [42] |
Liu C, Han LH, Wang HB, et al. Identification and bioinformatics analysis of thaumatin-like protein family in Daucus carota[J]. China Vegetables, 2017(2): 38-44. (in Chinese) 刘潮, 韩利红, 王海波, 等. 胡萝卜类甜蛋白家族鉴定与生物信息学分析[J]. 中国蔬菜, 2017(2): 38-44. |
| [43] |
Liu C, Han LH, Song PB, et al. Identification and bioinformatics analysis of thaumatin-like protein family in Morus notabilis[J]. Jiangsu Journal of Agricultural Sciences, 2017(5): 998-1006. (in Chinese) 刘潮, 韩利红, 宋培兵, 等. 桑树类甜蛋白家族鉴定与生物信息学分析[J]. 江苏农业学报, 2017(5): 998-1006. DOI:10.3969/j.issn.1000-4440.2017.05.007 |
| [44] |
Tsuda K, Sato M, Glazebrook J, et al. Interplay between MAMP-triggered and SA-mediated defense responses[J]. The Plant Journal, 2008, 53(5): 763-775. DOI:10.1111/tpj.2008.53.issue-5 |
| [45] |
Caarls L, Pieterse CMJ, Van Wees SCM. How salicylic acid takes transcriptional control over jasmonic acid signaling[J]. Frontiers in Plant Science, 2015, 6: 170. |
| [46] |
Liu LJ, Sonbol FM, Huot B, et al. Salicylic acid receptors activate jasmonic acid signalling through a non-canonical pathway to promote effector-triggered immunity[J]. Nature Communications, 2016, 7: 13099. DOI:10.1038/ncomms13099 |
| [47] |
Robert-Seilaniantz A, Navarro L, Bari R, et al. Pathological hormone imbalances[J]. Current Opinion in Plant Biology, 2007, 10(4): 372-379. DOI:10.1016/j.pbi.2007.06.003 |
| [48] |
Mucha E, Fricke I, Schaefer A, et al. Rho proteins of plants–functional cycle and regulation of cytoskeletal dynamics[J]. European Journal of Cell Biology, 2011, 90(11): 934-943. DOI:10.1016/j.ejcb.2010.11.009 |
| [49] |
Ono E, Wong HL, Kawasaki T, et al. Essential role of the small GTPase Rac in disease resistance of rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(2): 759-764. DOI:10.1073/pnas.98.2.759 |
| [50] |
Suharsono U, Fujisawa Y, Kawasaki T, et al. The heterotrimeric G protein α subunit acts upstream of the small GTPase Rac in disease resistance of rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(20): 13307-13312. DOI:10.1073/pnas.192244099 |
| [51] |
Kawano Y, Akamatsu A, Hayashi K, et al. Activation of a Rac GTPase by the NLR family disease resistance protein Pit plays a critical role in rice innate immunity[J]. Cell Host & Microbe, 2010, 7(5): 362-375. |
| [52] |
Harper JF, Harmon A. Plants, symbiosis and parasites: a calcium signalling connection[J]. Nature Reviews Molecular Cell Biology, 2005, 6(7): 555-566. DOI:10.1038/nrm1679 |
| [53] |
Cheng SH, Willmann MR, Chen HC, et al. Calcium signaling through protein kinases. The Arabidopsis calcium-dependent protein kinase gene family[J]. Plant Physiology, 2002, 129(2): 469-485. DOI:10.1104/pp.005645 |
| [54] |
Asano T, Tanaka N, Yang GX, et al. Genome-wide identification of the rice calcium-dependent protein kinase and its closely related kinase gene families: comprehensive analysis of the CDPKs gene family in rice[J]. Plant and Cell Physiology, 2005, 46(2): 356-366. DOI:10.1093/pcp/pci035 |
| [55] |
Asano T, Hakata M, Nakamura H, et al. Functional characterisation of OsCPK21, a calcium-dependent protein kinase that confers salt tolerance in rice[J]. Plant Molecular Biology, 2011, 75(1/2): 179-191. |
| [56] |
Shivaprasad PV, Chen HM, Patel K, et al. A microRNA superfamily regulates nucleotide binding site–leucine-rich repeats and other mRNAs[J]. The Plant Cell, 2012, 24(3): 859-874. DOI:10.1105/tpc.111.095380 |
| [57] |
Boccara M, Sarazin A, Thiebeauld O, et al. The Arabidopsis miR472-RDR6 silencing pathway modulates PAMP- and effector-triggered immunity through the post-transcriptional control of disease resistance genes[J]. PLoS Pathogens, 2014, 10(1): e1003883. DOI:10.1371/journal.ppat.1003883 |
| [58] |
Campo S, Peris-Peris C, Siré C, et al. Identification of a novel microRNA (miRNA) from rice that targets an alternatively spliced transcript of the Nramp6 (Natural resistance-associated macrophage protein 6) gene involved in pathogen resistance[J]. New Phytologist, 2013, 199(1): 212-227. DOI:10.1111/nph.12292 |
| [59] |
Li Y, Lu YG, Shi Y, et al. Multiple rice microRNAs are involved in immunity against the blast fungus Magnaporthe oryzae[J]. Plant Physiology, 2014, 164(2): 1077-1092. DOI:10.1104/pp.113.230052 |
| [60] |
Baldrich P, Campo S, Wu MT, et al. MicroRNA-mediated regulation of gene expression in the response of rice plants to fungal elicitors[J]. RNA Biology, 2015, 12(8): 847-863. DOI:10.1080/15476286.2015.1050577 |
| [61] |
Yang L, Huang H. Roles of small RNAs in plant disease resistance[J]. Journal of Integrative Plant Biology, 2014, 56(10): 962-970. DOI:10.1111/jipb.v56.10 |
| [62] |
Zhang J, Liu J, Qin J. Research advances and prospect for plant innate immunity[J]. Bulletin of Chinese Academy of Sciences, 2017, 32(8): 856-862. (in Chinese) 张杰, 刘俊, 秦君. 植物先天免疫研究现状与前景展望[J]. 中国科学院院刊, 2017, 32(8): 856-862. |
 2018, Vol. 45
2018, Vol. 45