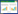扩展功能
文章信息
- 巩晓芳, 祝英, 彭轶楠, 王治业, 杨晖, 郭增祥, 周剑平
- GONG Xiao-fang, ZHU Ying, PENG Yi-Nan, WANG Zhi-Ye, YANG Hui, GUO Zeng-Xiang, ZHOU Jian-Ping
- 当归不同生长时期根际丛枝真菌分布及土壤养分和酶活性的动态变化
- Dynamics of arbuscular mycorrhizal fungi distributions, soil nutrients and enzyme activities in rhizosphere soil at different growth stages of Angelica sinensis
- 微生物学通报, 2017, 44(11): 2596-2605
- Microbiology China, 2017, 44(11): 2596-2605
- DOI: 10.13344/j.microbiol.china.170058
-
文章历史
- 收稿日期: 2017-01-20
- 接受日期: 2017-03-21
- 优先数字出版日期(www.cnki.net): 2017-03-24
2. 甘肃省微生物资源开发利用(联合)重点实验室 甘肃 兰州 730000;
3. 岷县中药材生产技术指导站 甘肃 定西 748400
2. Key Laboratory of Microbial Resources Exploitation and Utilization in Gansu Province, Lanzhou, Gansu 730000, China;
3. Minxian Chinese Herhal Medicine Station of Production and Technical Guidance, Dingxi, Gansu 748400, China
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)是一种有益的土壤微生物,广泛分布于陆地生态系统中,能与90%以上的维管植物形成互惠共生体[1-2]。AMF与植物形成共生体后,通过庞大的菌丝网络结构,改变物种之间的竞争能力,对生态系统中物质循环、生态平衡维持具有重要意义[3-5]。AMF与植物共生不仅能促进植物生长[6],增强植物对环境的适应性[7],降低发病率[8],提高药用植物有效成分含量并提高药材品质[9],还具有降低农药残留的作用[10-13]。同时AMF还分泌糖蛋白类的球囊霉素,能增加土壤有机碳库,改善土壤团聚体,对退化土壤的修复发挥一定的作用[14-16]。
当归具有治病、防病和保健等多种用途,是甘肃名贵中药材之一。甘肃岷县不断扩大当归种植面积,已成为我国当归种植示范基地。但是,当归的多年连作使得该地区土壤质量开始变差,从而导致当归发病率提高[17],当归单位产量和品质降低[18]。为了追求产量,药农过量使用化肥和农药,不仅使中药材品质逐年下降,同时进一步加剧了土壤板结和贫瘠等问题[19]。AMF作为农业生态系统中普遍存在的一类生物资源,贺学礼等[20]和姜攀等[21]分别对我国河北省安国县和福建省厦门市药用植物根围AMF侵染率和多样性开展了调查研究,发现AMF与药用植物均能形成良好的根际共生关系,并且AMF多样性受寄主特异性和土壤环境因子的影响。另外,大量研究已表明,自然界中AMF与黄芩、丹参、白术等中药材存在密切的共生关系,并能改善土壤养分的吸收代谢[22-23],在中药材种植中具有良好的应用潜力。为了充分利用AMF资源来提高药用植物的产量和品质,贺学礼等建议在黄芩种植过程中应合理使用杀真菌药剂,以减轻药剂对AMF的危害而削弱了菌根效应[24]。但是AMF与中药材当归的共生关系和应用研究目前还未见报道。
本研究通过对甘肃省岷县当归不同生长时期的根际土壤进行系统地采样,分析不同生长时期当归根际AMF孢子密度、根际土壤养分和土壤酶活性以及它们之间的相互关系,以了解当归不同生长时期AMF的时空变化及对根际土壤养分和酶活性的影响,为AMF在当归种植中的应用提供理论依据。
1 材料与方法 1.1 样品采样地点位于甘肃省岷县麻子川乡当归主要种植区。海拔高度2 500-3 000 m,年均气温5.5,7月份最热,平均气温16,年降雨量635 mm,雨水集中在7-9月,年无霜期123 d,常年平均相对湿度68%,平均日照时数2 214.9 h,适合当归的种植和生长。采样地为当归两年连作地,翻地前施肥,肥料为艳阳天复合肥450 kg/hm2,其中纯氮、P2O5和K2O含量均为18%;炒熟的菜籽225 kg/hm2;当归生长期间无需追肥。由岷县中药材生产技术指导站工作人员日常管理。
1.2 主要试剂和仪器硫酸铜、硫酸钾、硼酸、乙酸铵、抗坏血酸、邻菲罗啉,天津市大茂化学试剂厂;酒石酸锑钾、硫酸亚铁,天津市凯信化学工业有限公司;钼酸铵,天津市化学试剂四厂凯达化工厂;浓硫酸,兰州中联化学试剂有限责任公司;氢氧化钠,烟台市双双化工有限公司。
K1100型全自动凯氏定氮仪、石墨消解仪,济南海能仪器股份有限公司;A3AFG-00原子吸收分光光度计、TU-1950八联池-紫外分光光度计,北京谱析通用仪器有限责任公司;H-2050R台式高速冷冻离心机,上海沪粤明科学仪器有限公司;雷磁PHS-3C pH计,上海日岛科学仪器有限公司。
1.3 采样时间与方法分别在2015年4月15日(M1:当归栽种前取土壤样品)、2015年6月6日(M2:当归生长旺盛期根际土壤样品)、2015年7月6日(M3:当归抽薹期根际土壤样品)、2015年8月28日(M4:当归地下茎生长旺盛期根际土壤样品)和2015年10月21日(M5:当归收获期根际土壤样品) 5个时期采样。采用五点“S”采样法,M1时期用10 cm土钻分别取0-20 cm土层土壤,然后混合均匀,装入无菌自封袋中;M2、M3、M4和M5时期取样时,每次取5株当归的地下茎,采用抖动法去掉地下茎外围土壤,再将附有根际土的地下茎装入无菌自封袋中,用手轻揉使粘附的根际土壤变松散、易脱落,然后再抖动地下茎以最大量收集根际土壤,混匀后为一次土壤样品。将采集的根际土壤样品装入自封袋,放在冰袋保温盒中,带回实验室后将土壤样品分成两部分:一部分为新鲜土壤样品,保存在4中,用于土壤酶活力测定;另一部分土壤样品风干后用于测定AMF孢子密度和养分等指标。指标测定时每个样品重复3次。
1.4 分析指标与方法 1.4.1 土壤理化性质测定[25]: 土壤有机质测定采用重铬酸钾容量法测定[26]。先将土壤样品用重铬酸钾溶液和浓硫酸消煮(150,45 min),然后用硫酸亚铁溶液滴定,计算得到土壤有机质含量;全氮含量采用全自动凯氏定氮仪测定[27],先用浓硫酸和催化剂消煮土壤样品(400,100 min),消煮管自然冷却后用凯氏定氮仪测定全氮;有效钾测定采用火焰光度法测定[28],先用乙酸铵溶液振荡浸提土壤样品30 min,定性滤纸过滤,用原子吸收分光光度计测定滤液有效钾含量;有效磷测定采用紫外分光光度法[29],先用碳酸氢钠溶液振荡浸提土壤样品30 min,定量滤纸过滤,滤液用抗坏血酸溶液显色30 min后,用八联池-紫外分光光度计测定;pH值采用pH计测定,称取土壤样品10 g加入20 mL蒸馏水,摇匀静置30 min后用pH计测定。 1.4.2 土壤酶活性测定[30]: 磷酸酶活测定采用磷酸苯二钠比色法[31];脲酶测定采用苯酚钠-次氯酸钠比色法[32]。 1.4.3 球囊霉素测定[33]: 易提取球囊霉素(Easily extractable glomalin,EEG)提取方法[23]:取1 g风干土壤于试管中,加入8 mL、20 mmol/L (pH 7.0)柠檬酸钠浸提剂,在103 kPa,121连续提取30 min;10 000 r/min离心15 min,收集上清液。总球囊霉素(Total glomalin,TG)提取方法[23]:取1 g风干土壤于试管中,加入8 mL、50 mmol/L (pH 8.0)柠檬酸钠浸提剂,在103 kPa,121连续提取60 min,连续提取2次;10 000 r/min下离心15 min,收集上清液。分别吸取上清液0.5 mL加入5 mL考马斯亮蓝G-250染色剂,在595 nm波长下比色。用牛血清蛋白BSA作标准物质,绘制出标准曲线,然后求出易提取球囊霉素(EEG)和总球囊霉素(TG)含量。 1.4.4 AMF的孢子密度测定: 从每个土壤样品中称取10 g风干土壤,采用湿筛倾析-蔗糖离心法分离AMF的孢子,然后在体视显微镜下记录孢子数量[34],以每10 g风干土壤中的孢子含量计算孢子密度。 1.5 数据分析实验数据采用SPSS 22软件的单因素方差分析对测量变量进行统计分析;同时采用双变量相关性分析方法分析各变量间的相关性。采用Origin 9软件进行主成分分析和作图。
2 结果与分析 2.1 当归不同生长时期的根际土壤AMF孢子密度和球囊霉素含量如图 1所示,在当归不同生长时期,其根际土壤中AMF孢子密度显著不同(P<0.05),其中M2最低,M3、M4、M1、M5依次增高,M5最高。出现这种变化的原因:当归栽种以后,田间前一年保存下来的AMF孢子开始萌发并侵染当归根部形成共生菌丝体,因此,从M1时期到M2时期,AMF孢子数量迅速减少;M2、M3和M4是当归地上部分生长旺盛期,该时期AMF与当归形成良好的共生关系,AMF多以营养生长状态(菌丝体)的形式存在;而在M5期当归生长完成,当归地上部分衰老枯萎,此时AMF与当归共生关系减弱,AMF转向繁殖生长,形成大量的孢子,因此在当归生长后期孢子密度迅速增加。
|
| 图 1 当归不同生长时期根际土壤AMF孢子密度和球囊霉素含量的变化 Figure 1 AMF spores densities and glomalin contents in rhizosphere soil at different growth stages of Angelica sinensis 注:同一指标不同小写字母表示数据在P<0.05水平上存在显著差异. Note: Data of the same parameter with different letters are significantly different at P < 0.05. |
|
|
根际土壤易提取球囊霉素(EEG)和总球囊霉素(TG)在当归整个生长时期均表现为逐渐增加的趋势(图 1);当归同一生长时期,EEG含量均显著低于TG含量,而在M2时期(当归地上部分生长旺盛期)两者之间差异最小,从M2时期到M5时期,两者之间的含量差异增加。该结果表明由AMF菌丝分泌到根际土壤中的球囊霉素含量不断增加,根际土壤EEG含量与AMF和植物的共生关系密切相关。
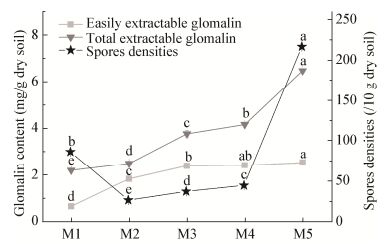
2.2 当归不同生长时期根际土壤养分含量的动态变化在当归不同生长时期,其根际土壤养分含量测定结果表明,随着当归生长时期的变化,土壤养分发生一定的变化(图 2)。从M1到M2全氮含量显著降低(P<0.05),从M2到M3全氮含量迅速增加(P<0.05),而M4和M5全氮含量没有显著差异(图 2A)。从M1到M2,根际土壤有机质含量显著增加(P<0.05);而M2、M3、M4和M5当归的四个生长时期,土壤有机质含量无显著差异(图 2B)。从M1到M3,根际土壤有效磷含量无显著变化(P>0.05);而从M3到M4,根际土壤有效磷含量显著降低(P<0.05);而从M4到M5,土壤根际有效磷含量又显著增加(图 2C)。从M1到M3,根际土壤有效钾含量显著增加(P<0.05),从M3到M4有效钾含量显著降低(P<0.05),在M4和M5有效钾含量无显著变化(图 2D)。根际土壤养分含量是由养分的吸收速率和矿化速率共同决定的,体现了根际相互作用的复杂过程。
|
| 图 2 当归不同生长时期根际土壤养分含量的变化 Figure 2 Variation of rhizosphere soil nutrients at different growth stages of Angelica sinensis 注:同一指标不同小写字母表示数据在P<0.05水平上存在显著差异. Note: Data of the same parameter with different letters are significantly different at P < 0.05. |
|
|
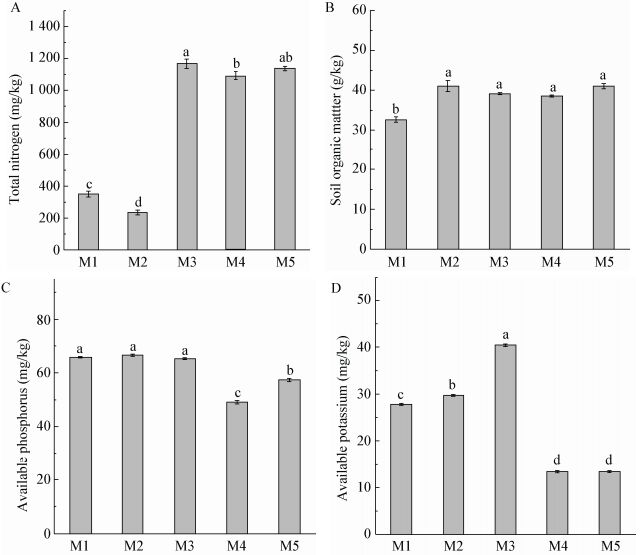
由图 3可知,随着当归生长时期的结束,根际土壤酸性磷酸酶和中性磷酸酶酶活逐渐增加(图 3A和B);而从M1到M3时期,脲酶酶活显著增加(P<0.05);从M3到M4又迅速降低;在M4和M5时期,脲酶酶活无显著差异(图 3C)。当归不同生长时期根际土壤pH值表现为波动变化(图 3D)。pH值影响酶活性和养分的代谢,而酶活性与养分的矿化代谢密切相关。
|
| 图 3 当归不同生长时期根际土壤酶活性和pH值的变化 Figure 3 Variation of rhizosphere soil enzyme activities and pH value at different growth stages of Angelica sinensis 注:同一指标不同小写字母表示数据在P<0.05水平上存在显著差异. Note: Data of the same parameter with different letters are significantly different at P < 0.05. |
|
|
为了进一步了解当归不同生长时期根际土壤AMF孢子密度与根际土壤养分和酶活性的相互关系,对根际土壤各测量变量进行相关性分析(表 1),结果表明:根际土壤全氮含量与酸性和中性磷酸酶酶活、脲酶酶活、EEG和TG呈极显著正相关,而与有效磷含量呈显著负相关;根际土壤有机质含量与EEG和TG呈极显著正相关,与酸性磷酸酶酶活呈显著正相关;根际土壤有效磷含量与有效钾含量呈极显著正相关,与酸性、中性磷酸酶酶活和pH值呈极显著负相关,与EEG和TG呈显著负相关;根际土壤有效钾含量与酸性、中性磷酸酶酶活、TG和AMF孢子密度呈显著负相关,与pH值呈极显著负相关;酸性磷酸酶与中性磷酸酶活性、EEG和TG呈极显著正相关,与AMF孢子密度呈显著正相关;中性磷酸酶酶活与pH值、EEG和TG呈极显著正相关;脲酶酶活与EEG呈极显著正相关,而EEG与TG呈极显著正相关。
| 全氮 Total N |
有机质 SOM |
有效磷 Available P |
有效钾 Available K |
酸性磷酸酶 Acid phosphatase |
中性磷酸酶 Neutral phosphatase |
脲酶 Urease |
易提取球囊霉素 EEG |
总球囊霉素 TG |
pH | 孢子密度 Spores density |
|
| 全氮 Total N |
1 | ||||||||||
| 有机质 SOM |
0.339 | 1 | |||||||||
| 有效磷 Available P |
-0.604* | -0.168 | 1 | ||||||||
| 有效钾 Available K |
-0.260 | -0.137 | 0.814** | 1 | |||||||
| 酸性磷酸酶 Acid phosphatase |
0.825** | 0.586* | -0.687** | -0.610* | 1 | ||||||
| 中性磷酸酶 Neutral phosphatase |
0.714** | 0.435 | -0.830** | -0.623* | 0.813** | 1 | |||||
| 脲酶 Urease |
0.648** | 0.514 | -0.040 | 0.353 | 0.428 | 0.372 | 1 | ||||
| 易提取球囊霉素 EEG |
0.787** | 0.789** | -0.530* | -0.259 | 0.834** | 0.738** | 0.708** | 1 | |||
| 总球囊霉素 TG |
0.777** | 0.515* | -0.568* | -0.585* | 0.966** | 0.709** | 0.390 | 0.735** | 1 | ||
| pH | 0.274 | 0.302 | -0.858** | -0.698** | 0.432 | 0.665** | -0.063 | 0.469 | 0.251 | 1 | |
| 孢子密度 Spores density |
0.327 | 0.126 | -0.223 | -0.566* | 0.621* | 0.283 | -0.101 | 0.169 | 0.000 | -0.131 | 1 |
| 注:*:在P<0.05水平上显著相关性;**:在P<0.01水平上极显著相关性. Note: *: significance at the P<0.05 level of probabilities in correlations; **: Significance at the P<0.01 level of probabilities in correlations. | |||||||||||
主成分分析结果显示(图 4),主成分1 (PC1)和主成分2 (PC2)分别占相关分量的59.77%和18.37%。M1、M2和M3是当归地上部分生长旺盛期,样本向X轴和Y轴正方向偏移;M4和M5是当归地下茎迅速生长时期,样本向X正方向偏移。该结果反映了当归不同生长时期是影响根际土壤AMF孢子密度、理化指标和酶活性的主要因素。
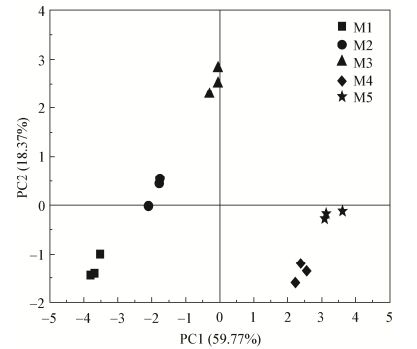
|
| 图 4 当归不同生长时期根际土壤测量变量的主成分分析 Figure 4 Principal component analysis (PCA) of rhizosphere soil measurement variables at different growth stages of Angelica sinensis |
|
|
根际土壤AMF孢子密度代表了孢子萌发和孢子形成的动态平衡。自然条件下,AMF与活体植物共生的生活史为:AMF孢子遇到合适的温度和湿度等条件开始萌发,形成菌丝有利于侵染寄主植物,若成功侵染寄主植物,生长一段时间后根外菌丝顶端可形成厚垣孢子或孢子果,完成生活史;若菌丝不能成功侵染寄主植物,菌丝将停止生长,最终死亡[35]。本研究结果显示,当归栽种时期(M1),AMF孢子密度高于当归生长旺盛期(M2、M3和M4),是因为在该时期土壤温度相对低,AMF孢子萌发较慢,或虽然萌发但侵染寄主植物较慢。进入5月份后,随着日照延长,地温开始回升,而6月至9月降雨增多,M2、M3和M4时期温暖湿润的土壤条件有利于AMF孢子的萌发;而同时当归生长旺盛,根系不断扩展,为AMF菌丝成功侵染提供更多机会,因此,该段时期AMF多以营养菌丝体的形式存在,而孢子密度相对较低(图 1)。在当归生长后期(M5),由于气温下降,当归生理成熟,植株地上部分枯萎,不再为AMF菌丝生长继续提供更多的碳水化合物等营养,从而在养分和温度的双重胁迫下AMF由营养生长转向繁殖,因此,该时期AMF孢子密度达到最高(217个/10 g,图 1)。该结果与丹参和金银花等中药植物根围AMF孢子密度研究结论一致[36-37]。
球囊霉素是AMF菌丝产生的一种含金属离子的耐热糖蛋白[15],随着AMF菌丝的衰亡、降解、最后释放到土壤中,是土壤有机质和氮素的重要来源;同时还能改善土壤团聚体结构。有资料表明,球囊霉素不仅具有重要的碳汇功能,还具有改善土壤质地和提高土壤肥力的作用[38],因此,球囊霉素含量与AMF存在的状态密切相关。本研究结果表明,EEG和TG含量均随着当归的生长而不断增加(图 1),而且EEG含量与TG含量呈显著正相关(P<0.05) (表 1),根际土壤全氮含量与EEG和TG含量也呈极显著正相关(P<0.01),根际土壤有机质含量与EEG含量呈极显著正相关(P<0.01),与TG含量呈显著正相关(P<0.05)。该结果与AMF真菌孢子萌发和孢子形成的动态平衡结果相呼应。同时,还表明AMF与当归共生可以提高根际土壤球囊霉素、全氮和有机质含量,对改善当归连作造成的土壤质量下降有较大的缓冲潜力。
土壤酶是土壤养分循环的催化剂,土壤酶活性表征了土壤养分的代谢循环速率[39]。研究表明,非连作和套作条件下脲酶与速效氮含量呈极显著正相关,而连作条件下相关性不显著[39]。根际土壤是AMF与寄主植物相互作用最直接的环境,本研究虽然是在当归连作试验田进行取样分析,但结果显示根际土壤脲酶活性与根际土壤全氮含量仍存在极显著相关性(P<0.01) (表 1),表明AMF具有改善连作条件下土壤脲酶和氮素代谢关系的功效。研究表明磷酸酶与土壤有机质、氮素和磷素的代谢密切相关[40]。本文研究结果表明,酸性磷酸酶活性与根际土壤全氮和有机质含量呈显著正相关,与根际土壤有效磷和有效钾含量显著负相关;中性磷酸酶活性与根际土壤全氮含量呈显著正相关,与根际土壤有效磷和有效钾含量呈显著负相关;同时酸性和中性磷酸酶活性与根际土壤EEG和TG含量也表现为极显著正相关(P<0.01),表明磷酸酶对土壤有机质、氮素、磷素和钾素代谢循环过程发挥重要的作用。本研究中当归根际土壤pH值在7.0左右,土壤酸碱度呈中性,其中性磷酸酶活性与根际土壤pH值表现为极显著正相关(P<0.01),虽然酸性磷酸酶与pH值相关性不显著,但是与中性磷酸酶表现为极显著正相关(P<0.01),说明酸性和中性磷酸酶活性在根际养分循环过程中具有一定的协同效应。球囊霉素与根际土壤全氮和有机质含量呈极显著正相关(P<0.01),而与根际土壤有效钾和有效磷含量呈显著负相关(P<0.05),同时与根际土壤磷酸酶和脲酶活性呈极显著正相关(P<0.01),表明AMF菌丝分泌的球囊霉素能同时调节根际土壤养分和酶活性,在一定程度上可缓解连作障碍引起的土壤养分代谢失衡问题。
连作障碍是作物种植,特别是道地中药材种植面临的突出难题。连作障碍的原因复杂多样,主要包括土壤养分代谢失衡、植物分泌自毒物质过量积累和土壤微生物菌群失衡引起的土传病害加重等[17-18],而土壤养分代谢失衡是连作障碍发生的关键因素。本研究通过对甘肃省岷县不同生长时期的当归根际土壤AMF孢子密度、土壤养分和土壤酶活性的测定,系统分析了它们之间的相关关系。研究结果表明,土壤AMF对当归根际土壤养分和酶活性均有积极的影响,在一定程度上缓解了连作障碍引起的养分代谢失衡,为AMF在当归种植上的应用提供了理论依据。
| [1] |
Cobb AB, Wilson GWT, Goad CL, et al. The role of arbuscular mycorrhizal fungi in grain production and nutrition of sorghum genotypes: enhancing sustainability through plant-microbial partnership[J]. Agriculture, Ecosystems & Environment, 2016, 233: 432-440. |
| [2] |
Zhu Y, Liu YX, Gong XF, et al. Symbiosis between three arbuscular mycorrhizal fungi and three host plants[J]. Microbiology China, 2016, 43(3): 527-533. 祝英, 刘英霞, 巩晓芳, 等. 3种丛枝菌根真菌与3种寄主植物的共生关系[J]. 微生物学通报, 2016, 43(3): 527-533. |
| [3] |
Gosling P, Hodge A, Goodlass G, et al. Arbuscular mycorrhizal fungi and organic farming[J]. Agriculture, Ecosystems & Environment, 2006, 113(1/4): 17-35. |
| [4] |
Cabral C, Ravnskov S, Tringovska I, et al. Arbuscular mycorrhizal fungi modify nutrient allocation and composition in wheat (Triticum aestivum L.) subjected to heat-stress[J]. Plant and Soil, 2016, 408(1/2): 385-399. |
| [5] |
Jasper DA, Abbott LK, Robson AD. The survival of infective hyphae of vesicular-arbuscular mycorrhizal fungi in dry soil: an interaction with sporulation[J]. New Phytologist, 1993, 124(3): 473-479. DOI:10.1111/nph.1993.124.issue-3 |
| [6] |
Taylor A, Pereira N, Thomas B, et al. Growth and nutritional responses to arbuscular mycorrhizal fungi are dependent on onion genotype and fungal species[J]. Biology and Fertility of Soils, 2015, 51(7): 801-813. DOI:10.1007/s00374-015-1027-y |
| [7] |
Zhu Y, Xiong JL, Lyu GC, et al. Effects of arbuscular mycorrhizal fungi and plant symbiosis on plant water relation and its mechanism[J]. Acta Ecologica Sinica, 2015, 35(8): 2419-2427. 祝英, 熊俊兰, 吕广超, 等. 丛枝菌根真菌与植物共生对植物水分关系的影响及机理[J]. 生态学报, 2015, 35(8): 2419-2427. |
| [8] |
Jeffries P, Gianinazzi S, Perotto S, et al. The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility[J]. Biology and Fertility of Soils, 2003, 37(1): 1-16. |
| [9] |
He XL, Liu T, Zhao LL. Effects of inoculating AM fungi on physiological characters and nutritional components of Astragalus membranaceus under different N application levels[J]. Chinese Journal of Applied Ecology, 2009, 20(9): 2118-2122. 贺学礼, 刘媞, 赵丽莉. 接种丛枝菌根对不同施氮水平下黄芪生理特性和营养成分的影响[J]. 应用生态学报, 2009, 20(9): 2118-2122. |
| [10] |
Karpouzas DG, Papadopoulou E, Ipsilantis I, et al. Effects of nicosulfuron on the abundance and diversity of arbuscular mycorrhizal fungi used as indicators of pesticide soil microbial toxicity[J]. Ecological Indicators, 2014, 39: 44-53. DOI:10.1016/j.ecolind.2013.12.004 |
| [11] |
Marin M, Ybarra M, Fe A, et al. Effect of arbuscular mycorrhizal fungi and pesticides on Cynara cardunculus growth[J]. Agricultural and Food Science in Finland, 2002, 11(3): 245-251. |
| [12] |
Wan MT, Rahe JE, Watts RG. A new technique for determining the sublethal toxicity of pesticides to the vesicular-arbuscular mycorrhizal fungus Glomus intraradices[J]. Environmental Toxicology and Chemistry, 1998, 17(7): 1421-1428. |
| [13] |
Xu XQ, Xu LJ, Yin YY, et al. Analysis of arbuscular fungi on remedying pesticide polluted soil[J]. Mycosystema, 2009, 28(4): 616-621. 许秀强, 徐丽娟, 殷元元, 等. 丛枝菌根真菌修复农药污染土壤的潜力分析[J]. 菌物学报, 2009, 28(4): 616-621. |
| [14] |
Bai CM, He XL, Tang HL, et al. Spatial distribution of arbuscular mycorrhizal fungi, glomalin and soil enzymes under the canopy of Astragalus adsurgens Pall. in the Mu Us sandland, China[J]. Soil Biology & Biochemistry, 2009, 41(5): 941-947. |
| [15] |
Wright SF, Upadhyaya A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi[J]. Plant and Soil, 1998, 198(1): 97-107. DOI:10.1023/A:1004347701584 |
| [16] |
Lee JE, Eom AH. Effect of organic farming on spore diversity of arbuscular mycorrhizal fungi and glomatlin in soil[J]. Mycobiology, 2009, 37(4): 272-276. DOI:10.4489/MYCO.2009.37.4.272 |
| [17] |
Peng YN, Zhu Y, Jiang YM, et al. The study of pathogenesis and prevention measures about Angelica sinensis root rot[J]. Modern Chinese Medicine, 2014, 16(12): 975-978. 彭轶楠, 祝英, 姜一鸣, 等. 当归根腐病发病机制及防治措施[J]. 中国现代中药, 2014, 16(12): 975-978. |
| [18] |
Wang HZ, Zhang XH, Li YD, et al. Comparison of photosynthetic characteristic and the essential oils in crop rotation and continuous cropping of Angelica sinensis[J]. Acta Prataculturae Sinica, 2011, 20(1): 69-74. 王惠珍, 张新慧, 李应东, 等. 轮作与连作当归光合特性和挥发油的比较[J]. 草业学报, 2011, 20(1): 69-74. DOI:10.11686/cyxb20110110 |
| [19] |
Massah J, Azadegan B. Effect of chemical fertilizers on soil compaction and degradation[J]. Ama, Agricultural Mechanization in Asia Africa & Latin America, 2016, 47(1): 44-50. |
| [20] |
He XL, Wang YL, Zhao LL. AM fungal genetic diversity in seven medicinal plant rhizospheres in Anguo City of Hebei Province[J]. Chinese Journal of Eco-Agriculture, 2012, 20(2): 144-150. 贺学礼, 王雅丽, 赵丽莉. 河北安国7种中药材AM真菌遗传多样性研究[J]. 中国生态农业学报, 2012, 20(2): 144-150. |
| [21] |
Jiang P, Wang MY. Colonization rate and diversity of AM fungi in the rhizosphere of seven medicinal plants in Xiamen[J]. Acta Ecologica Sinica, 2012, 32(13): 4043-4051. 姜攀, 王明元. 厦门市七种药用植物根围AM真菌的侵染率和多样性[J]. 生态学报, 2012, 32(13): 4043-4051. |
| [22] |
Lu YQ, Wang DX, Lu XL, et al. Effects of AM fungi on physiological character and nutritional component of Atractylodes macrocephala under different N levels[J]. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(2): 351-356. 卢彦琦, 王东雪, 路向丽, 等. 丛枝菌根真菌对白术生理特性和植株成分的影响[J]. 西北植物学报, 2011, 31(2): 351-356. |
| [23] |
He XL, Xu K, Guo HJ. Relationship between distribution of AM fungi in the rhizosphere of Scutellaria baicalensis and soil C and N[J]. Journal of Agricultural University of Hebei, 2011, 34(5): 63-68. 贺学礼, 许珂, 郭辉娟. 黄芩根围AM真菌分布与土壤碳氮相关性研究[J]. 河北农业大学学报, 2011, 34(5): 63-68. |
| [24] |
He XL, Wang P, Ma L, et al. Effects of three fungicides on arbuscular mycorrhizal fungal infection and growth of Scutellaria baicalensis Georgi[J]. Environmental Science, 2012, 33(3): 987-991. 贺学礼, 王平, 马丽, 等. 3种杀真菌剂对AM真菌侵染和黄芩生长的影响[J]. 环境科学, 2012, 33(3): 987-991. |
| [25] |
Lu RK. Methods for Chemical Analysis of Soil Agriculture[M]. Beijing: China Agriculture Scientech Press, 2000. 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. |
| [26] |
Wu Y, Chen J. The potassium dichromate volumetric method for the determination of soil organic matter-heating method[J]. China High Technology Enterprises, 2016(26): 11-12. 吴恙, 陈江. 重铬酸钾容量法测定土壤有机质-加热法研究[J]. 中国高新技术企业, 2016(26): 11-12. |
| [27] |
Zhang W, Fu Y, Li JF, et al. Comparative study on Kjeldahl method and Dumas Combustion method for total Nitrogen measurement in soil[J]. Chinese Agricultural Science Bulletin, 2015, 31(35): 172-175. 张薇, 付昀, 李季芳, 等. 基于凯氏定氮法与杜马斯燃烧法测定土壤全氮的比较研究[J]. 中国农学通报, 2015, 31(35): 172-175. DOI:10.11924/j.issn.1000-6850.casb15060137 |
| [28] |
Dai ZQ, Li MD. Study on determination methods. for available potassium in upland field[J]. Acta Pedologica Sinica, 1997, 34(3): 336-343. 戴自强, 李明德. 旱地土壤有效钾测定方法的研究[J]. 土壤学报, 1997, 34(3): 336-343. DOI:10.11766/trxb199508200314 |
| [29] |
Wang Q, Xu QB, Yao ZQ. Determination of available phosphorus in soil[J]. Instrumentation and Analysis Monitoring, 2009(4): 36-38, 40. 王芹, 徐清波, 姚振琴. 土壤中有效磷的测定[J]. 仪器仪表与分析监测, 2009(4): 36-38, 40. |
| [30] |
Guan SY. Soil Enzymes and Its Research Methods[M]. Beijing: China Agriculture Press, 1986. 关松荫. 土壤酶及其研究方法[M]. 北京: 中国农业出版社, 1986. |
| [31] |
Zhan HQ, Yan SS, Wang JR, et al. Effects of rice straw returning on activities of soil phosphatase and available P values in soil[J]. Crops, 2015(2): 78-83. 战厚强, 颜霜霜, 王家睿, 等. 水稻秸秆还田对土壤磷酸酶活性及速效磷含量的影响[J]. 作物杂志, 2015(2): 78-83. |
| [32] |
Jiao XG, Sui YY, Zhang XY. Study on the relationship between soil organic matter content and soil urease activity[J]. System Sciences and Comprehensive Studies in Agriculture, 2008, 24(4): 494-496. 焦晓光, 隋跃宇, 张兴义. 土壤有机质含量与土壤脲酶活性关系的研究[J]. 农业系统科学与综合研究, 2008, 24(4): 494-496. |
| [33] |
Janos DP, Garamszegi S, Beltran B. Glomalin extraction and measurement[J]. Soil Biology & Biochemistry, 2008, 40(3): 728-739. |
| [34] |
Bi YL, Wu WY. Dyeing method-a kind of the method for mycorrhizal spore density quick improved measurement[J]. Energy Environmental Protection, 2007, 21(2): 9-11. 毕银丽, 吴王燕. 染色法——一种改进的丛枝菌根孢子密度快速测定方法[J]. 能源环境保护, 2007, 21(2): 9-11. |
| [35] |
Zhong K, Wang MY, Liu RJ. Arbuscular mycorrhizal fungi: life cycle, genetic characteristics and biological fundamentls of their pure culture[J]. Mycosystema, 2009, 28(2): 310-314. 钟凯, 王淼焱, 刘润进. AM真菌生活史、遗传特性与纯培养的生物学基础[J]. 菌物学报, 2009, 28(2): 310-314. |
| [36] |
Wang LY, He XL. The resource and spatio-temproal distribution of AM fungi from Salvia miltiorrhiza in Anguo[J]. Journal of Agricultural University of Hebei, 2009, 32(6): 73-79. 王凌云, 贺学礼. 安国地区丹参根围AM真菌资源及时空分布研究[J]. 河北农业大学学报, 2009, 32(6): 73-79. |
| [37] |
Zhang XH, He XL, Wang L. AM fungal distribution and the relationship with soil carbon and nitrogen in the rhizosphere of Lonicera japonica[J]. Journal of Hebei University (Natural Science Edition), 2011, 31(5): 522-527. 张翔鹤, 贺学礼, 王雷. 金银花根围AM真菌分布与土壤碳氮关系[J]. 河北大学学报:自然科学版, 2011, 31(5): 522-527. |
| [38] |
Guo LD, Tian CJ. Progress of the function of mycorrhizal fungi in the cycle of carbon and nitrogen[J]. Microbiology China, 2013, 40(1): 158-171. 郭良栋, 田春杰. 菌根真菌的碳氮循环功能研究进展[J]. 微生物学通报, 2013, 40(1): 158-171. |
| [39] |
Zhang HL, Zheng XQ, Wang YF, et al. Effects of intercropping on soil nutrients and enzyme activities in continuous taro cropping fields[J]. Environmental Pollution & Control, 2014, 36(11): 55-59. 张翰林, 郑宪清, 王一斐, 等. 连作芋艿套作对土壤养分及酶活性的影响[J]. 环境污染与防治, 2014, 36(11): 55-59. DOI:10.3969/j.issn.1001-3865.2014.11.011 |
| [40] |
Zheng SZ, Xiao QL, Wu WD, et al. Relationship among microbial groups, enzyme activity and physico-chemical properties under different artificial forestry in hilly red soil[J]. Chinese Journal of Eco-Agriculture, 2008, 16(1): 57-61. 郑诗樟, 肖青亮, 吴蔚东, 等. 丘陵红壤不同人工林型土壤微生物类群、酶活性与土壤理化性状关系的研究[J]. 中国生态农业学报, 2008, 16(1): 57-61. |
 2017, Vol. 44
2017, Vol. 44