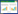扩展功能
文章信息
- 王静, 刘玉敏, 李春喜, 赵丽青, 秦燕, 张慧敏
- WANG Jing, LIU Yu-Min, LI Chun-Xi, ZHAO Li-Qing, QIN Yan, ZHANG Hui-Min
- SD-PMA-ddPCR检测食品中单核细胞增生李斯特氏菌
- Detection of Listeria monocytogenes cells in food based on SD-PMA-ddPCR
- 微生物学通报, 2016, 43(10): 2306-2313
- Microbiology China, 2016, 43(10): 2306-2313
- DOI: 10.13344/j.microbiol.china.150746
-
文章历史
- 收稿日期: 2015-10-01
- 接受日期: 2016-05-09
- 优先数字出版日期(www.cnki.net): 2016-05-24
2. 山东出入境检验检疫局 山东 青岛 266500
2. Shandong entry-exit inspection and quarantine bureau, Qingdao, Shandong 266500, China
随着社会的发展和人们对健康的关注,食品安全已经成为影响广泛而深远的社会性问题。单核细胞增生李斯特氏菌是一种常见的食源性致病菌,生命力很强,人感染后可导致脑膜炎、胃肠炎、败血症等[1-3],严重危害人们身体健康。因此,定量检测单核细胞增生李斯特氏菌引起各国的高度关注。
目前,检测单核细胞增生李斯特氏菌的方法有很多,比如实时荧光聚合酶链式反应[4]、荧光染色[5]、免疫学方法[6]等,虽然这些方法相比于传统培养法有一些优势[7, 8],但是还存在一些无法克服的缺点,诸如操作繁琐费时、灵敏度低、不能真实反映样品的污染水平、出现“假阳性”的结果[9, 10]等。因此,开发快速、准确的定量检测单核细胞增生李斯特氏菌活菌的方法是非常有必要的。本研究将基于核酸共价 交联技术从分子水平寻找细菌活的状态的标志物,建立活菌的检测方法。叠氮溴化丙锭(PMA)是一种能和DNA共价交联的荧光染料,光照可以使PMA的光敏基团转化为氮宾自由基,其可以和DNA发生共价交联,进而阻断DNA分子的PCR扩增,并且PMA只能选择性地渗透死菌的细胞膜,因此PMA被用于和PCR技术相结合定量检测活 菌[11-14]。但是有研究发现,PMA不能完全有效抑制死菌DNA的PCR扩增,可能一些受损细菌的细胞碎片阻止了PMA渗透进入细胞膜[15]。Wang等[16]利用0.1% SD处理热灭活的细菌,SD与膜蛋白作用,促进了PMA进入死菌细胞内,完全有效地抑制了死菌DNA的PCR扩增。
微滴式数字PCR系统(ddPCR)是近年来发展起来的核酸分子绝对定量检测技术,该方法在传统的PCR扩增前将含有核酸分子的反应体系进行微滴化处理,形成了成千上万个微滴,通过PCR扩增和荧光信号的积累读取阳性微滴数目,再通过泊松分布计算出样本的DNA分子数目[17-19]。本文首次将PMA与ddPCR技术相结合,以单核细胞增生李斯特氏菌为例,开发了高灵敏、高选择性的检测食源性致病菌的新方法。
1 材料与方法 1.1 菌种、试剂与仪器单核细胞增生李斯特氏菌L. monocytogenes (ATCC 19115、ATCC 54009),购自美国Microbio- Logics公司。
PMA (1 mg,美国Biotium公司):溶解于1.0 mL 20%的DMSO溶液,得到1 g/L储备液,于-20 ℃避光保存。G+细菌基因组DNA提取试剂盒,北京庄盟国际生物基因科技有限公司;脱氧胆酸钠,国药集团化学试剂有限公司;引物、探针由生工生物工程(上海)股份有限公司合成;荧光定量PCR反应体系有关试剂,罗氏公司;微滴式数字PCR反应体系有关试剂,美国伯乐公司。
QX200微滴式数字PCR系统,美国伯乐公司;7900HT Fast实时荧光定量PCR系统,美国应用生物系统公司;CF16RXII高速冷冻离心机,日本日立公司;卤钨灯(500 W),上海飞利浦灯具有限公司。
1.2 培养基胰酪胨大豆酵母浸膏琼脂(TSA-YE) (g/L):胰酪胨15.0,植物蛋白胨5.0,氯化钠5.0,酵母粉6.5,琼脂15.0,pH 7.3±0.2;营养肉汤(g/L):蛋白胨10.0,牛肉粉3.0,氯化钠5.0,葡萄糖1.0,pH 7.5±0.2;科马嘉李斯特菌显色培养基(g/L):琼脂15.0,蛋白胨23.0,酵母粉23.0,氯化钠5.0,色素8.5,增补剂9.0,pH 7.0±0.5。
1.3 实验方法1.3.1 细菌培养:用接种环沾取甘油管保存的单核细胞增生李斯特氏菌(ATCC 19115)标准菌株菌液,在胰酪胨大豆酵母浸膏琼脂(TSA-YE)平板上划线,于37 ℃培养24 h。挑取单菌落接种于营养肉汤液体培养基,37 ℃培养至对数生长期,置于1.5 mL无菌离心管中,8 000 r/min离心5 min,弃上清液备用。
1.3.2 SD协助条件下热灭活菌的制备:取108 CFU/mL菌液于1.5 mL离心管中,80 ℃水浴10 min后冷却至室温,吸取1 mL热灭活菌液涂布于3个李斯特菌显色培养基平板,37 ℃培养24 h观察,均未有菌落长出。用0.1% SD处理热灭活菌液,37 ℃温育2 h。
1.3.3 最佳PMA浓度的选取:热灭活菌制备同1.3.2,分别加入PMA终浓度为0.0、0.5、1.0、2.0、3.0、4.0、5.0、10.0 mg/L,混合体系振荡5 s后暗处孵育15 min,使PMA最大限度进入受损细胞内。将离心管置于500 W卤钨灯下20 cm处曝光15 min (管口朝上,置于冰上)。随后用试剂盒法提取基因组DNA,进行PCR检测。取108 CFU/mL单核细胞增生李斯特氏菌活菌菌液500 μL作为对照组,处理同实验组。
1.3.4 最佳曝光时间的选取:热灭活菌制备同1.3.2,加入终浓度为5.0 mg/L PMA暗处孵育 15 min,置于卤钨灯下方20 cm处,分别曝光0.0、2.0、5.0、10.0、15.0、20.0 min,随后用试剂盒法提取基因组DNA,进行PCR检测。
1.3.5 细菌DNA提取及qPCR和ddPCR检测:本实验采取试剂盒法提取细菌基因组DNA,参考SN/T 1870-2007合成引物。上游引物为(23 bp):5′-CTGAATCTCAAGCAAAACGTGGT-3′,下游引物为(18 bp):5′-CGCGACCGAAGCCAACTA-3′,探针:5′-FAMATACGATAACATCCACGGCTCTGG CTGGTAMRA-3′。
qPCR反应体系(25 μL):12.5 μL LightCycler® 480 Probes master;10 μmol/L上、下游引物各1 μL;10 μmol/L探针0.5 μL;模板DNA 2 μL;用ddH2O补至25 μL。qPCR反应条件为:95 ℃ 3 min;94 ℃ 5 s,60 ℃ 40 s (收集FAM荧光),40个循环。
ddPCR反应体系(20 μL):10.0 μL ddPCR™ Supermix for probes (No dUTP);10 μmol/L上、下游引物各1 μL;10 μmol/L探针0.5 μL;模板DNA 4 μL;用ddH2O补至20 μL。ddPCR反应条件为:95 ℃ 5 min;94 ℃ 10 s;60 ℃ 45 s,40个循环;98 ℃ 10 min。
1.3.6 qPCR、PMA-ddPCR、SD-PMA-ddPCR检测不同比例活菌的比较:108 CFU/mL的活菌和热灭活菌比例添加,分别配制活菌比例为100%、50%、25%、10%、0%的菌悬液,0.1% SD处理后在优化条件下,进行qPCR、PMA-ddPCR、SD-PMA-ddPCR检测。
1.3.7 PMA-qPCR、PMA-ddPCR检测单核细胞增生李斯特氏菌的灵敏度:将106 CFU/mL的单核细胞增生李斯特氏菌菌液10倍梯度稀释,制得浓度为106、105、104、103、102、101 CFU/mL的菌液,分别标记为L6-L1,进行PMA-qPCR、PMA-ddPCR检测。
1.3.8 人工污染样品及实际样品中单核细胞增生李斯特氏菌的检测:取25 g新鲜鸡肉样品,用均质器制成鸡肉匀浆,加入108 CFU/mL死菌,然后人工污染101-106 CFU/mL的单核细胞增生李斯特氏菌,在优化条件下进行SD-PMA-ddPCR检测。
从超市、市场共采集实际样品90份,其中肉类、乳制品、水产品各30份。分别采用食品安全国家标准[20]中传统的分离培养方法、我国出入境检验检疫行业标准[21]中规定的qPCR方法和本研究建立的SD-PMA-ddPCR对实际样品进行单核细胞增生李斯特氏菌检测。
2 结果与分析 2.1 实验原理如图 1所示,把菌液离心,重悬于生理盐水中,用SD处理受损细菌进一步破坏受损细菌的细胞膜;随后用PMA处理,PMA穿过细胞膜进入死细胞与DNA共价交联,阻止了DNA的扩增,提取细菌基因组DNA进行qPCR和ddPCR检测,实现了活菌的特异性检测。
|
| 图 1 单核细胞增生李斯特氏菌的检测原理示意图 Figure 1 The principle of L. monocytogenes detection |
|
|
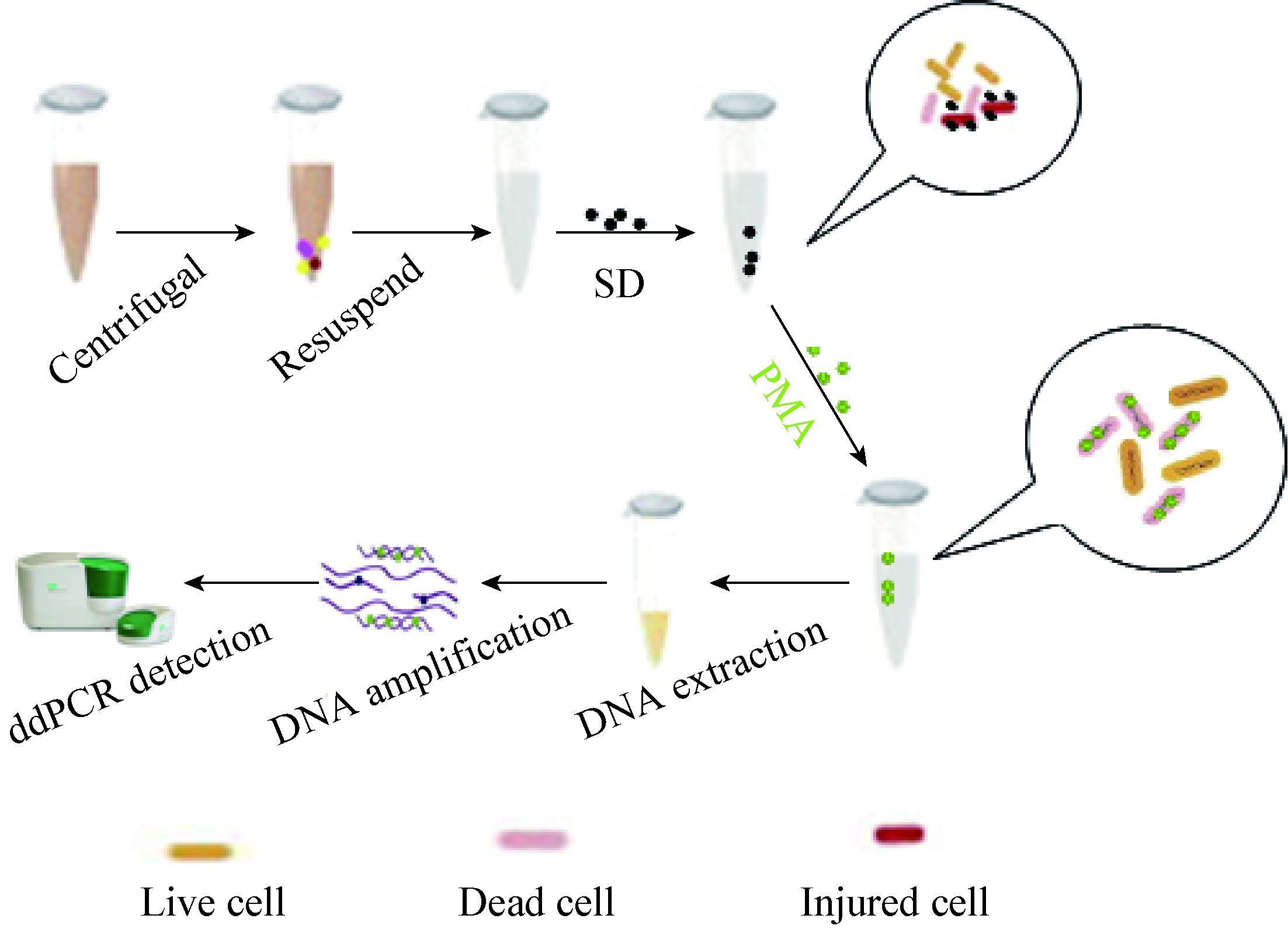
如图 2所示,热损伤细菌经过SD和PMA处理之后,其Ct值明显高于对照组,说明SD可以进一步破坏死菌的细胞膜,促进了PMA渗透进入死菌细胞膜,从而和DNA共价交联,阻止了DNA的PCR扩增。而且Wang等[15]研究发现,0.1% SD不会对活菌产生影响。
|
| 图 2 SD对PMA进入死菌细胞的影响 Figure 2 Effect of SD for PMA to enter dead cells |
|
|
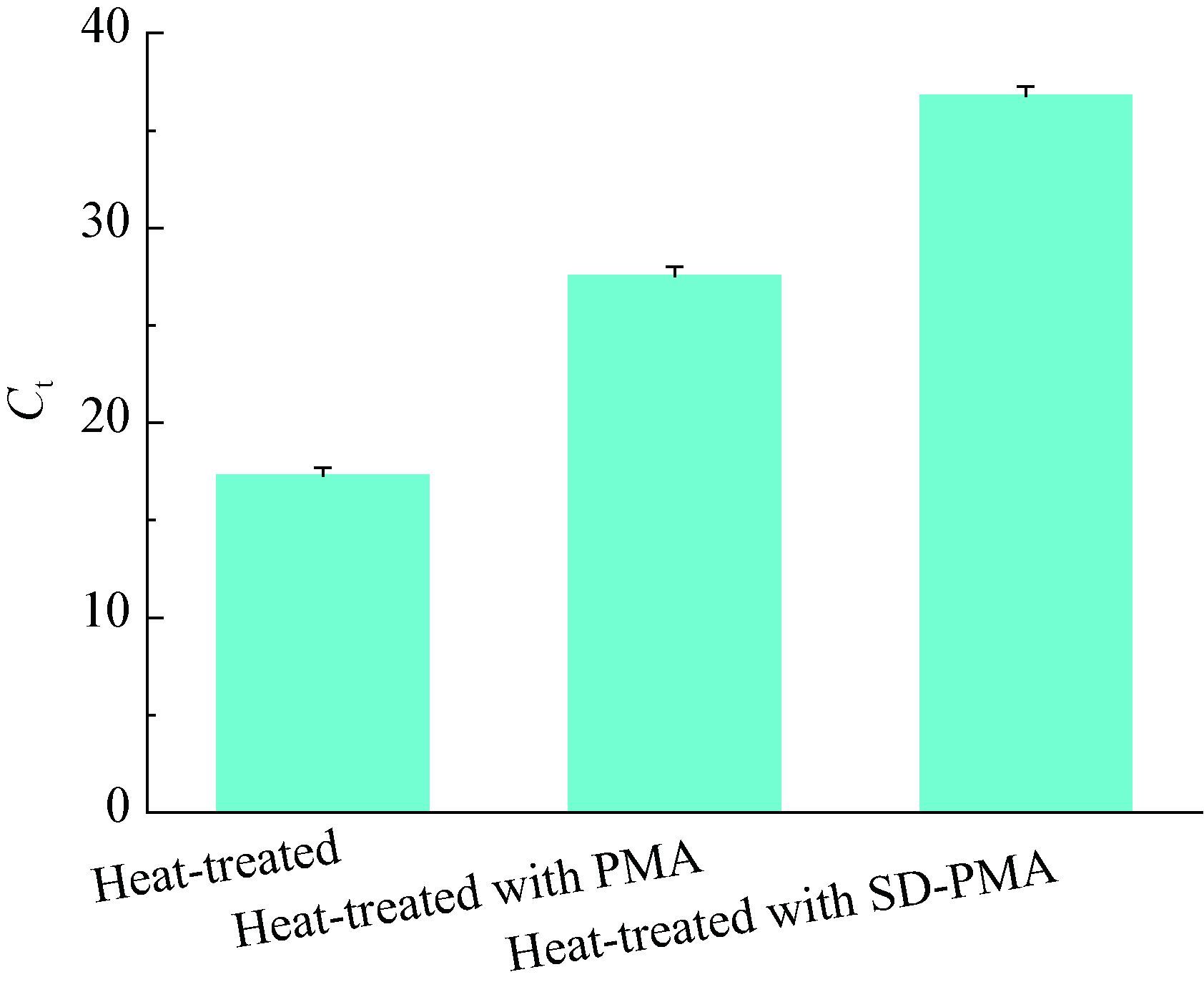
如图 3所示,随着PMA浓度的增大,死菌DNA qPCR扩增的Ct值明显升高,当PMA浓度超过 5.0 mg/L时,反应体系的Ct值几乎不再发生变化。当PMA浓度为10.0 mg/L时,活菌DNA qPCR扩增的Ct值高于不加PMA的对照组,影响了活菌DNA的qPCR扩增。本研究选用5.0 mg/L PMA作为最佳浓度。
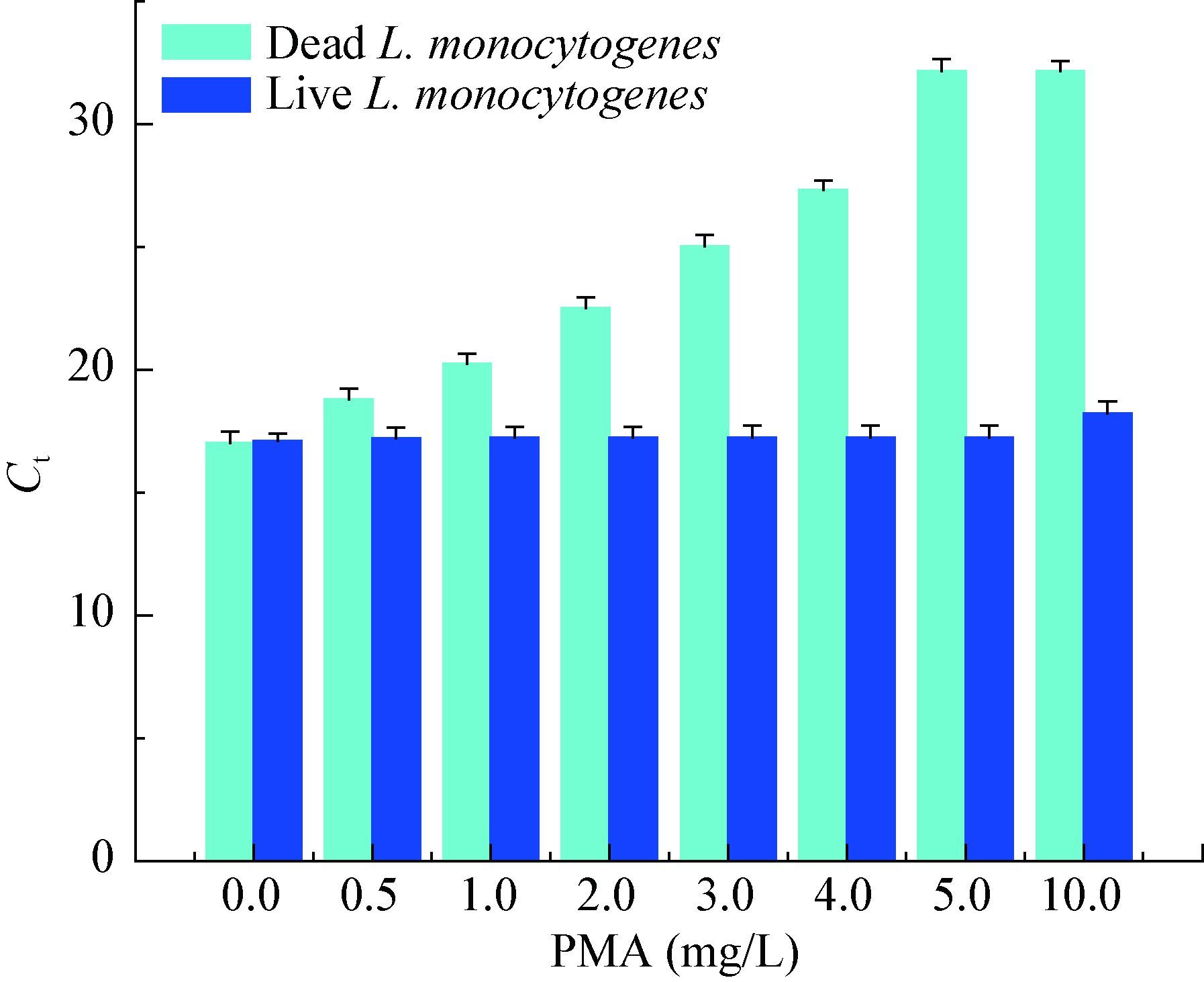
|
| 图 3 PMA浓度对死、活菌qPCR的影响 Figure 3 Effect of PMA concentration on qPCR of dead and live cells |
|
|
如图 4所示,随着光照时间的增加,体系的Ct值迅速升高,光照时间超过15.0 min后,体系的Ct值不发生明显变化,本研究选取15.0 min作为最佳光照时间。
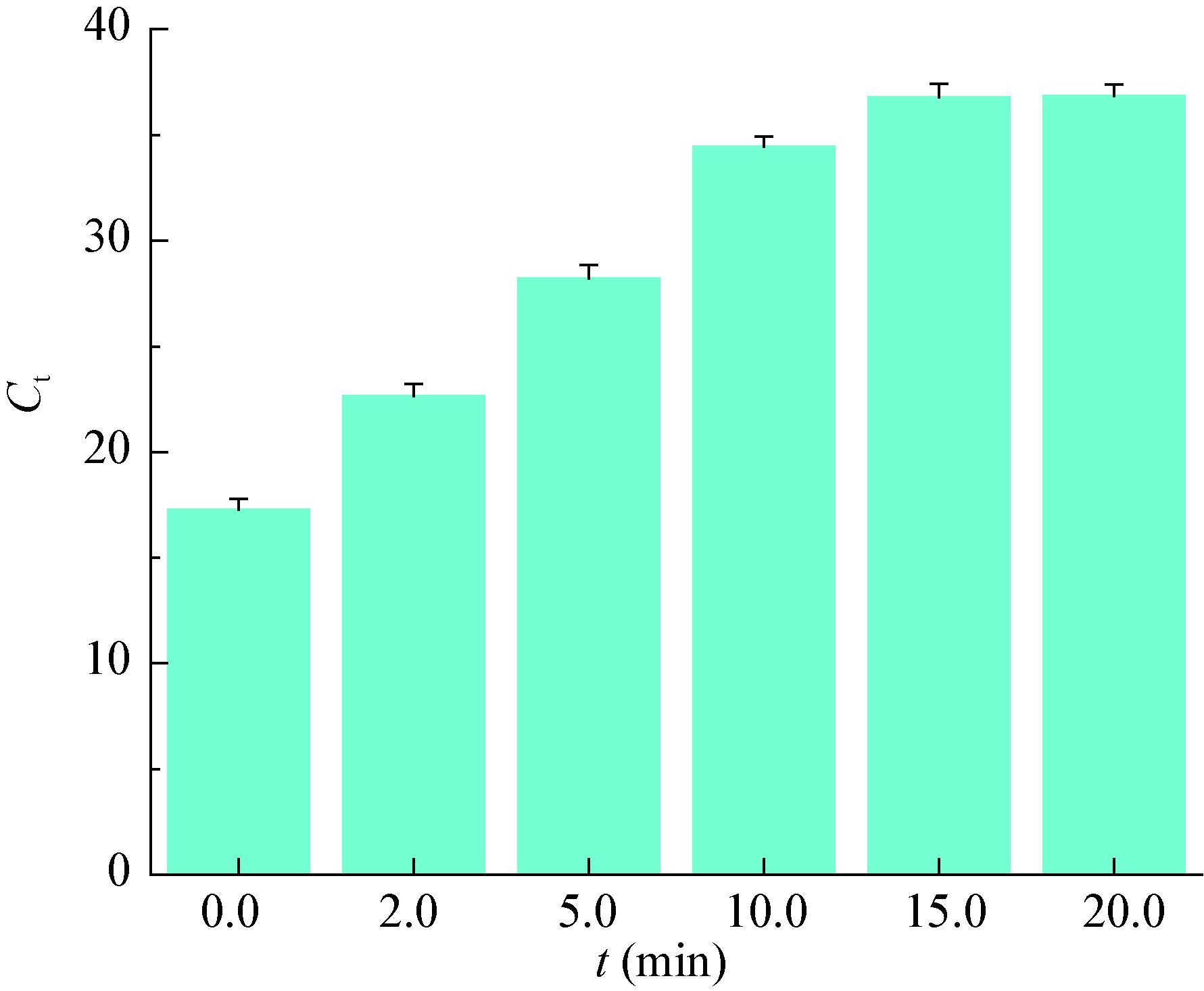
|
| 图 4 不同曝光时间对Ct值的影响 Figure 4 Effect of different light exposure time on Ct |
|
|
如图 5所示,Ct值与单核细胞增生李斯特氏菌的浓度在102-108 CFU/mL范围内呈现良好的线性关系(R=0.998 5),y=44.01-3.38x,方程中y代表DNAqPCR扩增的Ct值,x代表单核细胞增生李斯特氏菌浓度的对数值。
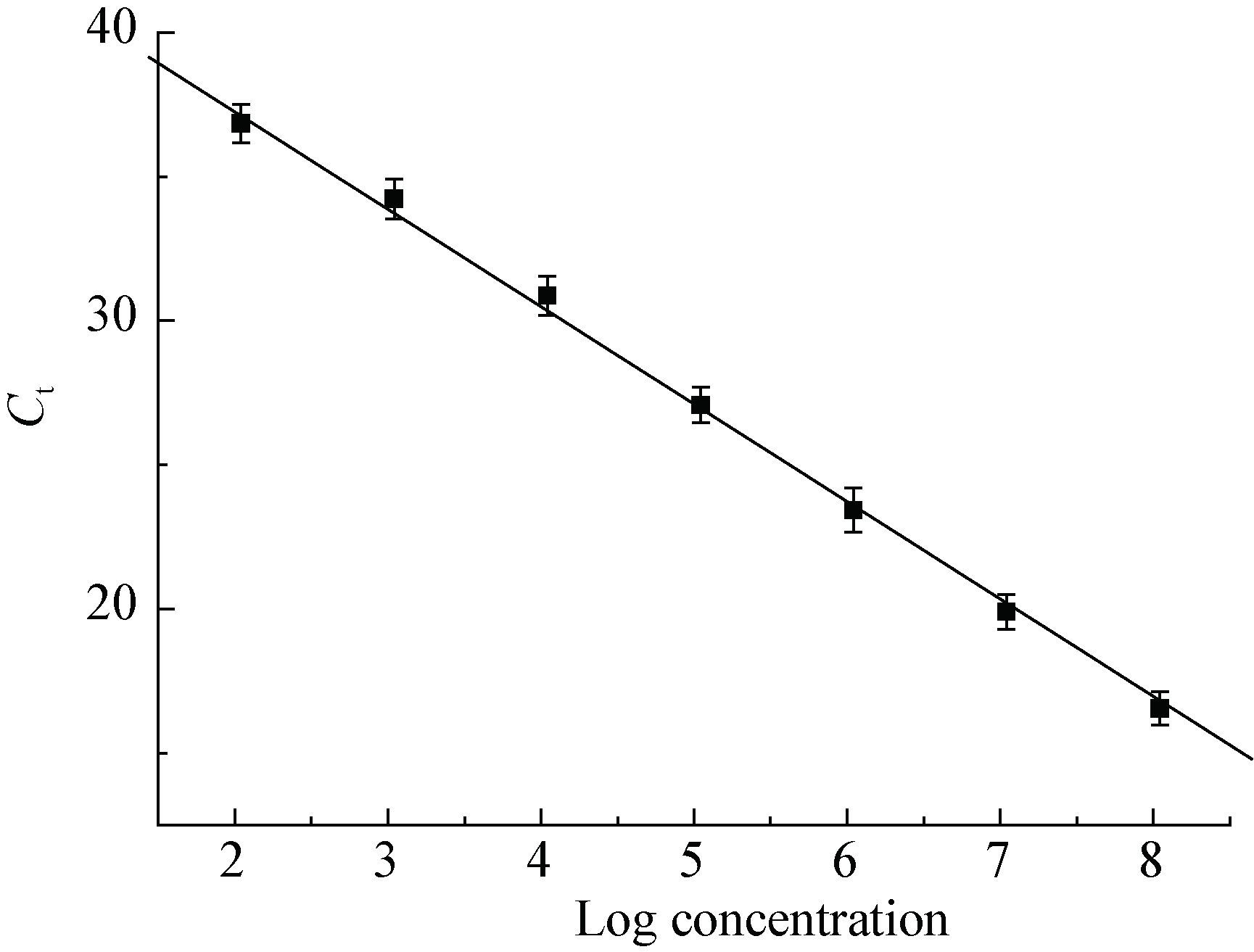
|
| 图 5 不同单核细胞增生李斯特氏菌浓度对Ct值的影响 Figure 5 Effect of different L. monocytogenes concentration on Ct |
|
|
将1.6×108 CFU/mL活菌、热灭活菌按照图 6所示比例混合后,进行qPCR、PMA-ddPCR、SD-PMA-ddPCR检测,如图 6所示,不论活菌比例如何变化,qPCR检测结果始终为死活菌的总量;当活菌比例0时,未经SD处理的菌液进行PMA-ddPCR检测,依然可以检出阳性,说明5.0 mg/L PMA单独作用下不能完全抑制108 CFU/mL死菌的DNA扩增;随着活菌比例的增加,PMA-ddPCR和SD-PMA-ddPCR检出结果也相应增加,但是SD-PMA-ddPCR检出结果与样本值更加接近。
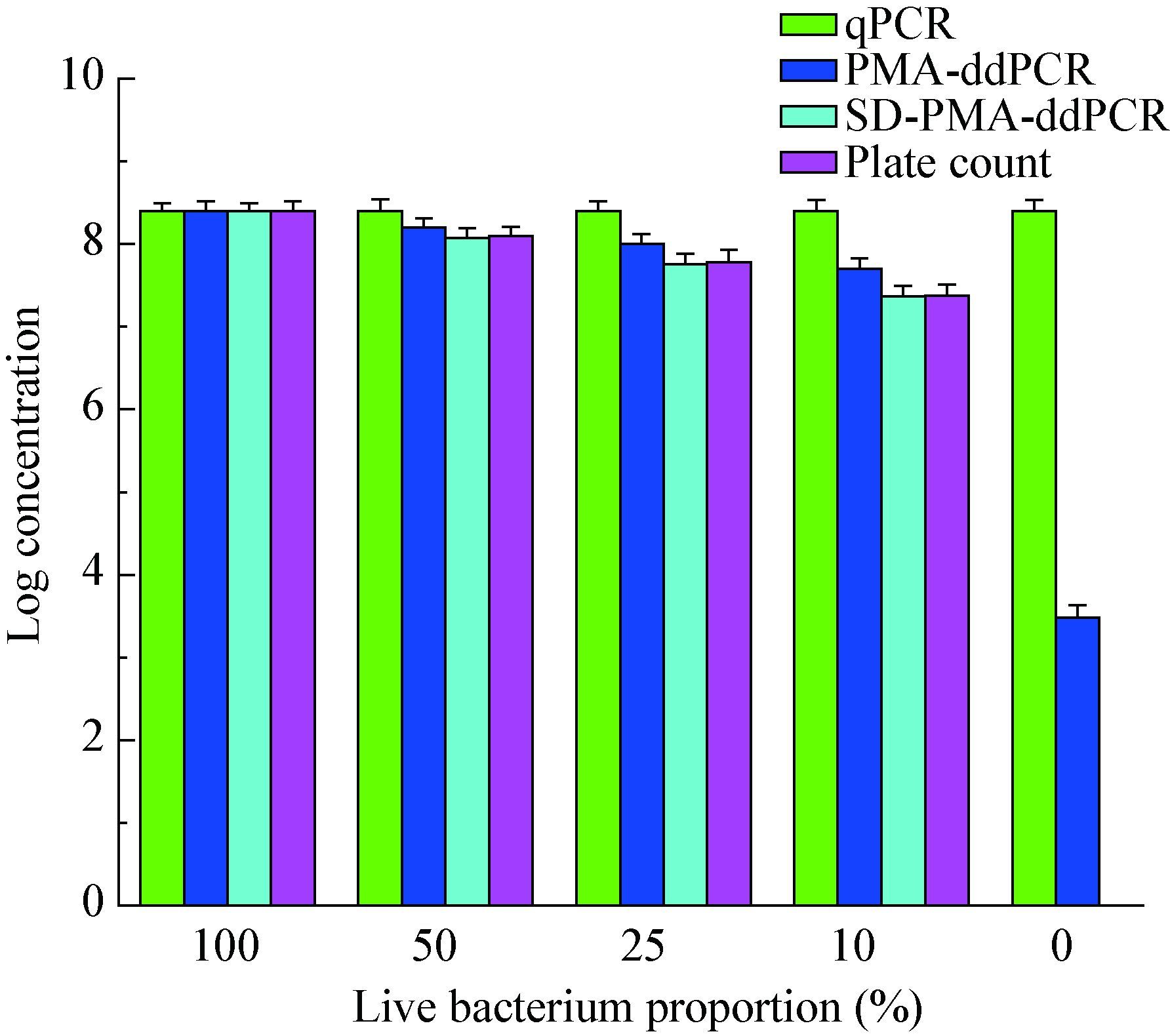
|
| 图 6 qPCR、PMA-ddPCR、SD-PMA-ddPCR对活、死菌混合液的检测 Figure 6 Detection of viable and dead cell mixtures by qPCR,PMA-ddPCR and SD-PMA-ddPCR |
|
|
将1.7×106 CFU/mL的单核细胞增生李斯特氏菌菌液10倍梯度稀释,分别标记为L6-L1,利用0.1% SD处理热灭活菌之后,进行PMA-ddPCR、PMA-qPCR检测。PMA-ddPCR所有反应生成的微滴数目均大于10 000 (图 7A),表明所有反应微滴生成正常,保证了后续定量分析的准确性。从一维散点图(图 7B)上可以看出L1至L6生成的阳性微滴数分布,阳性微滴数目随着浓度的升高而逐渐增多。此外,阴性对照(NTC)中没有检测到阳性微滴,可见该体系中没有污染或非特异性扩增,PMA-ddPCR检测单核细胞增生李斯特氏菌有良好的特异性。PMA-ddPCR灵敏度是2.0 copies/20 μL,并在2-1.99×104 copies/20 μL呈良好的线性(R=0.999 1) (图 7C)。PMA-qPCR最少可检出102 CFU/mL的单核细胞增生李斯特氏菌(图 7D),将L1-L6测得Ct代入2.5标准曲线计算浓度值作图,PMA-qPCR线性相关系数R=0.996 8。PMA-ddPCR线性优于PMA-qPCR。
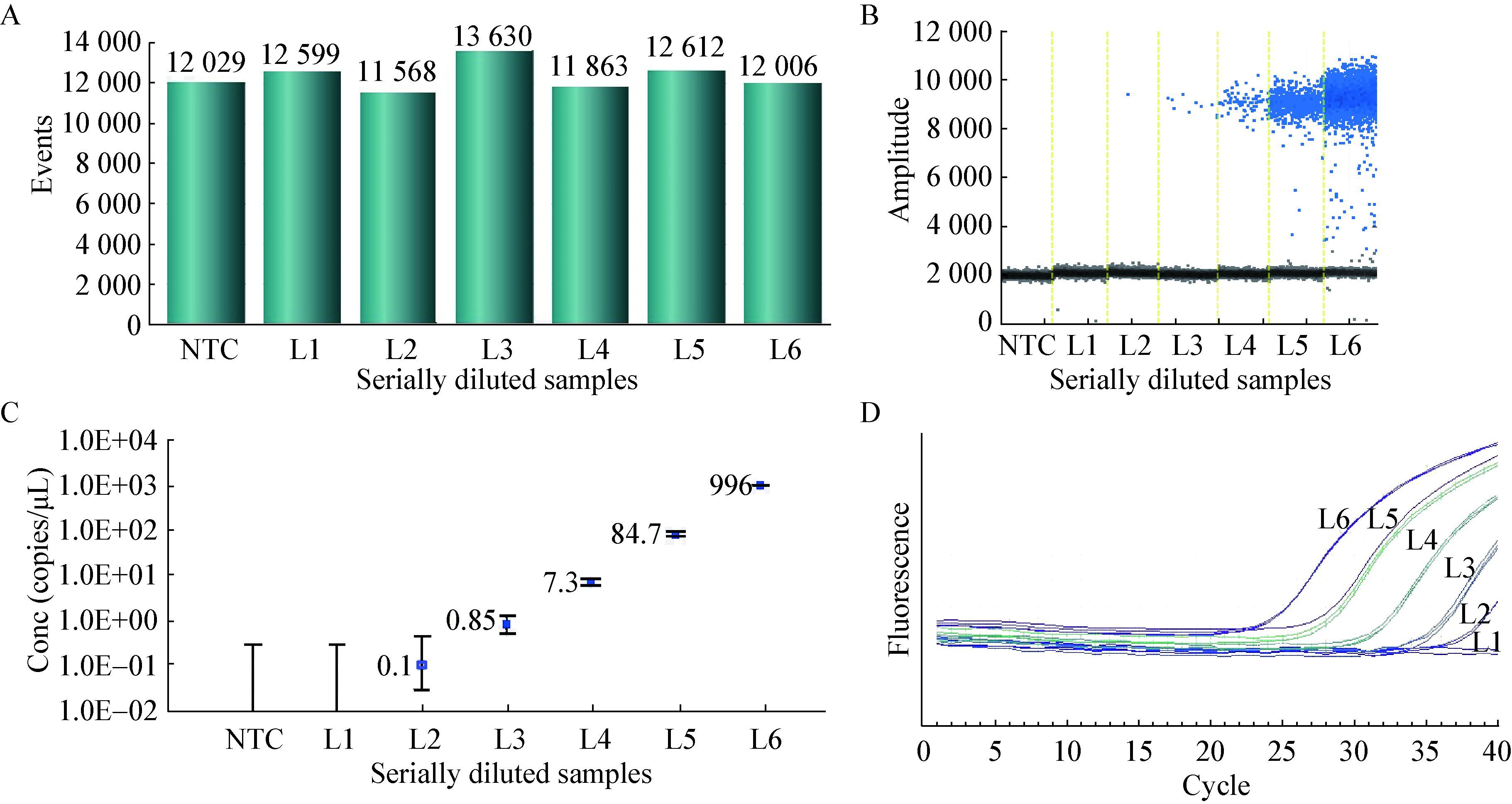
|
| 图 7 PMA-ddPCR、PMA-qPCR检测单核细胞增生李斯特氏菌的灵敏度 Figure 7 The sensitivity of L. monocytogenes detected by PMA-ddPCR and PMA-qPCR 注:A:ddPCR各样本生成的微滴数;B:ddPCR一维散点图;C:ddPCR反应体系(20 μL)中目标基因浓度;D:PMA-qPCR灵敏度. Note:A: The number of droplets generated by digital PCR; B: 1D scatterplot of ddPCR; C: Concentration of target genes in reaction system of ddPCR (20μL); D: Sensitivity of PMA-qPCR detection. |
|
|
对2种单核细胞增生李斯特氏菌菌株、不同污染程度的鸡肉样品进行SD-PMA-qPCR、SD-PMA-ddPCR检测,如表 1和表 2所示,SD-PMA-ddPCR检测人工染菌鸡肉样品,最低可检出102 CFU/mL的单核细胞增生李斯特氏菌,且与理论添加值基本吻合。当染菌量≤103 CFU/mL时,SD-PMA-qPCR测得值与理论添加值偏差较大。SD-PMA-ddPCR检测低浓度染菌样品时优于SD-PMA-qPCR。SD-PMA-ddPCR对样品检测的RSD均小于5.0%,精确度、稳定性良好。
| 理论添加量 The theory addition (CFU/mL) | 理论添加取对数 Log concentration of theory addition | SD-PMA-qPCR结果取对数 Log concentration of SD-PMA-qPCR | SD-PMA-ddPCR结果取对数 Log concentration of SD-PMA-ddPCR | RSD (%) |
| 1.7×101 | 1.23 | - | - | - |
| 1.7×102 | 2.23 | 1.09 | 2.29 | 4.19 |
| 1.7×103 | 3.23 | 2.00 | 3.15 | 3.84 |
| 1.7×104 | 4.23 | 4.08 | 4.17 | 3.61 |
| 1.7×105 | 5.23 | 5.11 | 5.14 | 3.47 |
| 1.7×106 | 6.23 | 6.56 | 6.17 | 3.22 |
| 理论添加量 The theory addition (CFU/mL) | 理论添加取对数 Log concentration of theory addition | SD-PMA-qPCR结果取对数 Log concentration of SD-PMA-qPCR | SD-PMA-ddPCR结果取对数 Log concentration of SD-PMA-ddPCR | RSD (%) |
| 2.2×101 | 1.34 | - | - | - |
| 2.2×102 | 2.34 | 1.13 | 2.31 | 4.02 |
| 2.2×103 | 3.34 | 2.10 | 3.28 | 3.88 |
| 2.2×104 | 4.34 | 4.13 | 4.32 | 3.57 |
| 2.2×105 | 5.34 | 5.23 | 5.27 | 3.42 |
| 2.2×106 | 6.34 | 6.63 | 6.30 | 3.20 |
从超市、市场共采集的实际样品检测结果如表 3所示,有4份样品为单核细胞增生李斯特氏菌阳性,3种方法检测结果一致。传统的分离培养方法对实际样品只能做到定性检测;qPCR检测结果检测的为单核细胞增生李斯特氏菌死菌、活菌的总量,极易造成定量检测结果偏高;SD和pMA可以有效抑制死菌DNA的PCR扩增,SD-PMA-ddPCR检测降低了“假阳性”出现的可能性。结合人工污染样品数据分析,SD-PMA-ddPCR与样品实际污染水平更加接近。
| 阳性样品 Positive samples | 传统分离培养法 The traditional separation culture method | qPCR结果取对数 Log concentration of qPCR | SD-PMA-ddPCR结果取对数 Log concentration of SD-PMA-ddPCR | RSD (%) |
| 1 | Positive | 6.86 | 3.22 | 3.82 |
| 2 | Positive | 6.13 | 3.00 | 4.01 |
| 3 | Positive | 5.35 | 2.06 | 3.14 |
| 4 | Positive | 4.18 | 2.01 | 3.51 |
PMA与ddPCR相结合的方法,可以在死菌存在的条件下定量检测单核细胞增生李斯特氏菌活菌,消除了“假阳性”结果的出现,SD对样品预处理,使得PMA更容易穿过死菌细胞膜。SD-PMA-ddPCR方法简便快速,成功检测鸡肉等样品中单核细胞增生李斯特氏菌的含量。与SD-PMA-qPCR方法相比,具有灵敏度高、精密度高、检测低浓度染菌样品更精确等优点,Wang等[15]应用SD-PMA-mPCR方法在107 CFU/mL热灭活单核细胞增生李斯特氏菌存在的条件下,定量检测牛肉等样品中的单核细胞增生李斯特氏菌。本方法把曝光时间增加了3倍,应用SD-PMA-ddPCR在108 CFU/mL热灭活单核细胞增生李斯特氏菌存在的条件下,定量检测鸡肉样品中的单核细胞增生李斯特氏菌活菌,说明曝光时间延长可以促进PMA与DNA共价交联。SD-PMA-ddPCR方法具有巨大的发展空间,有望应用于其他样品的检测。
| [1] | Li JH, Guo HQ, Gao XQ, et al. Immunomagnetic capture PCR for rapid detection of Listeria monocytogenes[J]. Food Science , 2015, 36 (12) : 226–229. (in chinese) 李婧姮, 郭慧琴, 高晓强, 等. 免疫磁珠捕获PCR快速检测单核细胞增生李斯特氏菌[J]. 食品科学 , 2015, 36 (12) : 226–229. |
| [2] | Liu SH, Wei YB, Lin XJ, et al. Research advances on determination methods of single cells hyperplasia of Listeria[J]. Modern Agricultural Science and Technology , 2010 (19) : 327–328. (in chinese) 刘书花, 魏云波, 林小静, 等. 食品中单核细胞增生李斯特氏菌的检测方法研究进展[J]. 现代农业科技 , 2010 (19) : 327–328. |
| [3] | Zhang JL, Yang LX. Single increase of Listeria food-borne pollution condition and testing methods[J]. The Journal of Medical Theory and Practice , 2012, 25 (8) : 910–911. (in chinese) 张加林, 杨林娴. 单增李斯特菌的食源性污染状况及检测方法[J]. 医学理论与实践 , 2012, 25 (8) : 910–911. |
| [4] | Master CI, Shallcross JA, Mackey BM. Effect of stress treatments on the detection of Listeria monocytogenes and enterotoxigenic Escherichia coli by the polymerase chain reaction[J]. Journal of Applied Bacteriology , 1994, 77 (1) : 73–79. DOI:10.1111/jam.1994.77.issue-1 |
| [5] | Ding JY, Han JZ. The occurrence of Listeria monocytogenes in food and its determination method progress[J]. Food Research and Development , 2008, 29 (12) : 171–174. (in chinese) 丁建英, 韩剑众. 食品中单增李斯特菌的存在现状及检测方法研究进展[J]. 食品研究与开发 , 2008, 29 (12) : 171–174. |
| [6] | Lin T, Liu ZZ, Yang XJ, et al. Research on VIDAS-GB assay to determine Listeria monocytogenes in aquatic products[J]. Chinese Journal of Health Laboratory Technology , 2008, 18 (4) : 655–656. (in chinese) 林涛, 刘真真, 杨雪娇, 等. 全自动荧光酶免疫分析仪-国标法检测水产品中单核细胞增生李斯特氏菌的研究[J]. 中国卫生检验杂志 , 2008, 18 (4) : 655–656. |
| [7] | Aricind A, Bhagwat AA. Simultaneous detection of Escherichia coli O157:H7, Listeria monocytogenes and Salmonella strains by real-time PCR[J]. International Journal of Food Microbiology , 2003, 84 (2) : 217–224. DOI:10.1016/S0168-1605(02)00481-6 |
| [8] | Malorny B, Bunge C, Helmuth R. A real-time PCR for the detection of Salmonella enteritidis in poultry meat and consumption eggs[J]. Journal of Microbiological Methods , 2007, 70 (2) : 245–251. DOI:10.1016/j.mimet.2007.04.013 |
| [9] | SEO KH, Valentin-Bon IE, Brackett RE. Detection and enumeration of Salmonella enteritidis in homemade ice cream associated with outbreak: comparison of conventional and real-time PCR methods[J]. Journal of Food Protection , 2006, 69 (3) : 639–643. |
| [10] | Whyte P, Gill KM, Collins JD, et al. The prevalence and PCR detection of Salmonella contamination in raw poultry[J]. Veterinary Microbiology , 2002, 89 (1) : 53–60. DOI:10.1016/S0378-1135(02)00160-8 |
| [11] | Nocker A, Sossa-Fernandez P, Burr MD, et al. Use of propidium monoazide for live/dead distinction in microbial ecology[J]. Applied and Environmental Microbiology , 2007, 73 (16) : 5111–5117. DOI:10.1128/AEM.02987-06 |
| [12] | Cawthorn DM, Witthuhn RC. Selective PCR detection of viable Enterobacter sakazakii cells utilizing propidium monoazide or ethidium bromide monoazide[J]. Journal of Applied Microbiology , 2008, 105 (4) : 1178–1185. DOI:10.1111/jam.2008.105.issue-4 |
| [13] | Nocker A, Cheung CY, Camper AK. Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs. dead bacteria by selective removal of DNA from dead cells[J]. Journal of Microbiological Methods , 2006, 67 (2) : 310–320. DOI:10.1016/j.mimet.2006.04.015 |
| [14] | Forghani F, Langaee T, Eskandari M, et al. Rapid detection of viable Bacillus cereus emetic and enterotoxic strains in food by coupling propidium monoazide and multiplex PCR (PMA-mPCR)[J]. Food Control , 2015, 55 : 151–157. DOI:10.1016/j.foodcont.2015.02.049 |
| [15] | Wang LJ, Ye CL, Xu HY, et al. Development of an SD-PMA-mPCR assay with internal amplification control for rapid and sensitive detection of viable Salmonella spp., Shigella spp. and Staphylococcus aureus in food products[J]. Food Control , 215, 57 : 314–320. |
| [16] | Wang LJ, Li P, Zhang ZH, et al. Rapid and accurate detection of viable Escherichia coli O157: H7 in milk using a combined IMS, sodium deoxycholate, PMA and real-time quantitative PCR process[J]. Food Control , 2014, 36 (1) : 119–125. DOI:10.1016/j.foodcont.2013.08.011 |
| [17] | Morisset D, Štebih D, Milavec M, et al. Quantitative analysis of food and feed samples with droplet digital PCR[J]. PLoS One , 2013, 8 (5) : 62583–62588. DOI:10.1371/journal.pone.0062583 |
| [18] | George D, Czech J, John B, et al. Detection and quantification of chimerism by droplet digital PCR[J]. Chimerism , 2013, 4 (3) : 102–108. DOI:10.4161/chim.25400 |
| [19] | Beck J, Bierau S, Balzer S, et al. Digital droplet PCR for rapid quantification of donor DNA in the circulation of transplant recipients as a potential universal biomarker of graft injury[J]. Clinical Chemistry , 2013, 59 (12) : 1732–1741. DOI:10.1373/clinchem.2013.210328 |
| [20] | GB 4789.30-2010, National food safety standard: Food microbiological examination: Listeria monocytogenes[S]. Beijing: China Standard Publishing House, 2010(in Chinese). GB 4789.30-2010, 食品安全国家标准: 食品微生物学检验: 单核细胞增生李斯特氏菌检验[S]. 北京: 中国标准出版社, 2010 |
| [21] | SN/T 1870-2007, Detection of pathogens in food-Real-time PCR Method[S]. Beijing: China Standard Publishing House, 2007(in Chinese). SN/T 1870-2007, 食品中致病菌检测方法-实时PCR法[S]. 北京: 中国标准出版社, 2007 |
 2016, Vol. 43
2016, Vol. 43