扩展功能
文章信息
- 许美容, 贾奥琳, 陶阳, 邓晓玲
- XU Mei-Rong, JIA Ao-Lin, TAO Yang, DENG Xiao-Ling
- 难培养菌的多条带PCR 产物产生原因分析
- Analysis on causes of polymorphic PCR bands in nonculturable endophytes amplification
- 微生物学通报, 2015, 42(4): 783-790
- Microbiology China, 2015, 42(4): 783-790
- 10.13344/j.microbiol.china.140571
-
文章历史
- 收稿日期: 2014-07-25
- 接受日期: 2014-11-06
- 优先数字出版日期(www.cnki.net): 2014-11-20
柑橘黄龙病是由限制于韧皮部的革兰氏阴性杆菌(“Candidatus Liberibacter spp.”,“Ca. L. spp.”)引起的[1]。黄龙病病原菌培养的研究鲜有报道[2, 3, 4, 5]且无法被后人重复。由于病原难以人工培养,无法利用纯的病原核酸进行分子水平的研究。因此,目前对该菌的分子生物学研究应提取含有“Ca. L. spp.”的寄主核酸或蛋白为模板,其成分较为复杂。
早期“Ca. L. spp.”流行学研究主要分析16S rRNA基因、16S/23S间隔区、外膜蛋白(Outer membrane protein,omp)、β-操纵子和trmU-tufB- secE-nusG-rplKAJL-rpoB等相对较保守的基因或基因簇的相似率。“Ca. L. asiaticus”的Psy62株系全基因组序列(CP001677)公布后,其中的短串联重复序列(Short tandem repeats,STR)很快被用于不同来源的菌株多态性分析[6, 7, 8, 9, 10]。2013年,Matos等[10]对之前报道过的4个STR进行研究后指出,黄龙病存在时间越长的地区,其病原的变异性越大。与“Ca. L. asiaticus”相关的原噬菌体SC1 (HQ377372)、SC2 (HQ377373)、FP2 (JF773396)中的高变异基因也被广泛地用来分析不同国家或地区来源“Ca. L. asiaticus”菌株的多样性[11, 12, 13, 14, 15]。以上研究均能获得序列上差异的单条带产物或大小不同的多条带产物。
随着基因组序列的完善和生物信息学的发展,一些基于PCR的多态性好、高效、可靠、易于操作的分型方法被广泛地应用于微生物遗传多样性分析:如随机扩增多态性DNA (RAPD),扩增片段长度多态性(AFLP),具体的和随机扩增(SARA),简单串联重复(SSR),序列标记位点(STS)等。以上方法多用于分析单一物种来源的核酸样品。从难培养菌提取的核酸通常混在其寄主组织或细胞的核酸中。本研究通过分析难培养菌“Ca. L. asiaticus”的2个STR基因序列,探讨复杂背景生物DNA为模板的PCR多态性条带产生的原因,为该类生物材料分子生物学实验设计提供参考。
1 材料与方法 1.1 样品的采集及DNA提取从云南和广东省感染黄龙病的果园中分别采集144个和176个柑橘叶片样品。分别剪取0.1 g叶中脉,用试剂盒(OMEGA,D2485-02)提取基因组总DNA。用10 g/L的琼脂糖凝胶检测DNA的质量。经柑橘黄龙病病原细菌“Ca. L. asiaticus”的特异性引物UP2/DP2[16]鉴定,筛选出64个具有较高“Ca. L. asiaticus”浓度的柠檬、香橼或砂糖橘DNA样品为模板(表 1),扩增2个“Ca. L. asiaticus”基因(CLIBASIA_01645和CLIBASIA_04555)。同样,根据实验结果,再次筛选“Ca. L. asiaticus”阳性和阴性的砂糖橘、马水橘和长春花样品(表 1),用于这2个基因多态性条带的来源分析。以上PCR均以实验室保存的含“Ca. L. asiaticus”基因组的黄龙病柑橘DNA样品为阳性对照,以不含“Ca. L. asiaticus”基因组的健康柑橘DNA样品为阴性对照。
| 项目 Item | 用于扩增CLIBASIA_01645和CLIBASIA_04555基因的样品 Samples used to amplify CLIBASIA_01645 and CLIBASIA_04555 genes | 用于扩增“未知基因”的样品 Samples used to amplify
‘unknown genes’ |
|||||
| 省份 Province | 云南 | 广东 | 广东 | ||||
| 采集地点 Location | 瑞丽 | 建水 | 德庆 | 清远 | 德庆 | 德庆 | 广州 |
| 寄主 Host | 柠檬 | 香橼 | 砂糖橘 | 砂糖橘 | 砂糖橘 | 马水橘 | 长春花 |
| 阳性样品数量 Number of positive samples | 14 | 18 | 22 | 10 | 8 | 8 | 5 |
| 阴性样品数量 Number of negative samples | 0 | 0 | 0 | 0 | 8 | 8 | 5 |
Note: ‘Unknown genes’ are the amplicons of CLIBASIA_01645 and CLIBASIA_04555 genes with no hits in GenBank.
首先从33对“Ca. L. asiaticus”的不同候选STR位点的引物[16]中选择扩增产物条带清晰且多态性良好的引物STR13F/R和STR32F/R[16],用于扩增2个“Ca. L. asiaticus”基因(CLIBASIA_01645和CLIBASIA_04555);然后根据引物STR13F/R、STR32F/R的扩增产物中未能在GenBank中找到同源序列(命名为“未知序列”),用Primer Premier 5软件设计引物(表 2),以分析这些未知序列的来源。引物在上海英潍捷基贸易有限公司(Invitrogen Biotechnology Co.,Ltd)合成,并根据说明书稀释至10 µmol/L后保存于−20 °C备用,引物储存液稀释10倍后用于PCR。
| 引物编号Primer code | 基因编号 Gene code | 正向引物 Forward primer (5′→3′) | 反向引物 Reverse primer (5′→3′) |
| STR13F/R | CLIBASIA_01645 | GTAGGAGTCCCCGAAAT | GCCTGTACGAGGTTTGA |
| STR32F/R | CLIBASIA_04555 | TGATAACAAGCACCTCT | CTAATCTGAACCCAAAC |
| STR13-22F/R | UN1 | ACCGTTTGTTCTGAG | ACTTTTGCTTTTTCT |
| STR13-31F/R | UN2 | TTTGACTTGGGGTAA | TTCTATTGGTTGCTT |
| STR32-12F/R | UN3 | AAGTACCCAGCAACC | TCATCCCCCTATCAT |
| UP2/DP2 | 16S rRNA | ATGTTGTGGTAGATCAGGTGACGGT | GCAAAAGGCATAATCATTAAACCAA |
Note: ‘UN’ means the gene sequence has no hit in GenBank.
以已筛选到的阳性DNA作为模板,用引物STR13F/R和STR32F/R进行常规PCR扩增。25 μL的PCR体系为:自制灭菌ddH2O 17.6 μL,10×Taq buffer (含Mg2+,TianGen)、dNTPs (2.5 mmol/L,TianGen)分别2.5 μL,正反向引物混合液(10 μmol/L) 1 μL,Taq DNA聚合酶(2.5 mol/μL) 0.4 μL,含 10-20 ng的DNA模板1 μL;用Bio-Rad热循环仪(C1000TM Thermal Cycler)进行PCR扩增,程序为:95 °C 5 min;95 °C 30 s,56 °C 30 s,72 °C 30 s,34个循环;72 °C 7 min。用1%的琼脂糖凝胶检测PCR结果。
用6%聚丙烯酰胺凝胶电泳检测STR13F/R和STR32F/R的PCR产物,银染法染色后,清水洗涤、拍照。切取图 1所示的聚丙烯酰胺凝胶中的差异性条带并用改良法回收[17]。以回收的微量DNA为模板,用对应的原引物配制25 μL PCR体系(参照上述体系)进行重复扩增以扩大产物浓度,用1.2%的琼脂糖凝胶电泳分离扩增产物。
1.4 PCR产物回收、克隆、测序及序列分析与验证对于STR13F/R和STR32F/R的二次扩增产物,用AxyPrep DNA Gel Extraction Kit (AxyGen biosclences,Lot #05313KB1)回收琼脂糖凝胶中目的DNA的条带;用pEASY-T1 Cloning Kit试剂盒(Transgen,Lot #H10104)将回收产物直接与T-载体连接并转化大肠杆菌DH5α感受态细胞。每个PCR产物配制1管连接体系,转化后涂布1个含氨苄霉素的LB平板。从每个过夜培养的转化子平板上挑选5个单菌落到液体LB培养基中过夜培养;用目的基因引物和T载体通用引物分别以1 μL菌液为模板,PCR检测连接效果;选取2个经PCR检测为阳性的样品送上海生工生物工程有限公司测序。
测序所得序列经去除载体污染后用BLASTn和BLASTp软件分析(http://blast.ncbi. nlm.nih.gov/ Blast.cgi)。根据比对结果,对在GenBank中未找到匹配的序列(未知序列)作进一步分析:以引物UP2/DP2筛选出的分别8个阴性和阳性的砂糖橘、马水橘及分别5个阴性和阳性长春花DNA为模板;以STR13-22F/R、STR13-31F/R、STR32-30F/R为引物做PCR;PCR的体系和程序参照引物特性设定;用1%的琼脂糖凝胶检测PCR结果。
2 结果与分析 2.1 两对STR引物扩增产物的聚丙烯酰胺凝胶电泳多态性条带引物STR13F/R和STR32F/R分别扩增64个含“Ca. L. asiaticus”菌株的云南和广东样品,均能获得多态性谱带(图 1)。引物STR13F/R扩增产物的多态性较STR32F/R扩增产物丰富:扩增32个云南或广东省“Ca. L. asiaticus”菌株均获得多于20种类型(按条带数目和片段大小划分)的谱带(图 1A、C),而STR32F/R对64个样品的扩增仅获得4种类型的谱带(图 1B、D);引物STR13F/R扩增产物的条带数目为1-7个,而引物STR32F/R的扩增产物条带数目为1-4个(表 3)。

|
|
图 1
引物STR13F/R和STR32F/R的PCR产物聚丙烯酰胺凝胶电泳谱带
Figure 1
PAGE profile amplified by STR13F/R and STR32F/R
注:A:引物STR13F/R对32个来自广东样品的扩增结果;B:引物STR32F/R对32个来自广东样品的扩增结果;C:引物STR13F/R对32个来自云南样品的扩增结果;D:引物STR32F/R对32个来自云南样品的扩增结果. M为分子量标准(DSBIO,M1011);1-32:黄龙病材料的编号;箭头所示为回收并测序的条带. Note: A: PCR result of 32 samples from Guangdong using STR13F/R as primers; B: PCR result of 32 samples from Guangdong using STR32F/R as primers; C: PCR result of 32 samples from Yunnan using STR13F/R as primers; D: PCR result of 32 samples from Yunnan using STR32F/R as primers. M: DNA ladder (DSBIO, M1011); 1-32: Sample codes; Arrows were pointed to the bands further cloned and sequenced. |
| 引物名称 Primer | 样品采集地 Origin | 扩增产物的条带数目所占比率 Rate of different PCR band numbers (%) | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| STR13F/R | Guangdong | 25.00 | 40.60 | 15.60 | 9.38 | 6.25 | 3.13 | 0 |
| Yunnan | 6.25 | 9.38 | 31.30 | 9.38 | 18.80 | 15.70 | 9.38 | |
| STR32F/R | Guangdong | 90.60 | 9.38 | 0 | 0 | 0 | 0 | 0 |
| Yunnan | 75.00 | 0 | 21.90 | 3.13 | 0 | 0 | 0 | |
随机选取STR13F/R引物的50个扩增条带和STR32F/R的10个扩增条带进行回收、再扩增、克隆和测序。分别有42个(84%)和9个(90%)序列为目的基因CLIBASIA_01645和CLIBASIA_04555的序列。这些目的产物的序列差异性主要是由其短串联重复数目的不同造成的:42个CLIBASIA_01645基因的扩增产物中含1-5个、5-10个和10-20个短串联重复(TGTGTCT)的序列分别有6个、25个和11个;9个CLIBASIA_04555基因目的片段的序列中,分别有4个序列含有2个拷贝非串联重复序列(GTGAGATCGATATTGCA ATAGAAAACCTGCCTGAT),另5个扩增产物片段则含有3个该重复序列。且STR32F/R引物对采自云南香橼样品扩增的条带多含3个拷贝重复序列,而采自云南柠檬的样品多扩增出2个拷贝的该重复。STR13F/R引物对来自2省的4个品种扩增结果无明显的品种特异性。
2.3 非目的基因扩增产物的来源BLAST分析表明STR13F/R引物扩增的50条序列中,有6条来源于柑橘基因组。其中GD-31样品的大小为313 bp的扩增条带与脐橙叶绿体基因(Citrus sinensis chloroplast)序列相似率为94%;该条带的第9至303位碱基序列与脐橙叶绿体基因序列相似率为99% (图 1和表 4),与其余多个植物物种的核糖体蛋白L2 (Ribosomal protein L2,rpl2)基因的相似率也在95%以上,推测为柑橘基因组上的扩增。STR13F/R引物扩增的广东省22号和31号样品均获得多个PAGE条带,对其中最小条带的克隆和测序均获得1个在GenBank中搜索到匹配序列的未知序列(图 1A,表 4)。STR32F/R引物的10个扩增产物中有1个(图 1D中12的最大片段)为在GenBank中无匹配的未知序列(图 1和表 4)。
| 样品编号 Sample code | 症状 Symptom | 引物 Primer | 条带号 Band code | 片段大小 Size (bp ) | 短串联重复数目TRNs | 是否是“ Ca. L. asiaticus”序列 Hit in ‘ Ca. L. asiaticus’ genome |
| GD-22 | 均匀黄化 | STR13F/R | 1 | 188 | 6 | 是 |
| 2 | 181 | 5 | 是 | |||
| 3 | 147 | - | 否 | |||
| YN-12 | 典型斑驳 | STR32F/R | 1 | 492 | - | 否 |
| 2 | 229 | 3 | 是 | |||
| GD-31 | 均匀黄化 | STR13F/R | 1 | 313 | - | 否 |
| 2 | 211 | 9 | 是 | |||
| 3-1 | 169 | 3 | 是 | |||
| 3-2 | 166 | - | 否 |
Note: TRNs: Tandem repeat numbers; −: No TRNs.
根据以上实验结果,用以“未知序列”为模板设计的引物STR13-22F/R、STR13-31F/R、STR32-12F/R分别选取阳性和阴性的砂糖橘、马水橘及长春花DNA为模板进一步扩增;琼脂糖凝胶电泳结果(图 2)可见,对于STR13-22F/R引物,所有来自3种植物材料的“Ca. L. asiaticus”阳性或阴性的样品中均未能扩增到147 bp的目的条带,证明该序列来自样品GD-22的内生菌;同理,STR13-31F/R的扩增结果可见该目的序列来自GD-31样品的内生菌;STR32-12F/R则能从柑橘(砂糖橘和马水橘)来源样品扩增到458 bp的条带,而长春花中为阴性,可见该片段是柑橘基因组上的序列。综上表明,内生菌是造成PCR条带多样性的原因之一,“Ca. L. asiaticus”的不同寄主可引起PCR条带多样性。
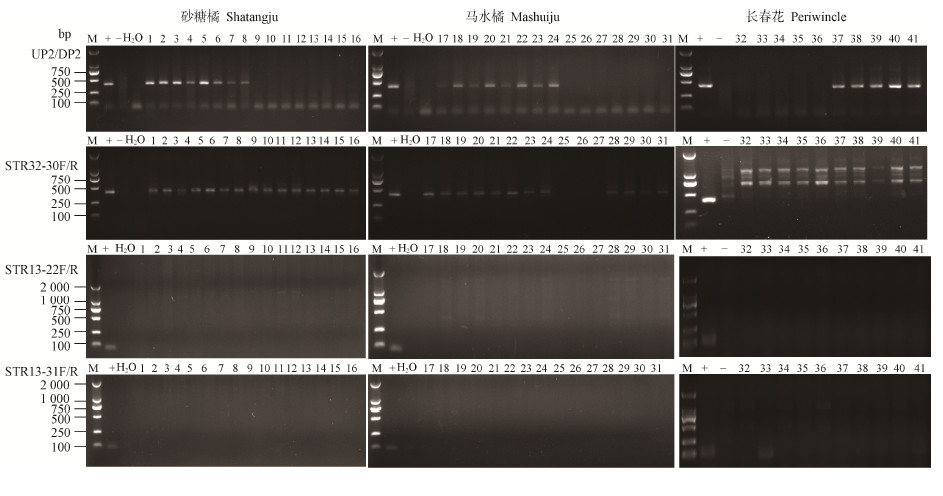
|
|
图 2
来源于不同寄主的黄龙病菌PCR产物琼脂糖凝胶电泳
Figure 2
Conventional PCR detection of ‘Ca L. asiaticus’ DNA samples collected from different host
注:M:Marker 2000 (DSBIO,Lot 082);+:阳性对照;−:阴性对照;H2O:空白对照;1−8:“Ca L. asiaticus”阳性的砂糖橘样品;9−16:“Ca. L. asiaticus”阴性的砂糖橘样品;17−24:“Ca. L. asiaticus”阳性的马水橘样品;25−31:“Ca. L. asiaticus”阴性的马水橘样品;32−36:“Ca. L. asiaticus”阳性的长春花样品;37−41:“Ca. L. asiaticus”阳性的长春花样品. Note: M: Marker 2000 (DSBIO, Lot 082); +: Positive control; −: Negative control; H2O: Blank; 1−8: ‘Ca L. asiaticus’ positive Shatangju DNA samples; 9−16: ‘Ca. L. asiaticus’ negtive Shatangju DNA samples; 17−24: ‘Ca. L. asiaticus’ positive Chuntianju DNA samples; 25−31: ‘Ca. L. asiaticus’ negtive Shatangju DNA samples; 32−36: ‘Ca. L. asiaticus’ positive periwinkle DNA samples; 37−41: ‘Ca. L. asiaticus’ negtive periwinkle DNA samples. |
PCR结合变性梯度凝胶电泳(Denatured gradient gel electrophoresis,DGGE)的方法被普遍应用于微生物种群研究,该方法的分辨率更高,但易出现不同序列的DNA共同迁移的现象[18]。陈章宝等[19]分析PCR-DGGE在鸡肠道微生物种群研究中的多条带,指出即使胶上肉眼可见的单一条带都可能是几种微生物菌株的DNA基因片段。Ma等[20]用普通PCR分析“Ca. L. asiaticus”上的一个STR基因的扩增产物,提出该菌的STR基因多样性现象。可见PCR产物的来源并非单一的。为消除宿主背景造成的非特异性扩增的影响,实验中应设置合适的阴性对照。通常做不同宿主来源样品的PCR时,人们习惯选择一个不含有目的基因的样品为阴性对照。本实验证明,应采用所有背景材料的阴性DNA作为对照的扩增结果才更可信。
植物内生菌是植物微生态系统组成部分,在“Ca. L. asiaticus”的寄主植物中普遍存在。除了柑橘属植物外,“Ca. L. asiaticus”还可以在九里香中存活,也可以通过菟丝子或嫁接等方式传播到长春花上。殷幼平等[21]用RFLP的方法分析九里香中的细菌种群,发现该寄主中可培养的细菌就有26株。类似地,长春花中也存在与“Ca. L. asiaticus”相关的内生菌群[22, 23]。郑雪芳等[24]用磷脂脂肪酸(PLFAs)生物标记法证明带有黄龙病原叶片内生菌PLFAs含量比健康植株叶片更大。用常规分离与分子鉴定方法,王爱华等[25]也从奥林达夏橙中获得10个属细菌类群,同样得出感染黄龙病的材料中内生菌种群更为丰富的结论。更有甚者,内生菌的种类和数量可能影响植物病害症状的显现[26]和病原菌的浓 度[27, 28]。可见,普遍存在的内生菌不仅是难培养菌的人工培养影响因素[29],还是难培养菌分子生物学研究中应考虑的潜在干扰因素。
| [1] | Jagoueix S, Bové JM, Garnier M. The phloem-limited bacterium of greening disease of citrus is a member of the α subdivision of the Proteobacteria[J]. International Journal of Systematic Bacteriology, 1994, 44(3): 397-386 |
| [2] | Zhao HY, Zhou YZ, Ge ZM, et al. Culture and characteristics of bacterium-like organism (BLO) from citrus yellow shoot[J]. Journal of Hunan University (Natural Science Edition), 1990, 12(1): 6-20 (in Chinese) 赵鸿燕, 周咏芝, 葛宗民, 等. 柑橘黄龙病病原类细菌 (Bacterium-like organism, BLO)的培养与性质[J]. 湖北大学学 报: 自然科学版, 1990, 12(1): 6-20 |
| [3] | Zhang JN, Liu ZJ, Cheng WW, et al. Studies on isolation culture and pathogenicity of yellow shoot disease of citrus of bacteria-like organism[J]. Scientia Agricultura Sinica, 1994, 27(2): 7-12 (in Chinese) 张景宁, 刘仲健, 程伟文, 等. 柑橘黄龙病病原类细菌分离培 养及其感病性研究[J]. 中国农业科学, 1994, 27(2): 7-12 |
| [4] | Davis MJ, Mondal SN, Chen H, et al. Co-cultivation of ‘Candidatus Liberibacter asiatieus’ with actinobacteria from citrus with Huanglongbing[J]. Plant Disease, 2008, 92: 1547-1550 |
| [5] | Sechler A, Schuenzel EL, Cooke P, et al. Cultivation of ‘Candidatus Liberibacter asiaticus’, ‘Ca. L. africanus’, and ‘Ca. L. americanus’ associated with Huanglongbing[J]. Phytopathology, 2009, 99(5): 480-486 |
| [6] | Chen J, Deng X, Sun X, et al. Guangdong and Florida populations of ‘Candidatus Liberibacter asiaticus’ distinguished by a genomic locus with short tandem repeats[J]. Phytopathology, 2010, 100(6): 567-572 |
| [7] | Katoh H, Subandiyah S, Tomimura K, et al. Differentiation of ‘Candidatus Liberibacter asiaticus’ isolates by variable-number tandem-repeat analysis[J]. Applied and Environmental Microbiology, 2011, 77(5): 1910-1917 |
| [8] | Katoh H, Davis R, Smith MW, et al. Differentiation of Indian, East Timorese, Papuan and Floridian ‘Candidatus Liberibacter asiaticus’ isolates on the basis of simple sequence repeat and single nucleotide polymorphism profiles at 25 loci[J]. Annals of Applied Biology, 2012, 160(3): 291-297 |
| [9] | Islam MS, Glynn JM, Bai Y, et al. Multilocus microsatellite analysis of ‘Candidatus Liberibacter asiaticus’ associated with citrus Huanglongbing worldwide[J]. BMC Microbiology, 2012(12): 39 |
| [10] | Matos LA, Hilf ME, Chen J, et al. Validation of ‘Variable Number of Tandem Repeat’-based approach for examination of ‘Candidatus Liberibacter asiaticus’ diversity and its applications for the analysis of the pathogen populations in the areas of recent introduction[J]. PLoS One, 2013, 8(11): e78994 |
| [11] | Liu R, Zhang P, Pu X, et al. Analysis of a prophage gene frequency revealed population variation of ‘Candidatus Liberibacter asiaticus’ from two citrus-growing provinces in China[J]. Plant Disease, 2011(95): 431-435 |
| [12] | Wang X, Zhou C, Deng X, et al. Molecular characterization of a mosaic locus in the genome of ‘Candidatus Liberibacter asiaticus’[J]. BMC Microbiology, 2012(12): 18 |
| [13] | Zhou L, Powell CA, Hoffman MT, et al. Diversity and plasticity of the intracellular plant pathogen and insect symbiont ‘Candidatus Liberibacter asiaticus’ as revealed by hypervariable prophage genes with intragenic tandem repeats[J]. Applied and Environmental Microbiology, 2011, 77(18): 6663-6673 |
| [14] | Wang X, Tan J, Bai Z, et al. Detection and characterization of miniature inverted-repeat transposable elements in ‘Candidatus Liberibacter asiaticus’[J]. Journal of Bacteriology, 2013, 195(17): 3979-3986 |
| [15] | Tan J, Wang XF, Su HN, et al. Genetic diversity of two hypervariable genes from prophage regions of ‘Candidatus Liberibacter asiaticus’ in China[J]. Scientia Agricultura Sinica, 2013, 46(18): 3784-3792 (in Chinese)谭锦, 王雪峰, 苏华楠, 等. 中国柑橘黄龙病病原菌两个原噬 菌体超变异基因遗传多样性[J]. 中国农业科学, 2013, 46(18): 3784-3792 |
| [16] | Xu M, Zheng Z, Li X, et al. Intraspecific genetic diversity analysis of ‘Candidatus Liberibacter asiaticus’ by short tandem repeats and PAGE[J]. Acta Phytopathologica Sinica, 2014, 44(6): 609-619 |
| [17] | Xu MR, Jia AL, Zheng Z, et al. Improving method in recovering and reamplifying the polymorphic PAGE band[J]. Journal of South China Agricultural University, 2015, 36(2): 117-120 (in Chinese) 许美容, 贾奥琳, 郑正, 等. 聚丙烯酰胺电泳条带中微量 DNA 片段的回收与再扩增方法的改进[J]. 华南农业大学学报, 2015, 36(2): 117-120 |
| [18] | Ercolini D. PCR-DGGE fingerprinting: novel strategies for detection of microbes in food[J]. Journal of Microbiology Methods, 2004, 56(3): 297-314 |
| [19] | Chen ZB, Xiang SN, Jiang ZX, et al. Analysis on causes of multi-bands in researching on microbe populations by PCR-DGGE[J]. Microbiology China, 2010, 37(1): 147-154 (in Chinese) 陈章宝, 向少能, 江震献, 等. PCR-DGGE 研究微生物种群中多条带产生原因分析[J]. 微生物学通报, 2010, 37(1): 147-154 |
| [20] | Ma W, Liang M, Guan L, et al. Population structures of ‘Candidatus Liberibacter asiaticus’ in southern China[J]. Phytopathology, 2014, 104(2): 158-162 |
| [21] | Yin YP, Li J, Lin YY, et al. Isolation and characterization of endophytic bacteria from huanglongbing’s hidden host plant- Murraya paniculata[J]. Microbiology China, 2012, 39(10): 1418-1427 (in Chinese) 殷幼平, 李佳, 林亚玉, 等. 柑橘黄龙病隐症寄主九里香内生 细菌分离及功能鉴定[J]. 微生物学通报, 2012, 39(10): 1418-1427 |
| [22] | Li J. Isolation and characterization of endophytic bacteria from Huanglongbing’s host plant—Murraya paniculata and Catharanthus roseus[D]. Chongqing: Master’s Thesis of Chongqing University, 2012 (in Chinese) 李佳. 柑橘黄龙病寄主植物内生细菌多样性分析及相关性研 究[D]. 重庆: 重庆大学硕士学位论文, 2012 |
| [23] | Li J, Yin YP, Zheng LP, et al. Isolation, identification and basic function analysis of plant associated bacteria from huanglongbing’s host plant—Catharanthus roseus[J]. Microbiology China, 2014, 41(5): 862-870 (in Chinese) 李佳, 殷幼平, 郑莉萍, 等. 柑橘黄龙病寄主长春花内生细菌 的分离及功能鉴定[J]. 微生物学通报, 2014, 41(5): 862-870 |
| [24] | Zheng XF, Liu B, Sun DG, et al. Plant endophyte PLFAs polymorphism in Huanglongbing-affected red pomelo plant[J]. Chinese Journal of Eco-Agriculture, 2012, 20(7): 932-944 (in Chinese) 郑雪芳, 刘波, 孙大光, 等. 柑橘黄龙病植株内生菌PLFAs 多 态性研究[J]. 中国生态农业学报, 2012, 20(7): 932-944 |
| [25] | Wang AH, Yin YP, Xiong HL, et al. Endophytic bacterial diversity analysis of Huanglongbing pathogen-infected citrus phloem tissue in Guangxi[J]. Scientia Agricultura Sinica, 2010, 43(23):4823-4833 (in Chinese) 王爱华, 殷幼平, 熊红利, 等. 广西柑橘黄龙病植株韧皮部内 生细菌多样性分析[J]. 中国农业科学, 2010, 43(23): 4823-4833 |
| [26] | Araújo WL, Marcon J, Maccheroni W Jr, et al. Diversity of endophytic bacterial populations and their interaction with Xylella fastidiosa in citrus plants[J]. Applied and Environmental Microbiology, 2002, 68(10): 4906-4914 |
| [27] | Lacava PT, Li WB, Araújo WL, et al. Rapid, specific and quantitative assays for the detection of the endophytic bacterium Methylobacterium mesophilicum in plants[J]. Journal of Microbiological Methods, 2006, 65(3): 535-541 |
| [28] | Sun DG. The polymorphism of endophytic bacteria community structure in Huanglongbing pathogen-infected citrus[D]. Fuzhou: Master’s Thesis of Fujian Normal University, 2012 (in Chinese) 孙大光. 柑橘黄龙病植株内生细菌群落结构多样性的研究[D]. 福州: 福建师范大学硕士学位论文, 2012 |
| [29] | Shi LJ, Xu LJ, Liu RJ. Recent advances in the study of culture-difficult fungi associated with plants and their cultural characteristics[J]. Microbiology China, 2011, 38(1): 110-117 (in Chinese) 史立君, 徐丽娟, 刘润进. 与植物共生的难培养菌物及其培 养特性研究进展[J]. 微生物学通报, 2011, 38(1): 110-117 |
 2015, Vol. 42
2015, Vol. 42