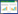扩展功能
文章信息
- 张驰, 宫婷, 杨超, 孙杨, 左振强, 宋存江
- ZHANG Chi, GONG Ting, YANG Chao, SUN Yang, ZUO Zhen-Qiang, SONG Cun-Jiang
- 假单胞菌合成聚合物和复杂化合物的种类及机理研究进展
- Progress in biosynthesis of polymers and complex compounds in Pseudomonas species-a review
- 微生物学通报, 2015, 42(3): 559-567
- Microbiology China, 2015, 42(3): 559-567
- 10.13344/j.microbiol.china.140479
-
文章历史
- 收稿日期: 2014-06-16
- 接受日期: 2014-08-19
- 优先数字出版日期(www.cnki.net): 2014-08-19
假单胞菌(Pseudomonas)属革兰氏阴性菌,无芽孢、多为直或稍弯的杆状。增殖速度快,生长范围广,大小介于(0.5-1.0) μm×(1.5-4.0) μm间,大部分为极生鞭毛,具运动性。营养需求简单,属异养需氧型,可对特定的氨基酸、天然化合物以及一些两性兼惰性的化合物进行代谢,部分菌株可产生水溶性荧光色素。
此外,假单胞菌属还可利用简单、廉价的碳源与氮源作为外源营养物合成具有工业用途的产物。除了初级代谢产物可作为某些化合物合成或降解的重要催化剂之外,假单胞菌还能合成多种次级代谢产物,主要包括:血红素、氢氰酸、藤黄绿脓菌素、鸡矢素、冠菌素、莫匹罗星、毒隐翅虫素、藻酸盐、维生素B12、环状脂肽、吩嗪、单乙酰基间苯三酚、2,4-二乙酰基间苯三酚、鼠李糖脂以及聚羟基脂肪酸酯等。
笔者选择了六类具有产业化前景或已实现产业化的复杂化合或聚合物,即:藻酸盐、维生素B12、环状脂肽、抗真菌代谢产物(吩嗪、2,4-二乙酰基间苯三酚)、鼠李糖脂以及聚羟基脂肪酸酯等为主要内容,对于它们的合成机制研究进展进行了综述,并就其合成研究的发展方向进行了展望。
1 藻酸盐藻酸盐(Alginate)又名褐藻酸钠,是从海带中提取出的一种多糖碳水化合物,是一种安全的食品添加剂,广泛应用于医药、食品、纺织、化工等多个领域[1]。据报道,藻酸盐具有抗氧化、抗癌、降低胆固醇以及免疫调节等方面的作用,对于糖尿病、高血压、肿瘤等疾病的治疗具有一定的功效。
藻酸盐主要由糖亚基和金属离子所构成。其糖亚基部分是由D-甘露糖醛酸(D-Mannuronic acid)与L-古洛糖醛酸(L-Guluronic acid)组成的一种聚糖醛酸,称为藻酸(Alginic acid,图1)。藻酸是褐藻类细胞壁成分的多糖,通过β-1,4-键糖苷键使聚甘露酸区域(-M-M-M-M-)、聚古洛糖区域(-G-G-G-G-)或杂聚区域(-M-G-M-G-M-M-G)相链接。
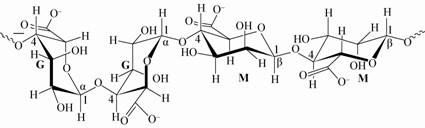
|
| 图1 藻酸盐结构 Figure.1 Structure of alginate |
早在19世纪,人们就从海洋藻类中分离出了藻酸盐,但是直到20世纪60年代,才发现铜绿假单胞菌(Pseudomonas aeruginosa)可合成藻酸盐。
然而并不是所有的铜绿假单胞菌都能产生藻酸盐,只有具有粘性的铜绿假单胞菌才具有合成藻酸盐的能力。这是因为控制藻酸盐合成的操纵子algD在绝大多数的铜绿假单胞菌株中都处于沉默状态,在粘性菌株中却具有高度活性[2]。algD操纵子是一个靠近argF基因受σ22启动子(由algT基因编码)控制表达的基因簇,由12个基因所组成的[3]。algD操纵子的调控具有高度的复杂性与多样性,需要众多的调控子参与调控表达[4],其中:algR、algZ及algB为主要的3个调控子。algR是典型的二组分(Two-compent)调控子,与algZ构成algR-algZ操作子,从而影响algD的转录;algB则是藻酸盐合成克隆的第一个基因,对algD有正调控作用。
但是,铜绿假单胞菌在合成藻酸盐的过程中,不是直接合成藻酸盐,而是首先利用6-磷酸果糖合成藻酸盐的前体——核苷二磷酸糖(Nucleoside diphospho-sugar,NDP-sugar)和GDP-甘露糖醛酸。AlgA、AlgC以及AlgD则是作为前体合成过程中 的3个关键酶。AlgC虽然不是algD操纵子基因簇中基因所编码的产物,但是也具有正调控作用[5]。首先,铜绿假单胞菌中的一些具有聚合化的酶(Alg8,结构类似于β-糖基转移酶)[5]对核苷二磷酸糖和GDP-甘露糖醛酸进行聚合作用,合成一种高聚化合物——聚甘露糖醛酸(Polymannuronate,polyM)。随后,具有高聚合D-甘露糖醛酸C5差相异构酶特性的AlgG酶,将D-甘露糖醛酸(M)转换成L-古洛糖醛酸(G)。最终,在β-1,4链接酶以及Alg8的催化下[6],形成藻酸盐。而algD操纵子基因簇中的algE和algK基因则可以分别编码生成大小为54 kD和52 kD具有信号肽蛋白结构,参与藻酸盐的胞外运输。AlgE是具有信号肽蛋白结构包覆的膜外复合体结构,可以进入平面脂双层,并形成β折叠,随后形成一个金属离子通道,加强对藻酸盐的选择运 输[7]。AlgK则是一种TPR-蛋白[8]—— 一种新的胞外多糖分泌的周质组分,能够与AlgX以及MucD形成一种具有脂蛋白结构的多蛋白复合体[9]。此外,藻酸盐的合成还需要一些酶、转录因子、调节基因和通道蛋白等共同调节[10, 11],是一个多因子共同参与的过程,如,MucA蛋白突变可解除褐藻多糖合成操纵子转录的抑制作用,进而合成褐藻多糖(图2)。
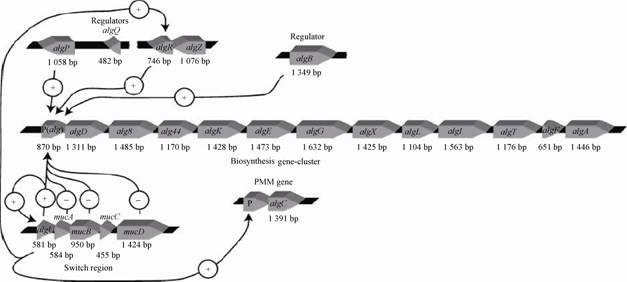
2 维生素B12维生素B12 (Vitamin B12,VB12),是一种由含钴的卟啉类化合物组成的B族维生素,是迄今为止发现的最为复杂的四吡咯化合物[12](图3)。它能促进红细胞的发育和成熟,参与DNA的合成,脂肪、碳水化合物及蛋白质的代谢,增加核酸与蛋白质的合成,主要用于防治恶性贫血。一般在工业生产中使用的工程菌株为脱氮假单胞菌(Pseudomonas denitrificans),是一种具有脱氮功能的假单胞菌,其VB12产量可达100-160 mg/L。
VB12的合成过程十分复杂。首先,谷氨酸在谷胺酰-tRNA合成酶的催化下,形成谷胺酰-tRNA,谷胺酰-tRNA在谷胺酰-tRNA脱氢酶(HemA)的作用下,合成谷胺醛(Glutamate 1-semialdehyde,GSA),再经谷胺醛氨基转移酶的催化合成所有四吡咯的共同前体——5-氨基乙酰丙酸(5-Aminolevuinic acid,5-ALA)[13]。随后,在ALA脱水酶(HemB)、胆色素原脱氨酶(HemC)、尿卟啉原Ⅲ合成酶(HemD)以及5个依赖于SAM (S-腺苷-L-甲硫氨酸)的甲基转移酶(CobA,CobG,CobJ,CobM和CobF)与单加氧酶的共同催化下,与氧原子结合,形成前咕啉6 (Precorrin 6)。
前咕啉6再经还原(CobK)、甲基化(CobH)、脱羧、甲基重排、酰胺化(CobB)以及依赖于ATP的钴鏊合酶(CobNST)共同作用下,得到具有钴元素的中间体——钴(Ⅱ)啉酸a,c-二酰胺(Cob(II) yrinic aci d a,c-diamide)。最终,在CobQ等相关酶的催化下,再次对钴(Ⅱ)啉酸a,c-二酰胺进行还原、腺苷化、酰胺化,合成腺苷钴胺素(Ado-cobyric acid)——VB12的最终前体。
而正是由于VB12复杂的合成途径,也使其整个调控机制较为繁复。cobF-cobM基因簇操纵子以及cobA、cobE基因可以调控钴胺素的积累;增强型的启动子以及高效的核糖体结合位点,则能够有效增加Cob蛋白的表达量。一些前体(如:甘氨酸、苏氨酸、甜菜碱)能够促进VB12的合成,而另一些前体则存在底物抑制作用(如:cobA基因所编码的转甲基酶)。此外,发酵条件对VB12的合成也具有很大的影响,特别是对好氧菌P. denitrificans来讲,氧是整个代谢过程中的关键因素:发酵前期高氧条件,有利于菌体的生长以及VB12合成的启动;发酵后期低氧条件,有利于VB12的快速大量合成[14]。
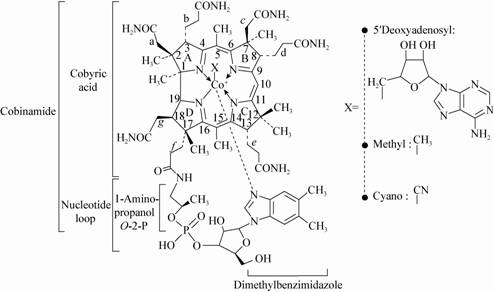
3 环状脂肽环状脂肽(Cyclic lipopeptides,CLP)是一类结构相似的化合物,由寡肽通过相邻氨基酸环化形成的内酯环与脂肪酸连接而成(图4)。CLP是微生物的次级代谢产物,能够有效降低界面张力,具有表面活性剂作用;并具有抗真菌、抗肿瘤等药物特性,在医药领域具有广阔的应用前景。由于脂肪酸长度、修饰方式,氨基酸数量、类型以及内酯环多样性等,也使得CLP具有多样的结构变化。
许多具有荧光性质的假单细胞能够合成CLP,包括荧光假单胞菌(Pseudomona fluorescence)和丁香假单胞菌(Pseudomonas syringae)等。前者是一种重要的植物根际促生细菌,其中一些菌株具有促进植物生长和防治病害的作用,能够合成Viscosin group、Amphisin group、Tolaasin group这3种CLP。后者则是CLP中Syringomycin group的主要合成菌株,这类菌株常用于防治外源生物入侵和人工造雪。
假单胞菌合成CLP,多是依赖于一大类称为缩氨酸合成酶(Peptide synthetases)的多功能酶。这些酶作用于多转运硫模板机制,属于非核糖体依赖氨基酸合成机制的一种,具有较低的专一[14]。部分生产CLP的菌株即使没有特定的底物,也能合成CLP类似物[16]。整个合成过程可以分为3步:(1) 特定的酶复合体识别相对应的氨基酸结构,并对其进行甲基化修饰;(2) 硫化修饰使各个模块间的稳定性增强并利用硫模块将其进行转运;(3) 利用缩氨基作用将各个前体缩合在一起。
CLP的合成主要受Gac two-component (gacS/gacA)调节系统所控制[17],但也受到其他因素的调控,例如:生长阶段、碳源、营养物质以及特定的信号分子或者环境信号[18],不同类型的CLP合成菌株之间的调控基因不尽相同,调控程度也有所不同:viscosinamide只在P. fluorescence对数生长期积累;提高碳源、氮源、磷源则能有效提高viscosinamide与tensin的产量;syringomycin、amphisin的合成则主要受到植物根系分泌物以及植物信号分子的调控。
4 抗真菌代谢产物真菌是引起植物病害的主要微生物类群。假单胞菌合成的抗真菌代谢产物可分为两类:吩嗪(Phenazine)和2,4-二乙酰基间苯三酚(2,4-Diacetylphloroglucinol,DAPG)。
4.1 吩嗪吩嗪(C12H8N2或C6H4N2C6H4)是一种二苯并吡嗪,结构类似蒽,仅中间环的2个次甲基为氮原子代替(图5)。该结构具高度稳定性,但在其杂环位置具有多种修饰方式。虽然吩嗪类化合物抗真菌作用的机制尚不清楚,但普遍认为其能够通过自由扩散的方式进入细胞膜内,抑制氧化还原作用。
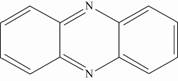
|
| 图5 吩嗪分子结构式 Figure.5 The structure of phenazine |
合成机制可以概括为:首先,假单胞菌利用芳香族氨基酸合成吩嗪的前体——羧酸吩嗪(Phenazine carboxylic acids,PCA)[19],随后,在不同酶的催化下对PCA进行修饰,进而合成具有不同抗真菌效果的吩嗪类化合物。在具有合成吩嗪能力的假单胞菌中,都存在一组相对保守的基因簇phzXYABCDEFG。PhzC伴随着aro基因(aroD,aroB,aroE,aroL,aroA,aroC)的组成型表达上调莽草酸途径(Shikimic acid pathway),为吩嗪的合成提供大量的前体——分支酸(Chorismic acid);PhzE则起到类似邻氨基苯甲酸盐合成酶(Anthranilate synthase,AS)的作用,催化分支酸生成氨基脱氧异分支酸(Aminodeoxyisochorismate acid,ADIC);在PhzD的催化下生成3-羟基氨基苯甲酸(3-hydroxyanthranilic);最终,由PhzF和PhzG催化其生成PCA的前体——1,6二羧酸吩嗪(Phenazine-1,6-dicarboxylic acids)[20]。虽然这些基因簇中的部分基因功能尚不明确(如phzA,phzB,phzZ ,phzY),但其主要功能都是合成相关的修饰酶,对产物进行修饰。然而,不同的假单胞菌也存在一些特定的基因。例如,phzO基因只存在于金霉素假单胞菌(Pseudomonas aureofacien)中,其能编码一个 55 kD的芳香族单一加氧酶,对PCA进行修饰。phzH则在绿针假单胞菌(Pseudomonas chlororaphis)具有类似于天冬酰胺合成酶的作用,催化1-羧酸-吩嗪生成1-甲酰胺 - 吩嗪。
4.2 2,4-二乙酰基间苯三酚单乙酰间苯三酚(Monoacetyl phloroglucinol,MAPG)和2,4-二乙酰基间苯三酚(2,4-Diacetyphloroglucinol,DAPG/PHL)是一类高效广谱多酮类抗生素。DAPG的合成主要受基因簇phlACBD的操控[21],而其在转录和翻译水平上,还受到上游基因以及GacS/GacA,小RNA因子RsmA和PrrB等多个调控系统的调控。在DAPG合成基因簇phlACBD中,phlACB共同编码一个种乙酰基转移酶,phlD则具有高度的保守性,能够催化丙二酸单酰CoA和乙酰CoA生产DAPG前体物质乙酰间苯三酚(Monoacetylphloroglucinol,MAPG) (图6)。
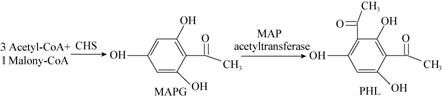
|
| 图6 P. fluorescence中PHL的合成过程 Figure.6 Biosynthess pathway of PHL in P.fluorescence |
同吩嗪一样,假单胞菌中有关DAPG合成的基因虽然相对保守,但也具有一定的多样性。例如:P. fluorescence F113和Q2-87中存在phlE和phlF基因,参与DAPG的合成[22]。phlE基因是位于phlACBD基因簇下游的一个独立于该基因簇的ρ因子依赖型终止子;phlF基因则对DAPG合成具有阻遏作用。除此之外,在生产DAPG时也受到了细胞间信号系统、胞外酶、毒力因子等群体效应或密度压力的调控,但与大部分微生物次级代谢产物不同的是,DAPG在对数生长期的末期或稳定期的初期就可以达到最大积累量,随着菌体生长,含量会有所下降。
5 鼠李糖脂鼠李糖脂(Rhamnolipid)是一种极具工业应用潜力的可降解性表面活性剂,广泛应用于食品工业以及化工行业,作为乳化剂、清洗剂或者洗涤剂使用,是一种环境友好型的化学替代物[23]。目前,鼠李糖脂已经采用基因工程菌株——假单胞菌中鼠李糖脂合成相关的基因簇在大肠杆菌进行异源表 达——规模化工业生产。
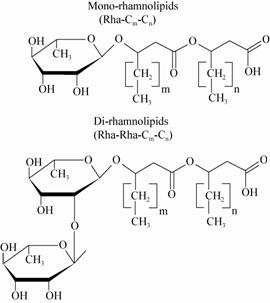
|
| 图7 单鼠李糖脂和双鼠李糖脂分子结构式 Figure.7 The structure of mono- and di-rhamnolipids |
鼠李糖脂是由一个或两个β-羟基疏水脂肪酸通过β-糖苷与一到两个鼠李糖分子链接形成(图7)。而根据鼠李糖个数的不同可以分为单鼠李糖脂和双鼠李糖脂。
能够生产鼠李糖脂的微生物并不多,主要是利用P. aeruginosa进行鼠李糖脂的生产。鼠李糖脂中的鼠李糖部分是通过对6-P-葡萄糖进行一个5步连续的酶催化作用得到的;鼠李糖脂中的β-羟基疏水脂肪酸部分则是源于脂肪酸的从头合成。在整个合成的过程中,主要包括3个关键的酶促反应:首先,β-羟基疏水脂肪酸在RhlA (3-Hydroxyacyl-ACP:3- Hydroxyacyl-ACP-3-hydroxyacyl-transferase)的催化作用下相互连接;随后,I型鼠李糖脂转移酶(RhlB)催化生成单鼠李糖脂。而II型鼠李糖脂转移酶(RhlC)则可以在单鼠李糖脂的基础上再添加一个鼠李糖结构,从而生成双鼠李糖脂。而针对鼠李糖脂合成调控机制的研究发现,rhlA、rhlB受到同一启动子的调控,但rhlC启动子还不明确;σ54因子、RhlI/R以及群体效应或磷源、氮源的限制都对整个的合成过程都具有调控作用[24, 25]。
6 聚羟基脂肪酸酯(Polyhydroxyalkanoates,PHA)PHA是微生物在失去营养平衡条件下,如碳源过量,氮源、磷源、氧受到限制时,在胞内形成的聚酯类颗粒,由具有磷脂包膜的聚脂肪酸酯以及覆盖在其表面的颗粒相关蛋白(Granule associated proteins,GAPs)所构成的。由于PHA可以作为细胞内碳源以及能源物质存储,因此也常被认为是一种原核细胞的亚细胞器结构,称为Carbonosomes。根据PHA单体结构中含有碳的个数,主要分为C4-C5的短链PHA (Short-chain-length-PHA,scl-PHA)以及C6-C12的中长链PHA (Medium-chain-length,mcl-PHA)[26]。
PHA具有较强的光学活性、弹性、质轻、可塑性、耐磨性、生物可降解性和生物相容性等,因此也被广泛地应用于众多领域,例如:生物降解性包装材料、组织工程材料、缓释材料及电化学材料等方面[27],被认为是一种具有潜在利用价值的生物技术以及医药生物材料。
20世纪80年代以来,人们已经发现300多种细菌,可以利用80多种不同的脂肪酸作为单体合成PHA,但目前工业中用于生产PHA的微生物菌种仍以假单胞菌为主。假单胞菌合成PHA的途径主要可分为两类:(1) 脂肪酸的β-氧化合成途径;(2) 脂肪酸从头合成途径。在脂肪酸的β-氧化途径合成中:脂肪酸被氧化为脂酰辅酶A (Acetyl-CoA);随后,脂酰辅酶A发生还原反应,生成烯脂酰辅酶A (Malonyl-CoA);烯脂酰辅酶A则在水合酶的作用下转化为(S)-3-羟基辅酶A (3-Hroxyacyl-ACP);而(S)-3-羟基辅酶A则被异构酶转化为PHA合成底物——(R)-3-羟基辅酶A;最终在PHA合酶的催化下合成PHA。当然,并不是所有的(S)-3-羟基辅酶A都用于PHA的合成,也有一部分(S)-3-羟基辅酶A被转化为3-酮基脂酰辅酶A (3-Ketoacyl-CoA),进入下一个β-氧化循环(图8)。
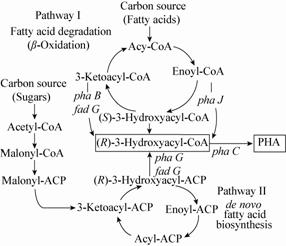
|
| 图8 假单胞菌 PHA 生物合成过程 Figure.8 Biosynthess pathway of PHA in Pseudomonas |
虽然PHA在结构及种类上具有很高的多样性,但在假单胞菌中,参与PHA的合成过程以及调控的基因都相对比较保守,主要包括:phaC、phaZ、phaI、phaF和phaD。phaC是PHA合酶基因,部分假单胞菌中存在两个不同的phaC基 因——phaC1和phaC2,二者之间具有80%作用的同源性,被PHA解聚酶基因(phaZ)隔开。位于合酶基因簇下游的phaD基因,可能编码一种与维持PHA颗粒稳定性有关的结构蛋白。phaI和phaF基因,是两个反向转录的基因,对胞内PHA颗粒表面蛋白分布及PHA分离与定位有关[28, 29]。除此之外,最近的研究还发现,PhaJ和FabG参与构建了脂肪酸的β-氧化与PHA生物合成之间的代谢通 路[30];PhaG和FabD则可以将脂肪酸从头合成途径的中间产物作为PHA合成过程中的底物[31],从而将二者联系起来。而从细菌的整体调控来看,部分代谢中间产物,碳源流动,氧化还原电位以及Gac/Rsm级联调控系统都对PHA合成具有一定的影响[32]。
假单胞菌除了可合成上述物质外,还可以合成其他具有商业价值的复杂化合物和聚合物,如,用于防治植物病害的氢氰酸、藤黄绿脓菌素;在癌症及肿瘤研究中具有重要意义的毒隐翅虫素;能够提高植物抗逆性的冠菌素以及天然的广谱抗生素假单胞菌酸A等。显然,假单胞菌在生物合成方面具有巨大的潜力。
虽然部分复杂化合物和聚合物由于产量过低,不适用于工业化生产,但笔者认为解决这一问题需要从以下两点出发,相辅相成,最终达到提高产量产业化生产的目的,即:
(1) 优化发酵条件。部分复杂化合物和聚合物的合成与菌株所需生长状态、生长环境具有很大的关系,因此应探究最佳营养物质、底物浓度、供氧时间等因素,探究最适发酵条件;
(2) 基于分子生物学与合成生物学理念进行优质菌种的构建。传统菌种诱变方法,多集中于利用紫外诱变和化学诱变等随机诱变手段,但随着分子生物学与合成生物学的不断发展,研究者们已经可以定向构建更为高产的目的菌种:① 采用合成生物学技术、启动子工程技术对野生菌进行代谢途径改造,例如,利用增强型启动子以及高效核糖体结合位点等,有效增加目的基因与蛋白的表达量;② 目的基因进行异源多拷贝表达,例如,P. denitrificans中异源表达来自Methanobacterium ivanovii的corA基因,避免底物抑制作用[33]。
笔者所在的课题组发现了一株能够利用非相关性碳源(葡萄糖)发酵生产mcl-PHA与褐藻寡糖双产物的门多萨假单胞菌NK-01 (Pseudomonas mendocina NK-01)[34, 35]。我们深信,随着代谢工程和合成生物学技术的不断发展,以假单胞菌生产复杂化合物和聚合物的种类将越来越多。另外,以假单胞菌为目的菌株,构建基盘细胞,再装配以各种产物模块,将会在工业生产中发挥越来越重要的作用。
| [1] | Wang YY, Guo WB, Wang SF, et al. Research progress on biological activities and applications of alginate oligosaccharide[J]. Food and Fermentation Industries, 2010, 36(10): 122-126 (in Chinese) 王媛媛, 郭文斌, 王淑芳, 等. 褐藻寡糖的生物活性与应用 研究进展[J]. 食品与发酵工业, 2010, 36(10): 122-126 |
| [2] | Deretic V, Gill JF, Chakrabarty AM. Gene algD coding for GDP mannosedehydrogenase is transcriptionally activated in mucoid Pseudomonas aeruginosa[J]. Journal of Bacteriology, 1987, 169(1): 351-358 |
| [3] | Stover CK, Erwin AL, Mizoguchi SD, et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic athogen[J]. Nature, 2000, 406(6799): 959-964 |
| [4] | Remminghorst U, Hay ID, Rehm BH. Molecular characterization of Alg8, a putative glycosyltransferase, involved in alginate polymerisation[J]. Journal of Bacteriology, 2009, 140(3/4): 176-183 |
| [5] | Ryder C, Byrd M, Wozniak DJ. Role of polysaccharides in Pseudomonas aeruginosa biofilm development[J]. Current Opinion in Microbiology, 2007, 175(6): 5452-5459 |
| [6] | Rehman ZU, Wang Y, Moradali MF, et al. Insights into the assembly of the alginate biosynthesis machinery in Pseudomonas aeruginosa[J]. Applied and Environmental Microbiology, 2013, 79(10): 3264-3272 |
| [7] | Rehman ZU, Rehm BH. Dual roles of Pseudomonas aeruginosa AlgE in secretion of the virulence factor alginate and formation of the secretion complex[J]. Applied and Environmental Microbiology, 2013, 79(6): 2002-2011 |
| [8] | Keiski CL, Harwich M, Jain S, et al. AlgK is a TPR-containing protein and the periplasmic component of a novel exopolysaccharide secretin[J]. Structure, 2010, 18(2): 265-273 |
| [9] | Hay ID, Schmidt O, Filitcheva J, et al. Identification of a periplasmic AlgK-AlgX-MucD multiprotein complex in Pseudomonas aeruginosa involved in biosynthesis and regulation of alginate[J]. Applied Microbiology Biotechnology, 2012, 93(1): 215-227 |
| [10] | Jain S, Ohman DE. Role of an alginate lyase for alginate transport in mucoid Pseudomonas aeruginosa[J]. Infection and Immunity, 2005, 73(10): 6429-6436 |
| [11] | Riley LM, Weadge JT, Baker P, et al. Structural and functional characterization of Pseudomonas aeruginosa AlgX: role of AlgX in alginate acetylation[J]. The Journal of Biological Chemistry, 2013, 288(31): 22299-22314 |
| [12] | Warren MJ, Raux E, Schubert HL, et al. The biosynthesis of adenosylcobalamin (vitamin B12)[J]. Natural Products Report, 2002, 19(4): 390-412 |
| [13] | Zhang YM, Wang L, Wang YS, et al. Research on biosynthesis of vitamin B12[J]. Food and Fermentation Industries, 2005, 31(9): 70-73 (in Chinese) 张玉明, 王雷, 王云山, 等. 维生素B12的研究进展[J]. 食品 与发酵工业, 2005, 31(9): 70-73 |
| [14] | Wang ZJ, Wang HY, Li YL, et al. Improved vitamin B(12) production by step-wise reduction of oxygen uptake rate under dissolved oxygen limiting level during fermentation process[J]. Bioresource Technology, 2010, 101(8): 2845-2852 |
| [15] | Li W, Rokni-Zadeh H, De Vleeschouwer M, et al. The antimicrobial compound xantholysin defines a new group of Pseudomonas cyclic lipopeptides[J]. PLoS One, 2013, 8(5): e62946 |
| [16] | Tran H, Ficke A, Asiimwe T, et al. Role of the cyclic lipopeptide massetolide A in biological control of Phytophthora infestans and in colonization of tomato plants by Pseudomonas fluorescens[J]. New Phytologist, 2007, 175(4): 731-742 |
| [17] | de Bruijn I, Raaijmakers JM. Diversity and functional analysis of LuxR-type transcriptional regulators of cyclic lipopeptide biosynthesis in Pseudomonas fluorescens[J]. Applied and Environmental Microbiology, 2009, 75(14): 4753-4761 |
| [18] | Mazzola M, de Bruijn I, Cohen MF, et al. Protozoan-induced regulation of cyclic lipopeptide biosynthesis is an effective predation defense mechanism for Pseudomonas fluorescens[J]. Applied and Environmental Microbiology, 2009, 75(21): 6804-6811 |
| [19] | Qu L, Liu HZ, Hu HB, et al. The biosynthesis of natural phenazine[J] Chinese Journal of Antibiotics, 2010, 35(3): 168-174 (in Chinese) 屈丽, 刘宏志, 胡洪波, 等. 天然吩嗪化合物的生物合成[J]. 中国抗生素杂志, 2010, 35(3): 168-174 |
| [20] | Culbertson JE, Toney MD. Expression and characterization of PhzE from P. aeruginosa PAO1: aminodeoxyisochorismate synthase involved in pyocyanin and phenazine-1-carboxylate production[J]. Biochimica et Biophysica Acta, 2013, 1834(1): 240-246 |
| [21] | Wei HL, Zhou HY, Zhang LQ, et al. Experimental evidence on the functional agent of 2,4-diacetylphloroglucinol in biocontrol activity of Pseudomonas fluorescens 2P24[J]. Acta Microbiologica Sinica, 2004, 44(5): 663-666 (in Chinese) 魏海雷, 周洪友, 张力群, 等. 抗生素2,4-二乙酰基间苯三酚 作为荧光假单胞菌2P24菌株生防功能因子的实证分析[J]. 微 生物学报, 2004, 44(5): 663-666 |
| [22] | Frapolli M, Pothier JF, Défago G, et al. Evolutionary history of synthesis pathway genes for phloroglucinol and cyanide antimicrobials in plant-associated fluorescent pseudomonads[J]. Molecular Phylogenetics and Evolution, 2012, 63(3): 877-890 |
| [23] | Wu H, Wang W, Han SY. Recent progress on rhamnolipid biosurfactant[J]. Microbiology China, 2007, 34(1): 148-152 (in Chinese) 吴虹, 汪薇, 韩双艳. 鼠李糖脂生物表面活性剂的研究进展 [J]. 微生物学通报, 2007, 34(1): 148-152 |
| [24] | Müller MM, H?rmann B, Syldatk C, et al. Pseudomonas aeruginosa PAO1 as a model for rhamnolipid production in bioreactor systems[J]. Applied Microbiology and Biotechnology, 2010, 87(1): 167-174 |
| [25] | Wittgens A, Tiso T, Arndt TT, et al. Growth independent rhamnolipid production from glucose using the non-pathogenic Pseudomonas putida KT2440[J]. Microbial Cell Factories, 2011, 10: 80 |
| [26] | Castiho LR, Mitchell DA, Freire DM. Production of polyhydroxyalkanoates (PHAs) from waste materials and by-products by submerged and solid-state fermentation[J]. Bioresource Technology, 2009, 100(23): 5996-6009 |
| [27] | Chen GQ, Wu Q. The application of polyhydroxyalkanoates as tissue engineering materials[J]. Biomaterials, 2005, 26(33): 6565-6578 |
| [28] | Dinjaski N, Prieto MA. Swapping of phasin modules to optimize the in vivo immobilization of proteins to medium-chain-length polyhydroxyalkanoate granules in Pseudomonas putida[J]. Biomacromolecules, 2013, 14(9): 3285-3293 |
| [29] | Maestro B, Galán B, Alfonso C, et al. A new family of intrinsically disordered proteins: structural characterization of the major phasin PhaF from Pseudomonas putida KT2440[J]. PLoS One, 2013, 8(2): e56904 |
| [30] | Vo MT, Lee KW, Jung YM, et al. Comparative effect of overexpressed phaJ and fabG genes supplementing (R)-3-hydroxyalkanoate monomer units on biosynthesis of mcl-polyhydroxyalkanoate in Pseudomonas putida KCTC1639[J]. Journal of Bioscience and Bioengineering, 2008, 106(1): 95-98 |
| [31] | Lee S, Jeon E, Jung Y, et al. Heterologous co-expression of accA, fabD, and thioesterase genes for improving long-chain fatty acid production in Pseudomonas aeruginosa and Escherichia coli[J]. Applied Biochemistry and Biotechnology, 2012, 167(1): 24-38 |
| [32] | Ryan WJ, O’Leary ND, O’Mahony M, et al. GacS-dependent regulation of polyhydroxyalkanoate synthesis in Pseudomonas putida CA-3[J]. Applied and Environmental Microbiology, 2013, 79(6): 1795-1802 |
| [33] | Stamford NP, Crouzet J, Cameron B, et al. Biosynthesis of vitamin B12: the preparative multi-enzyme synthesis of precorrin-3A and 20-methylsirohydrochlorin (a 2,7,20-trimethylisobacteriochlorin)[J]. Biochemical Journal, 1996, 1(313): 335-342 |
| [34] | Tao J, Zheng CG, Song CJ, et al. Synthesis of medium-chain-length polyhydroxyalkanoate (PHAMCL) by Pseudomonas mendocina NK-01[J]. Microbiology China, 2008, 35(5): 782-787 (in Chinese) 陶剑, 郑承纲, 宋存江, 等. 利用门多萨假单胞菌NK-01合成 中长链聚羟基脂肪酸酯(PHAMCL)[J]. 微生物学通报, 2008, 35(5): 782-787 |
| [35] | Guo W, Song C, Kong M, et al. Simultaneous production and characterization of medium-chain-length polyhydroxyalkanoates and alginate oligosaccharides by Pseudomonas mendocina NK-01[J]. Applied Microbiology and Biotechnology, 2011, 92(4): 791-801 |
 2015, Vol. 42
2015, Vol. 42